青霉素生产工艺优化及代谢分析提高产量
李云龙 唐文俊 白成海 黄明志,2,* 储炬,2 庄英萍,2
(1 华东理工大学生物反应器工程国家重点实验室,上海 200237;2 过程系统工程教育部工程研究中心,上海 200237;3 呼伦贝尔北方药业有限公司,牙克石 022150 )
自1929年弗莱明首次发现青霉素,距今已有近90年历史,作为第一个被发现的β-内酰胺类抗生素,青霉素仍然发挥着极其重要的作用。青霉素的工业化生产也已经进行了60多年,通过菌种改造和发酵工艺优化,现在青霉素产率较最初发现的原始菌株得到了极大提高[1]。其成本也有了大幅度降低,由最初的每10亿单位数百美元到现在的不足10美元[2]。青霉素由一种昂贵的珍稀化工产品变为现在廉价的大宗化工产品[3]。
青霉素的工业生产方式采用多级补料分批发酵工艺[4],在发酵过程中流加补入葡萄糖、苯乙酸、硫酸铵等料液,同时通过带放操作来控制发酵体积。通过控制流加培养液的速率,维持发酵液中的葡萄糖浓度始终处于极低浓度水平,既可以保证菌体生长,同时又不会对青霉素代谢形成阻遏作用[5]。青霉素的合成受溶解氧、溶解二氧化碳、pH、氨氮、碳源的调控,这些调控的产生不仅与搅拌、通气、培养基组分有关,更受补料方式的影响[6]。有研究表明,菌体的形态与其所处的微观及宏观环境密切相关,环境的改变会导致细胞形态和生理代谢发生全局性的改变[7-8]。
传统青霉素发酵周期约为150h,至菌丝自溶前发酵单位基本达到最高时放罐产量得率最大[9]。通常在发酵至150h后菌体形态开始发生明显变化,包括菌体对于糖的利用度、菌量合成以及发酵液流变特性都随之发生变化,并且此阶段青霉素合成速率快速降低。研究表明,把前中期的发酵液作为种子进行再培养,即“倒种”,在充足的营养物质条件下菌体能生成新的菌丝并大量合成青霉素[10-11]。所以在发酵后期遏制菌体自溶,改善菌丝形态,消除代谢物阻遏,尽可能维持高产物合成速率对提高整体发酵经济效益至关重要。
本文分析青霉素传统发酵工艺后期青霉素产率降低的可能原因,通过在补料分批发酵中后期进行倒种操作和补加金属盐以及磷酸盐溶液的操作,探讨发酵液环境的改变对青霉素合成的影响,为青霉素发酵工艺的优化提供了新思路,对青霉素工业生产起到指导作用.
1 材料与方法
1.1 菌种
产黄青霉PL1819。
1.2 主要仪器及软件
30L和50L高级生物反应器(上海国强)、LC-20A高效液相色谱仪(Agilent)、C18色谱柱(5μm, 250mm×4.6mm, Thermo)、DP-25显微镜(Olympus)、SHI-D(Ⅲ)型循环水式真空泵(上海瑞兹)、Biostar在线监控软件(华东理工大学)、MATLAB R2014b。
1.3 初始培养基组分及补料液组分
一级种子罐培养基:玉米浆140ml/L、蔗糖30g/L、(NH4)2SO43.6g/L、CaCO34.4g/L、玉米油1ml/L、消泡剂0.5ml/L。
二级种子罐、三级发酵初始培养基:柠檬酸·2H2O 1.6g/L、玉米浆10mL/L、FeSO4·7H2O 0.13g/L、CuSO4·5H2O 0.002g/L、MnSO40.02g/L、ZnSO4·7H2O 0.02g/L、MgSO4·2H2O 2.5g/L、Na2SO43.5g/L、(NH4)2SO41.5g/L、KH2PO43.1g/L、玉米蛋白粉 1.6g/L、CaCO32.6g/L、玉米油 0.4mL/L、消泡剂0.04mL/L。
二、三级发酵过程补料料液成分:葡萄70%、苯乙酸35%、硫酸铵28%、氨水17%。
1.4 发酵培养
米孢子在火焰保护下接种到30L一级发酵罐,发酵体积为20kg。一级种子罐不进行pH调控,待pH由下降转为升高时移入50L二级种子罐。二级种子罐发酵体积30L,开始增加过程补料。由于补入苯乙酸,二级种子罐中菌体已经开始分化并合成青霉素。当二级种子罐中青霉素效价达到10000U/mL时移入三级发酵罐,以保证接入三级发酵的高菌量和菌体分化特性。三级发酵体积为30L。整个发酵过程使用氨水控制pH在6.5,温度25℃,罐压0.08MPa。使用质谱仪监测发酵过程中尾碳、尾氧浓度,并通过biostar软件在线监测OUR、CER、RQ、pH、DO和温度等。每8h取样1次,检测菌浓、青霉素浓度、PAA浓度。
倒种实验:倒种操作为放出一定质量的发酵液并一次性补入等量的初始培养基。在发酵进行到90h及150h分别进行两次倒种操作,倒种体积分别为15kg及7.5kg。所有倒种后的补糖控制依据均以生物量的实际稀释倍数为准,即若倒种后发酵液稀释率为原液的70%,则当前倒种后补糖速率为倒种前补糖速率的70%。
补盐实验:从发酵进行到80h开始,通过流加方式连续补入磷酸盐溶液,其配方为:KH2PO415g/L;(NH4)H2PO48.4g/L,补料速率为1g/min。120h至发酵结束,在补入的料液中加入包括磷酸盐在内的其他金属盐类,具体包括:柠檬酸·2H2O 15g/L、FeSO4·7H2O 3.5g/L、CuSO4·5H2O 1g/L、MnSO41g/L、ZnSO4·7H2O 1g/L、MgSO4·2H2O 13g/L。
1.5 菌浓测定
测细胞干重法确定菌液浓度[12]。每个取样点重复测定3次,取平均值。
1.6 青霉素浓度、苯乙酸浓度测定
原始发酵液样品离心取上清后按预估样品浓度稀释,使用高效液相色谱法[13]检测样品中青霉素G、苯乙酸浓度。
1.7 代谢流计算
产黄青霉代谢网络以及发酵中期和后期菌体组分参照Jorgensen等[14]的研究,菌体组分见表1。MATLAB R2014b作为代谢流分析中的数学计算工具。根据代谢平衡原理,列出胞内代谢物对应的反应方程式,其中,氧气对应的方程式用来验证计算结果,提取等号左边系数作为矩阵A,未知数作为矩阵X,等号右边记作b,则X=A/b或X=inv(A)×b。发酵过程中测量葡萄糖消耗速率(qs)、青霉素G比合成速率(qPenG)、氧气比消耗速率(qO2)、二氧化碳比生成速率(qCO2)以及菌体比生长速率(u)。
2 结果与分析
2.1 产黄青霉补料分批发酵传统工艺
在传统的产黄青霉补料分批发酵工艺中,经过二级发酵,终末青霉素浓度达到10000U/mL,此时总发酵周期约为110h(其中一级发酵70h,二级发酵40h)。在三级发酵初期流加补入葡萄糖、苯乙酸、氨水及硫酸铵溶液,发酵44h后发酵质量达到35kg,并在随后开始以8h为周期的带放操作,通过带放操作维持发酵体积在34~35kg之间。发酵过程中菌体干重及青霉素浓度变化如图1所示,可见发酵至中期,即发酵100h以后,青霉素浓度增长速率变缓,在164h达到峰值,随后开始快速下降。此时成青霉素的合成速率已经低于其在发酵液中分解的速率,至188h放罐时较最高值下降了约16%。从发酵中期开始菌体浓度趋于稳定,发酵后期有轻微下降。
传统实验中不同发酵阶段对应的一些代谢参数列于表2,可看出在发酵180h青霉素比合成速率(qPenG)已经降为负值,且菌体对葡萄糖得率(YX/Glc)、产物对葡萄糖得率(YPenG/Glc)以及产物对苯乙酸得率(YPenG/PAA)均出现不同程度的下降。结合菌浓及青霉素浓度的变化情况,可知在发酵后期菌体的生长及代谢均受到了严重的影响。发酵后期青霉素浓度的降低一方面是受到菌体自溶,菌浓降低导致,另一方面则与菌体合成青霉素能力下降有关,底物葡萄糖可能更多地用于与青霉素合成无关的代谢途径中。
Douma等[15]研究表明,在稀释率为0.05/h的恒化培养中,青霉素比合成速率在前100h快速增长并达到最大值,随后开始缓慢降低,即经过5代繁殖生长后,青霉素的合成速率开始下降。其原因可能是菌体出现了不可逆的衰亡或退化。而补料分批发酵中,稀释率在中后期维持在0.01/h左右,则理论上产黄青霉能在5个代时(500h)内,维持较高的青霉素合成能力。而在实际的发酵过程中仅100h左右其产物合成速率就出现了快速的降低,这与相关研究结果存在明显差距。故考虑导致菌体青霉素合成能力下降的原因可能是后期发酵液中营养物质的不足和有毒代谢物的过度积累。

表1 发酵148h细胞组分Tab.1 Composition of biomass in 148h
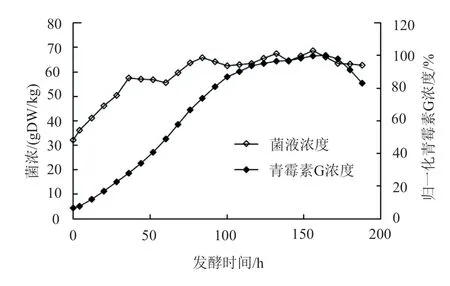
图1 补料分批发酵菌浓与青霉素G浓度变化Fig.1 Changes of biomass and normalized penicillin G in batch fermentation
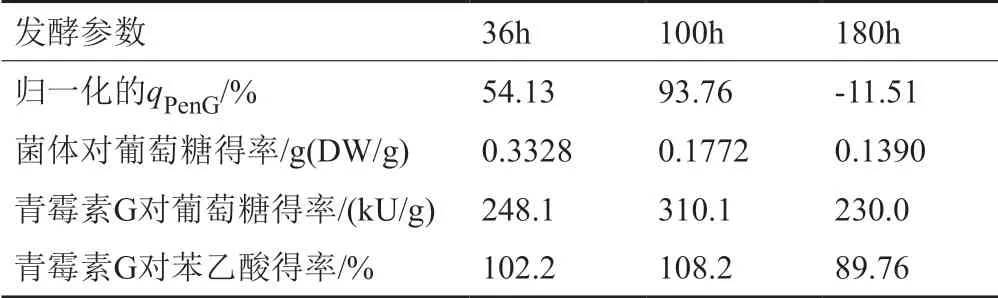
表2 不同发酵阶段比青霉素合成速率及得率对比Tab.2 The specific rates and yields at different fermentation stages
2.2 后期倒种和后期补盐工艺
2.2.1 后期倒种和后期补盐工艺对青霉素合成的影响
在倒种工艺中,发酵至90h进行第一次倒种操作,即放出约50%发酵体积(15kg)的发酵液,并同时补入等量的新鲜培养基。发酵150h进行第二次倒种,倒种量为约25%发酵体积(7.5kg)。倒种操作尽管大量减少和降低了罐内的总菌体量以及青霉素浓度,但同时也稀释了胞外有毒物质的积累。加之新鲜培养基的补入,使得菌体能够维持正常生长以及较高青霉素合成速率。在额外补盐实验中,发酵至80~120h,流加补入磷酸盐溶液,120h之后增加金属盐溶液的补入。
如图2所示,倒种和发酵后期补盐工艺较传统实验,发酵周期都得到了显著延长。发酵后期补盐工艺中在200h左右效价才开始降低,且降低趋势缓慢,整个有效发酵周期比传统工艺延长了50h以上。而在倒种工艺中,在264h放罐时,产物浓度依旧能够保持快速增长的趋势。图3为单批次青霉素累计总产量,可以看出在170h后,传统工艺青霉素总量开始下降,而倒种和后期补盐工艺在170h处仍在继续增加,并在之后很长时间内保持这一趋势。至188h,传统工艺发酵终止,此时倒种工艺和后期补盐工艺中青霉素总量较传统工艺分别高出17.46%和28.46%。图4表示3种工艺整个发酵过程中qPenG的变化情况。3种工艺中qPenG均在50~100h之间达到最大值,随后传统工艺和后期补盐工艺的qPenG开始下降,但后期补盐工艺的下降速率更加缓慢,且直至发酵结束始终高于传统工艺,说明发酵后期补入的盐溶液对维持青霉素继续合成起到了显著效果。而倒种工艺整个发酵过程中qPenG均高于其他两组工艺,且并未出现明显下降,可见倒种操作使发酵液质量得到了巨大的改善,不仅通过补加新鲜培养基稀释发酵液给菌体提供了更好的生长代谢环境,也利用带放操作去除了培养液中可能积累的有害物质,使其能够长时间维持较强的青霉素合成能力。

图2 不同调控策略下青霉素浓度比较Fig.2 The normalized penicillin G contents comparison under different control strategies

图3 不同调控策略下总青霉素产量的比较Fig.3 Comparison of total produced penicillin amount under different control strategies

图4 不同调控策略下青霉素比合成速率的比较Fig.4 Comparison of specific penicillin production rates under different control strategies
2.2.2 后期倒种和后期补盐工艺对产黄青霉菌丝形态的影响
青霉素的合成与菌丝形态之间存在密切关系,菌丝分化形成孢子阶段也是产物快速合成时期。要使细胞分化和生长朝着有利于次级代谢产物的积累方向发展,必须要有足够数量的菌丝体并能长期维持下去,才能使次级代谢产物的产量提高。发酵后期随着发酵环境的恶化,菌丝体逐渐形成膨大的短杆状或球状的异化菌丝,这种异化菌丝的青霉素合成能力下降,对发酵有不利影响[16-18]。如图5a、c、e分别为发酵24h 3组实验细胞形态,b、d、f分别为发酵152h 3组实验细胞形态。可见发酵前期菌体均呈细长丝状,各组之间无明显差异;发酵至152h,传统工艺菌体异化现象严重,而两个实验组则具有较好的菌丝形态。
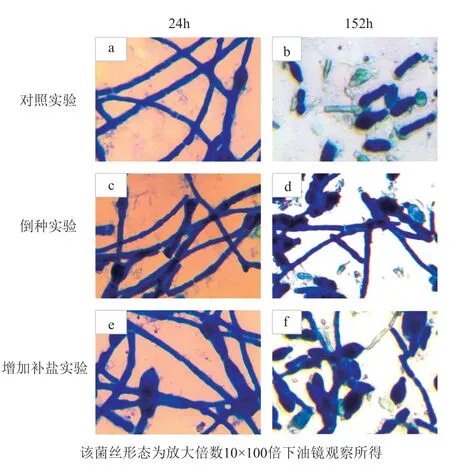
图5 不同调控策略在不同发酵周期菌丝形态的比较Fig.5 Comparison of mycelial morphology under different control strategies in different fermentation stages
2.2.3 后期倒种和后期补盐工艺对菌体及产物得率的影响
对发酵过程中菌体和产物得率进行计算,结果如图6。图6A中,3组工艺在发酵前期菌体对糖得率均迅速下降,100h后开始趋于稳定,说明后期菌体生长变慢,细胞代谢活动开始逐渐转变为以合成产物为主。150h开始,实验组菌体对糖得率稍稍高于传统工艺组,验证了倒种和后期补盐操作对菌体生长起到了积极作用。从产物对糖率(图6B)和产物对苯乙酸得率(图6C)可以明显看出,发酵前期3组实验的得率基本相同,均呈增长趋势,并在100h左右达到最大值。随后,传统工艺得率降低,后期补盐工艺虽然也开始下降,但其下降速率远低于传统工艺。发酵188h,传统工艺发酵结束,此时倒种工艺和额外补盐工艺中产物对糖得率分别提高40.02%和34.55%。倒种工艺在整个发酵过程中均能保持产物对糖得率在较高值,发酵250h之后仍未降低,且产物对苯乙酸得率基本维持在100%左右。说明发酵中后期两次倒种操作给产黄青霉的合成代谢提供了更好的环境,提高了菌体对底物及前体的利用率,确保底物及前体最大限度的参与到青霉素合成相关的次级代谢中。两批实验组的对比发现,倒种工艺较后期补盐工艺对抑制发酵后期菌体老化,促进产物合成有更优秀的效果。本研究认为这是由于倒种操作不仅一次性补入菌体生长需要的其他营养物质,同时还放掉大量的原发酵液,降低了发酵液内有毒代谢物的浓度。而倒种后仍进行正常的带放操作,则保证了在相当长时间内,发酵液都能给菌体提供良好的代谢环境,维持青霉素合成能力在较高水平。

图6 传统工艺组和实验组得率对比Fig.6 Comparison of yield between experimental group and control group
2.3 不同工艺操作下产黄青霉代谢流分析
青霉素的产率与初级代谢具有密切关系,初级代谢对青霉素合成的限制主要体现在3个方面:3个氨基酸前体(α-氨基己二酸,缬氨酸和半胱氨酸)的合成、NADPH和ATP的供应[19]。为了探究发酵中后期额外补盐对青霉素合成代谢的影响,对发酵后期传统工艺及额外补盐工艺进行了代谢流分析。发酵148h,额外补盐工艺与传统补料工艺中一些物质比转化率如表3所示。发酵148h,额外补盐工艺中底物葡萄糖比消耗速率、氧气比消耗速率以及二氧化碳比生成速率较传统工艺分别降低了9.75%、21.7%和15.5%。同时,菌体比生长速率、苯乙酸比消耗速率以及青霉素G比合成速率则分别提高了25.35%、43.8%和15.2%。这说明额外补盐工艺降低了菌体对底物的消耗,提高了底物到产物的转化率,这对工业发酵是十分有利的。
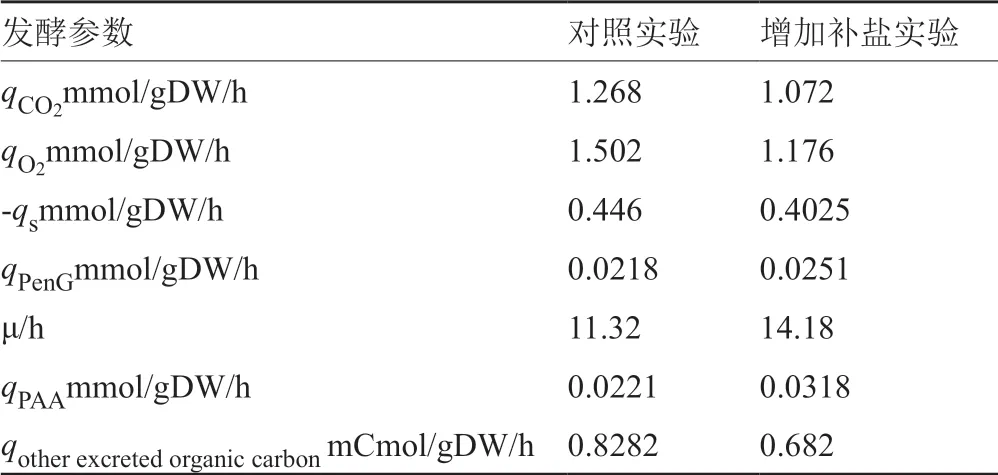
表3 148h传统工艺与额外补盐工艺发酵参数的比较Tab.3 Comparison of fermentative parameters between control and additional feeding groups in 148h
两种不同补料工艺在发酵148h的代谢流分析如图7所示,传统工艺和额外补盐工艺中氧消耗速率计算值分别为1.46和1.07mmol/(gDW·h),与所测值相符合。额外补盐实验中,6-磷酸葡萄糖到5-磷酸核酮糖的反应速率提高了27.5%。磷酸戊糖途径能产生半胱氨酸合成所需的NADPH,对青霉素的生产至关重要。缬氨酸以及半胱氨酸合成途径的反应速率分别较原始工艺提高了19.4%和15.1%。而TCA循环中草酰乙酸到柠檬酸途径反应速率降低了20.9%。这说明额外补盐操作明显影响了青霉素合成代谢节点的反应速率,磷酸戊糖途径以及氨基酸前体合成反应速率得到提高,无效的TCA循环减少,底物更多的参与到青霉素代谢途径中,从而提高了青霉素产率。同时也表明对于该菌种,影响其青霉素合成的主要代谢节点是NADPH和氨基酸前提的供应。
初级代谢中氨基酸和辅助因子的大量合成有利于提高青霉素的产量。所以保证活跃的中心碳代谢对青霉素发酵具有重要作用。青霉素合成途径中异青霉素合成酶需要Fe2+作为辅基,Mn2+和Cu2+通常也是某些酶的辅基,这些金属离子的加入对青霉素合成具有促进作用[20]。倒种实验和发酵后期补盐实验为青霉素初级代谢提供了充足的营养物质,能够维持发酵后期菌体的正常生长,使得青霉素的合成速率保持较高水平。
在青霉素的发酵过程中,一些代谢物的积累也会对青霉素合成造成不利影响。高浓度的赖氨酸对其合成途径的高柠檬酸合酶具有反馈抑制作用,最终影响α-氨基己二酸的合成,同时对三肽合成酶具有直接的抑制作用。另一方面,谷氨酸与甘氨酸能够在相关酶催化下合成谷胱甘肽。谷胱甘肽作为一种ACV类似物,能抑制异青霉素N合成酶(IPNS)的活性[21]。前期研究表明IPNS是青霉素合成的主要限速酶之一[22],因此谷胱甘肽在胞内/胞外的逐渐积累会抑制青霉素合成途径的酶活性,从而降低其合成速率。倒种实验通过放掉大量的发酵液同时补入新鲜培养基,对发酵液内的有毒代谢物起到了稀释作用,解除了高浓度的有毒代谢物对青霉素合成的抑制作用。发酵后期补盐实验由于额外增加了补料量,使得发酵后期的稀释率得到提高,一定程度上缓解了有毒代谢物的积累,使得青霉素的合成速率得以维持。
3 结论
在产黄青霉补料分批发酵的传统工艺中,存在青霉素合成速率过早下降的问题。本文通过在发酵中后期进行两次倒种操作有效地缓解了这一现象的发生,使青霉素合成速率始终维持在较高水平,发酵周期较传统工艺延长了近1倍,总产量提高了17.46%。根据倒种实验结果,本研究认为传统发酵工艺后期,青霉素合成速率降低的主因并不是菌体的自衰亡或退化,而是由于发酵液内供青霉菌利用的营养物质不足和某些有毒代谢物质的过量积累。
倒种操作虽然效果明显,但该操作导致发酵中后期大量仍具有较高产物合成能力的菌体流失,并且随后需补入额外的营养物质来弥补损失的菌体,这在工业规模上效益不高,不具有应用性。发酵后期额外补加磷酸盐及其他金属离子明显改善了发酵液环境,遏制了菌体异化,促进了前体氨基酸和NADPH的合成,能在一定程度上缓解青霉素合成速率的下降,发酵周期延长了50h以上,青霉素总产量提高了28.46%。所以工业生产上解决这一问题的关键还在于过程补料及中后期比生长速率的控制。

图7 发酵148h传统工艺与额外补盐实验工艺代谢流比较Fig.7 Comparison of metabolic fluxes between control and additional feeding group in 148h

