HPLC测定番荔枝果实中酚类成分及抗氧化相关性
韩 锐,陈亚运,季君洋,陈 勇,李 祥*,陈建伟
(南京中医药大学药学院,江苏 南京 210023)
番荔枝为番荔枝科(Annonaceae)番荔枝属(Annona Linn.)植物番荔枝(Annona squamosa Linn.)的成熟果实,又名佛头果、释迦,为热带水果[1]。原产于美洲,现在我国南方部分地区广东、广西、福建、海南等地均有引种。番荔枝具有极高食用药用价值,果实可治恶疮肿疡,补脾[2]。现代药理研究表明具有免疫抑制、抗菌、抗病毒、杀虫、抗疟、抗肿瘤[3-7]等功效,其根治急性赤痢、精神抑郁、抗惊厥[8-9]。番荔枝富含多种化学成分,包括生物碱、萜、多酚、黄酮、糖、蛋白质、氨基酸和人体所需多种微量元素等[10-13]。
天然酚类化合物主要存在于植物组织的初生壁与次生壁中,各植物组织不同部位及发育阶段所含种类及含量也不尽相同,其生长环境也会造成影响。研究发现酚类具有抗氧化、抗菌、抗炎、抗病毒、抗肿瘤、抗抑郁、抗焦虑、抗肥胖[14-19]等生物学特性。
目前人们对番荔枝果实成分及药理活性研究较多,但对果实各部位中酚类化合物的含量及抗氧化活性研究较少。本实验以6 个产地番荔枝果实为研究对象,分别对果皮、果肉、种子及抗氧化活性进行对比研究,揭示不同部位中酚类物质分布、含量及抗氧化活性差异,为番荔枝果实开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
番荔枝分别于2018年1月购自福建漳州(FJ)、海南三亚(HN)、越南西贡(YX)、广东汕头(GD)、广西南宁(GX)和云南西双版纳(YN),经南京中医药大学陈建伟教授鉴定为番荔枝科番荔枝属植物番荔枝的果实。
没食子酸(批号:110831-200302)、原儿茶酸(批号:110809-201205)、儿茶素(批号:110877-200001)、咖啡酸(批号:110885-200102)、表儿茶素(批号:110878-200102)、阿魏酸(批号:110773-201313)、芦丁(批号:100080-201409)、山柰素(批号:110831-200302) 国家食品药品检定研究院;新橙皮苷(批号:10477-201203) 南昌贝塔生物科技公司;槲皮素(批号:20151016) 北京Solarbio公司;对羟基苯甲酸(批号:131021)、柚皮素(批号:131105) 上海融禾医药科技发展有限公司;牡荆素(批号:PO6J7F17386)、Trolox(批号:MO8J7E17493)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海源叶生物技术有限公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid),ABTS) 上海浩然生物技术有限公司;K2S2O8上海麦克林生化科技有限公司;标准品纯度均大于98%。
甲醇(分析纯) 江苏汉邦公司;乙腈(色谱纯)德国默克公司;甲酸(分析纯) 南京化学试剂公司;乙醇(分析纯) 上海实意化学公司;二甲基亚砜(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FD-1A-50真空冷冻干燥机 北京博医康实验仪器有限公司;BT125D电子天平 德国Sartorius公司;KH-500DB型数控超声波清洗器 昆山禾创超声仪器有限公司;400Y打粉机 永康铂欧五金公司;SAGA-10TQ EPED超纯水仪 南京易普易达科技发展有限公司;Alliance e2695高效液相色谱仪 美国沃特世公司;TC-C18色谱柱(4.6 mm×250 mm,5 μm)美国安捷伦公司;SpectraMax 190多功能酶标仪 美国Molecular Devices公司;Allegra X-30R Centrifuge冷冻离心机 美国贝克曼库尔特公司;Alpha-1502型紫外分光光度计 上海谱元仪器有限公司。
1.3 方法
1.3.1 样品溶液制备
取6 个产地新鲜成熟的番荔枝用自来水清洗干净,剥离果皮、果肉及种子部位。于真空冷冻干燥机中干燥,打粉,过60 目筛。称取1.00 g番荔枝果皮、果肉、种子粉末于10 mL试管中,加入体积分数70%甲醇溶液5 mL,超声60 min后,用70%甲醇溶液补足质量。提取液于14 800×g离心10 min后,取上清液于-20 ℃冰箱中保存、备用。每个产地平行3 次实验。
1.3.2 标准品溶液制备
分别称取没食子酸5.02 mg、原儿茶酸5.01 mg、对羟基苯甲酸5.29 mg、咖啡酸5.27 mg、儿茶素4.93 mg、表儿茶素5.06 mg、阿魏酸5.24 mg、芦丁4.99 mg、新橙皮苷4.97 mg、牡荆素5.03 mg、槲皮素5.15 mg、柚皮素4.88 mg、山柰素5.15 mg,加甲醇溶解,于5 mL容量瓶中定容。其中柚皮素、芦丁、槲皮素需加入少量二甲基亚砜助溶。各吸取0.5 mL单酚标准品于10 mL容量瓶中,混匀、定容即得混合标准品。将配制好的标准品于14 800×g离心10 min,取上清液于-20 ℃冰箱中保存,备用。
1.3.3 总酚含量测定
采用福林-酚比色法测定总酚含量[20-21]。
标准曲线的建立:取配制的没食子酸溶液(1.00 mg/mL),逐级稀释成10.00、20.00、30.00、40.00、50.00 μg/mL没食子酸溶液。取0.5 mL标准品溶液,加入2.5 mL 10%福林-酚试剂,5 min后加入2 mL的5%碳酸钠溶液,摇匀,避光反应1 h,于波长765 nm处测吸光度。以吸光度为纵坐标(y),质量浓度为横坐标(x)绘制标准曲线。
样品含量测定:取6 个产地果皮、果肉、种子部位提取液,取1 mL进行稀释。以标准曲线方法进行测定。其吸光度带入标准曲线算出总酚质量浓度C。按公式(1)计算总酚含量:

式中:C为样品中总酚质量浓度/(mg/mL);V为稀释体积/mL;D为稀释倍数;M为样品质量/g。
1.3.4 单酚含量测定
1.3.4.1 色谱条件
Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm);柱温30 ℃;流速1 mL/min;进样量20 μL;洗脱程序:A相为0.5%甲酸溶液,B相为乙腈(0 min,A∶B=95∶5;25 min,A∶B=90∶10;40 min,A∶B=85∶15;70 min,A∶B=78∶22;90 min,A∶B=65∶35;95 min,A∶B=95∶5)。紫外检测器,检测波长为272 nm。
1.3.4.2 标准曲线制作
取1.3.2节制备的标准品溶液进行逐级稀释并进行色谱分析。以峰面积为y轴,以标准品质量浓度为x轴,建立回归方程。以3 倍信噪比确定检出限。
1.3.4.3 样品单酚含量测定
取1.3.1节制备的样品溶液进行色谱分析,以积分峰面积带入各单酚标准曲线中计算含量。
1.3.5 HPLC方法学考察
1.3.5.1 精密度
取混合标准品溶液,进行色谱分析,连续测定5 次,记录色谱峰的峰面积,根据各标准品的峰面积,计算相对标准偏差(relative standard deviation,RSD)。
1.3.5.2 稳定性
取果皮、果肉和种子部位提取液,分别在0、6、12、24 h进样,按1.3.4.1节色谱条件下,测定峰面积,根据峰面积计算RSD。
1.3.5.3 重复性
取果皮、果肉和种子部位提取液,按1.3.4.1节色谱条件进样,连续测定5 次,根据峰面积计算各单酚的含量,计算RSD。
1.3.5.4 加样回收率
分别称取番荔枝果皮、果肉、种子1.000 0 g,按照1.3.1节方法对样品进行处理,分别精密加入对照品适量。在1.3.4.1节色谱条件下,对加标准品的样品和未加标准品的样品进行检测,记录每组峰面积,按公式(2)计算回收率,平行6 次计算RSD。

式中:A为加标准品的样品峰面积;A0为标准品峰面积;Ax为样品峰面积。
1.3.6 抗氧化实验
1.3.6.1 清除DPPH自由基[22-23]
称取DPPH 2 mg溶于约20 mL甲醇中。取样品溶液,果皮部位分别稀释成相对药材质量浓度分别为0.098、0.20、0.39、0.78、1.56、3.13 mg/mL的溶液;果肉部位稀释成质量浓度分别为0.78、1.56、3.13、6.25、10.42、20.83 mg/mL的溶液;种子部位稀释成质量浓度分别为1.56、3.13、6.25、12.50、25.00、50.00 mg/mL的溶液。
取样品50 μL加入96 孔板中,加入100 μL DPPH溶液,振摇10 s,避光静置30 min,于519 nm波长处测定吸光度。DPPH自由基清除率按公式(3)计算:
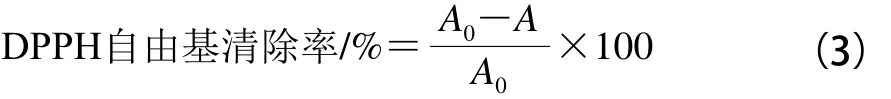
式中:A0为50 μL甲醇+100 μL DPPH溶液的吸光度;A为50 μL样品+100 μL DPPH溶液的吸光度。
1.3.6.2 清除ABTS阳离子自由基[24-25]
ABTS工作液配制:将ABTS配成浓度为7.4 mmol/L的溶液,K2S2O8配成浓度为2.6 mmol/L的溶液,各取1 mL等体积混合后,于室温避光12 h。用95%乙醇溶液将溶液稀释至40~50 倍,在734 nm波长处测定吸光度,使其吸光度在0.7±0.02范围内,即为配制好的ABTS工作液。
样品溶液配制:取1.3.1节制备的样品溶液,果皮部位稀释成相对药材质量浓度为0.024、0.049、0.098、0.20、0.39、0.78 mg/mL的溶液;果肉与种子部位同
1.3.6.1 节稀释。
清除ABTS阳离子自由基能力测定:在96 孔板中加入30 μL样品和120 μL ABTS工作液,振摇10 s,避光静置6 min,于波长734 nm处测定吸光度。ABTS阳离子自由基清除率按公式(4)计算:
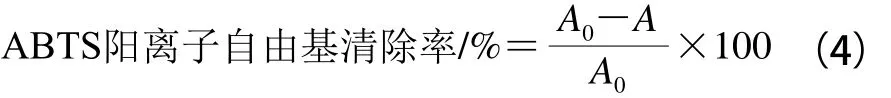
式中:A0为120 μL ABTS工作液+30 μL甲醇的吸光度;A为120 μL ABTS工作液+30 μL样品的吸光度。
1.4 数据统计分析
所有实验重复3 次,结果以 ±s表示,用Excel建立数据库。利用SPSS 23.0统计软件完成方差分析和相关性分析。采用GraphPad Prism 6软件进行数据统计分析与图表绘制。
2 结果与分析
2.1 HPLC方法学考察结果
表1 13 种酚类物质的方法学考察结果Table 1 Methodological study of the PLC method for the determination of 13 phenols %
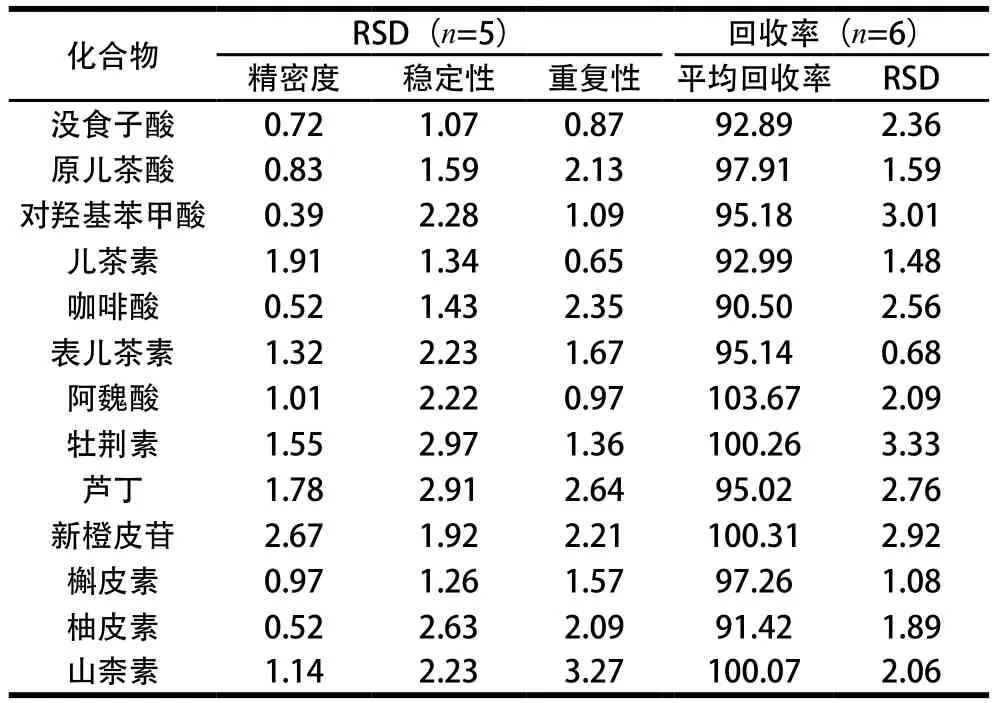
表1 13 种酚类物质的方法学考察结果Table 1 Methodological study of the PLC method for the determination of 13 phenols %
化合物 RSD(n=5) 回收率(n=6)精密度 稳定性 重复性 平均回收率 RSD没食子酸 0.72 1.07 0.87 92.89 2.36原儿茶酸 0.83 1.59 2.13 97.91 1.59对羟基苯甲酸 0.39 2.28 1.09 95.18 3.01儿茶素 1.91 1.34 0.65 92.99 1.48咖啡酸 0.52 1.43 2.35 90.50 2.56表儿茶素 1.32 2.23 1.67 95.14 0.68阿魏酸 1.01 2.22 0.97 103.67 2.09牡荆素 1.55 2.97 1.36 100.26 3.33芦丁 1.78 2.91 2.64 95.02 2.76新橙皮苷 2.67 1.92 2.21 100.31 2.92槲皮素 0.97 1.26 1.57 97.26 1.08柚皮素 0.52 2.63 2.09 91.42 1.89山柰素 1.14 2.23 3.27 100.07 2.06
如表1所示,HPLC方法学考察结果表明仪器精密度良好,HPLC条件稳定性、重复性和加样回收率均符合常规定量分析要求。
2.2 番荔枝果实总酚含量
根据没食子酸制作的回归方程y=0.012 3x-0.086 5,R2=0.999 9。在质量浓度10~50 μg/mL呈良好线性关系。果实中果皮部位总酚含量均显著高于果肉和种子部位。果皮部位中GX含量最高;果肉部位YN和HN总酚含量相对较高;种子部位总酚含量均较低。综上所述,各部位总酚含量差异性显著为果皮>果肉>种子,GX果实各部位总酚总量最高。
2.3 番荔枝果实单酚含量
2.3.1 单酚标准曲线
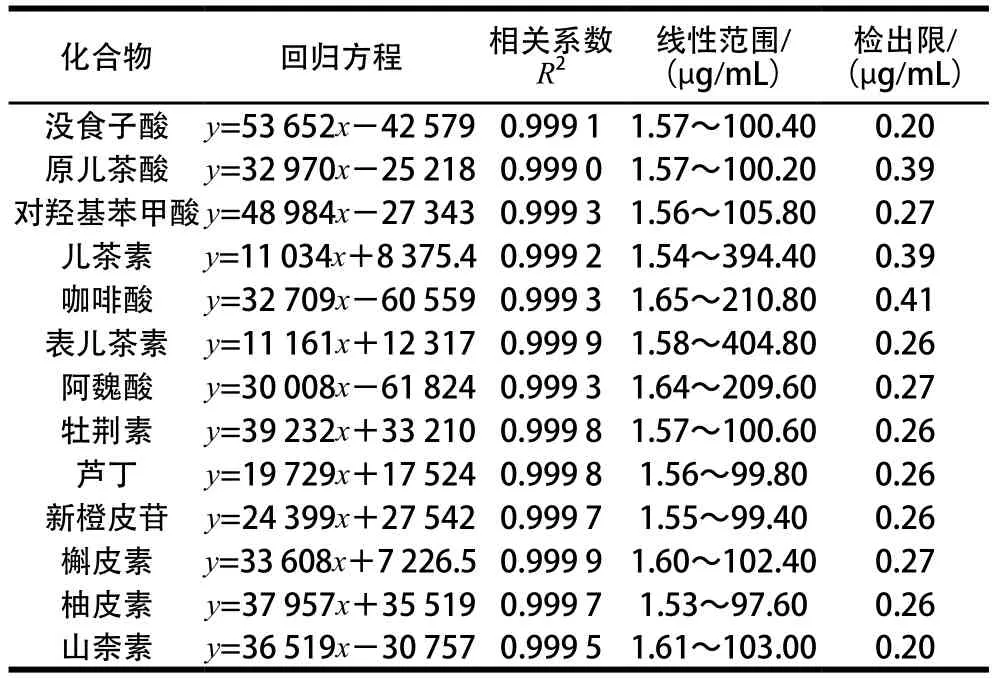
表2 对照品回归方程及检出限Table 2 Regression equations and detection limits
如表2所示,13 种单酚均呈现良好线性关系,相关系数在0.999 1~0.999 9之间,检出限范围为0.20~0.41 μg/mL。
2.3.2 单酚含量测定结果
如图1、表3所示,6 个样品中番荔枝果实中果皮、果肉、种子部位中所含单酚含量及种类差异显著。果皮中儿茶素与表儿茶素含量相对较高,GX儿茶素含量最高,对羟基苯甲酸、表儿茶素与新橙皮苷相对高于其他单酚。果肉中单酚种类和含量差异均较显著,对羟基苯甲酸与表儿茶素含量相对高于其他单酚,GX所含单酚种类最少为6 种,且总酚含量相对较低,YX总酚含量最低。种子部位HN所含种类最多为9 种单酚,其中芦丁含量最高,其次是表儿茶素。YX种子所含种类最少只有5 种单酚。YX和FJ果皮与果肉中均未检测到槲皮素、柚皮素、山柰素3 种单酚,种子中均未检测到没食子酸与原儿茶酸。果皮中所含单酚总量显著高于果肉与种子部位。

表3 番荔枝果实单酚含量(n=3)Table 3 Comparison of individual phenol contents in A. squamosa fruit (n=3)
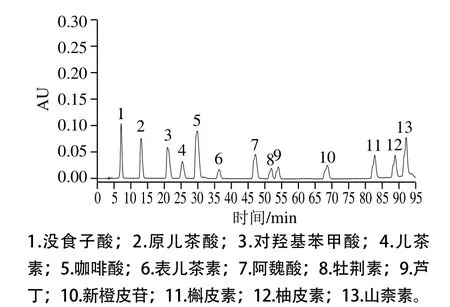
图1 单酚HPLC图Fig. 1 HPLC chromatograms of individual phenolic compounds
2.4 抗氧化实验结果
2.4.1 清除DPPH自由基

图2 果实酚类提取液对DPPH自由基的清除能力Fig. 2 DPPH radical scavenging activities of different fruit parts
由图2可知,番荔枝果实具有显著的抗氧化活性,且果皮部位清除DPPH自由基能力显著高于果肉和种子部位,这与Kingsley[26]和Henrique[27]等研究结果一致。果皮部位中,GX果皮抗氧化活性最好,其次是YX,FJ抗氧化能力最差。果皮在质量浓度为1.56 mg/mL时均达到最大清除率,而GX与YX果皮质量浓度仅为0.39 mg/mL达到最大。而在果肉部位中GX果肉抗氧化能力较差,YN效果最好且显著优于其他5 个样品。种子部位中,GX抗氧化能力最佳,GD显著低于其他组样品。
2.4.2 清除ABTS阳离子自由基
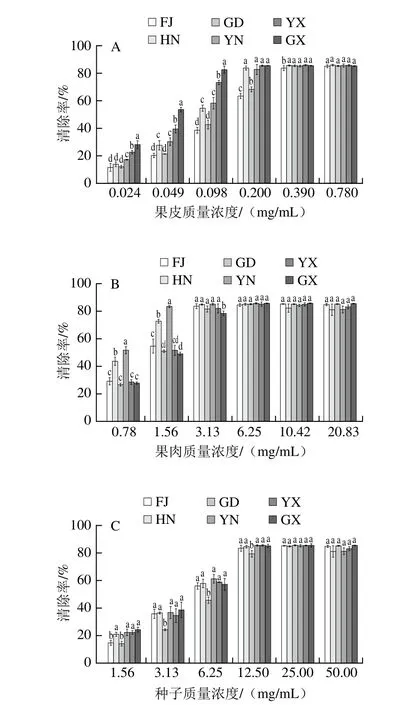
图3 果实酚类提取液对ABTS阳离子自由基的清除能力Fig. 3 ABTS radical cation scavenging activities of different fruit parts
由图3可知,番荔枝果实各部位清除ABTS阳离子自由基能力明显优于DPPH自由基。果实各部位间抗氧化能力差异显著,果皮抗氧化效果最佳,种子部位最差。GX果皮清除ABTS阳离子自由基能力最强,其次是YX,FJ和GD均较差。在果皮质量浓度为0.20 mg/mL时,除FJ和GD均达到最大清除率约85.00%。果肉部位YN抗氧化能力显著高于其他样品,其次为HN,FJ、GD、YX、GX四个样品果肉抗氧化能力相当均较差。种子部位中GD效果较差,其他5 个样品抗氧化效果优于GD,但无显著性差异。
2.5 番荔枝果实酚类物质抗氧化能力与酚类物质含量相关性分析

表4 番荔枝果实酚类物质抗氧化能力与酚类物质含量相关性分析Table 4 Correlation coefficients between antioxidant activity and phenolic contents
以清除ABTS阳离子自由基、DPPH自由基的IC50值和各酚类物质含量进行相关性分析,IC50值越小其抗氧化能力越强。如表4所示,植物酚类提取液的抗氧化作用不是由一种物质单独作用的结果,而是多种物质之间的协同作用,既与总酚相关又与单酚存在一定的关联性。果皮中总酚含量与清除ABTS阳离子自由基、DPPH自由基均达到极显著相关。果肉部位中表儿茶素、总酚含量与抗氧化能力达到显著相关。种子部位抗氧化能力与总酚含量存在一定的关联性,柚皮素与山柰素对抗氧化能力的贡献较大。与Kelebek[28]和Zahid[29]等报导一致,抗氧化活性与酚类化合物存在一定的相关性,且与总酚含量达到显著相关。但与本实验结果不同的是张华等[30]研究发现单酚中没食子酸、阿魏酸、咖啡酸对抗氧化活性贡献较大,可能与实验采用的样本含量较低所致。
3 结 论
番荔枝果实不同部位间酚类成分种类及含量差异显著。果皮部位总酚及单酚总量明显高于果肉和种子部位。果皮中儿茶素与表儿茶素含量较高;果肉中羟基苯甲酸与表儿茶素较高;种子中各单酚含量均较低。番荔枝果实具有显著的抗氧化活性,且清除ABTS阳离子自由基能力显著强于DPPH自由基,不同部位间抗氧化活性差异显著,果皮>果肉>种子。果皮与种子中GX抗氧化效果均较好,果肉中YN抗氧化活性显著高于其他样品。相关性分析表明抗氧化活性是多种物质之间的协同作用,与总酚存在显著相关。
本实验通过对番荔枝果实果皮、果肉和种子中总酚、单酚的含量测定,建立同时测定番荔枝果实中13 种酚类物质的方法,且操作简便,重复性好,可用于三者之间酚类物质的含量测定。又对番荔枝果实各部位酚类提取液抗氧化活性进行对比,与Adefegha等[31]报道一致,果皮酚类含量最高,且抗氧化活性显著高于果肉和种子部位。研究发现番荔枝果皮多酚显著的抗氧化活性,可能是其发挥抗II型糖尿病、高血压和肝保护的作用机制之一[32-33]。而果皮作为食用废弃物,且毒副作用小,可作为天然抗氧化剂,此研究为番荔枝果皮的开发利用提供可能。

