牛初乳和牛常乳乳清N-糖蛋白质的差异分析
曹雪妍,刘 瑛,杨 梅,杨 宁,梁肖娜,武俊瑞,乌日娜,陶冬冰,刘 彪,叶文慧,岳喜庆,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010110)
牛乳营养丰富,含有多种人体所需的蛋白质、脂肪、氨基酸、低聚糖和矿物质等成分。牛乳作为人类膳食中消费最多的动物乳,不仅能够提供营养成分,还可以提供多种生物活性物质,具有促进生长发育、调节机体免疫力、抗病毒和促进肠道健康等作用[1]。蛋白质是牛乳中的重要成分,约占牛乳的3.5%。牛乳蛋白主要分为酪蛋白、乳清蛋白和乳脂肪球膜蛋白,其中乳清蛋白约占牛乳总蛋白的20%,营养价值高,与酪蛋白相比,更易于被人体消化吸收,被认为是人体优质蛋白质补充剂之一[2-3]。乳清蛋白含有乳球蛋白、免疫球蛋白、乳铁蛋白和一些小分子肽等活性物质,非常适合婴幼儿、儿童、青少年、运动员和术后恢复者等群体,被广泛应用于婴幼儿配方乳和功能性食品的生产中[4]。
由于乳清蛋白的重要作用,近年来关于乳清蛋白的研究越来越多。研究者们采用蛋白质组学技术,阐明了人乳、牛乳、羊乳等哺乳动物乳的蛋白质组成并比较分析了它们之间的差异[5-8]。然而,生命体内许多重要的生物过程除受到蛋白质种类及含量的调控外,还与蛋白质的翻译后修饰密切相关。蛋白质的翻译后修饰对于执行蛋白质特定的功能是极其重要的,它使蛋白质的结构更复杂、功能更完善、调控机制也更精细[9]。蛋白质的翻译后修饰主要包括糖基化、磷酸化、乙酰化和泛素化等,其中,糖基化是一种最常见的蛋白质翻译后修饰,在细胞识别、信号转导和免疫调节等方面发挥着重要的作用,研究表明,生物体内约有50%以上的蛋白质会发生糖基化[10]。以往对乳汁蛋白质糖基化的研究多集中在乳中几种主要糖蛋白的含量及其随泌乳期的变化[11]。近年来,随着质谱技术的不断发展成熟,大规模的糖蛋白质组学和糖组学技术广泛应用于蛋白质糖基化的研究中,动物乳及不同泌乳期人乳蛋白质糖基化的研究取得了一定进展[12-17],然而,大规模的不同泌乳期牛乳蛋白质糖基化研究却鲜有报道。
因此,本研究利用非标记定量糖蛋白质组学技术,分析了不同泌乳期牛乳(牛初乳和牛常乳)乳清N-糖蛋白质的组成及其糖基化位点差异表达情况,并利用生物信息学手段,分析了牛乳乳清N-糖蛋白的功能,为评价和改善牛乳品质、研发婴幼儿配方乳中糖蛋白质的改良及功能食品的生产提供理论依据。
1 材料与方法
1.1 材料与试剂
牛乳样品采集自沈阳辉山乳业牧场,随机选择年龄1~6 岁之间的健康荷斯坦奶牛,饲养管理条件一致,分别在产后0~5 d和1~6 个月各收集60 头奶牛的乳样,记为牛初乳组和牛常乳组。收集的乳样迅速降温至-20 ℃,立即运送至实验室并贮藏于-80 ℃备用。实验前,分别混合初乳和常乳,以排除个体差异。
二硫苏糖醇(dithiothreitol,DTT)、十二烷基硫酸钠、碘乙酰胺(iodoacetamide,IAA)、尿素、三羟甲基氨基甲烷(Tris) 美国Bio-Rad公司;胰蛋白酶(测序级) 美国Promega公司;C18固相萃取小柱美国Waters公司;伴刀豆球蛋白A(concanavalin A,ConA)、麦胚凝集素(wheat germ agglutinin,WGA)、蓖麻凝集素(Ricinus communis agglutinin,RCA)、Bradford蛋白定量试剂盒、H218O、NH4HCO3美国Sigma公司;30 kDa超滤离心管 美国Millipore公司;糖苷酶F(N-glycosidase F,PNGase F) 瑞士Roche公司;甲酸、乙腈(均为色谱纯) 德国Merck公司;盐酸、氯化锰、氯化钙、氯化钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Q-Exactive高分辨质谱仪 美国Thermo Fisher公司;5430R型低温高速离心机、微量移液器 德国Eppendorf公司;氮吹仪 美国Organomation公司;Milli-Q超纯水系统 美国Millipore公司;真空冷冻干燥机 美国Labconco公司。
1.3 方法
1.3.1 乳清蛋白的制备
分别取牛初乳和牛常乳混合样品50 mL,4 ℃、10 000×g离心15 min,小心移除上层的乳脂肪层,取下层脱脂乳,4 ℃、150 000×g离心1 h,收集上清液样品,即乳清样品。向乳清中加入4 倍体积预冷丙酮,混匀,-20 ℃过夜后,4 ℃、12 000×g离心15 min,收集下层沉淀,重复2 次后冷冻干燥,得到乳清蛋白,采用Bradford法测定蛋白含量[18]。
1.3.2 乳清蛋白的蛋白酶酶解
分别取牛初乳和牛常乳乳清蛋白800 μg加入适量的UA buffer(0.1 mol/L NH4HCO3、0.1 mol/L Tris-HCl pH 8.0、8 mol/L尿素),加入DTT溶液至最终浓度10 mmol/L,混合均匀后至于37 ℃孵育2.5 h,然后冷却至室温,加入IAA至最终浓度50 mmol/L,暗处静置孵育30 min。加入5 倍体积的水,将UA浓度稀释至1.5 mol/L,按照1∶50的比例加入1 mg/mL的胰蛋白酶,37 ℃酶切18 h。酶解液经过C18固相萃取小柱脱盐。
1.3.3 N-糖基化肽段的富集及H218O中脱糖链
N-糖基化肽段的富集参考文献[10,19]的方法。将酶解后的肽段转移至新的30 kDa超滤离心管中,加入50 μL的凝集素混合液CWR(90 μg ConA、90 μg WGA和90 μg RCA),700 r/min振荡3 min后,室温放置1 h,14 000×g离心30 min。加入200 μL的结合缓冲液(20 mmol/L pH 7.3 Tris-HCl、0.5 mol/L CaCl2、0.5 mol/L MnCl2、0.25 mol/L NaCl),14 000×g离心30 min,重复4 次。加入50 μL的H218O配制的25 mmol/L NH4HCO3,14 000×g离心30 min,重复1 次。采用50 μL H218O配制的25 mmol/L NH4HCO3溶液溶解2 μg PNGase F,加入超滤离心管,37 ℃酶切3 h,反应结束后,换新收集管,14 000×g离心30 min,再加入40 μL H218O配制的25 mmol/L NH4HCO3溶液,14 000×g离心30 min,收集滤液,冻干待用。
1.3.4 细管高效液相色谱-质谱分析
采用0.1%的甲酸溶液复溶脱糖肽,取复溶后的肽段进行高效液相色谱-串联质谱联用分析,每个样品测定3 次。采用纳升流速高效液相色谱系统进行分离。流动相A液为0.1%甲酸-乙腈溶液(乙腈2%),B液为0.1%甲酸-乙腈溶液(乙腈84%)。上样柱为Acclaim PepMap100 nanoViper C18柱(100 μm×2 cm,3 μm);分析柱为EASY column C18柱(75 μm×10 cm,3 μm)。梯度洗脱程序如下:0~110 min,流动相B从0%~55%;110~115 min,流动相B从55%~100%;其后以100%流动相B保持5 min。流速为300 nL/min,脱糖肽经毛细管高效液相色谱分离后用Q-Exactive质谱仪分析。
质谱分析时长为120 min,采用正离子模式检测,母离子质量扫描范围m/z 300~1 800,一级质谱分辨率70 000(m/z 200);每次全扫描后采集10 个离子峰进行二次采集,二级质谱分辨率17 500(m/z 200),碰撞能量27 eV。
1.4 数据分析
采用MaxQuant 1.3.0.5软件对质谱分析的RAW文件进行鉴定分析。数据库下载自UniProt,物种为牛(Bos taurus)。搜库参数如下:酶为胰蛋白酶;最大漏切位点为2;固定修饰为半胱氨酸胺乙酰化;可变修饰为甲硫氨酸氧化和天冬酰胺脱氨基;肽段的质量偏差为10×10-6,碎片的质量偏差为0.1 Da。
1.5 生物信息学分析
为确定差异表达糖蛋白的功能,利用在线DAVID Bioinformatics Resources 6.8数据分析平台进行数据库检索(https://david.ncifcrf.gov/summary.jsp),分析差异表达糖蛋白的基因本体论(gene ontology,GO)功能注释和参与的Kyoto Encyclopedia of Genes and Genomes(KEGG)代谢通路。利用STRING V 10.5软件(https://string-db.org/)分析差异蛋白之间的相互作用。
2 结果与分析
2.1 牛乳N-糖蛋白的质谱鉴定结果

图1 鉴定的N-糖肽分子质量偏差分布情况Fig. 1 Molecular mass error distribution of the identified N-glycosylated peptides
采用糖蛋白质组学技术,鉴定N-糖蛋白及其糖基化位点。牛初乳和牛常乳乳清经过蛋白酶解、凝集素富集糖肽和糖苷酶去糖链处理后,采用高精度的高效液相色谱-串联质谱检测,获得的数据使用MaxQuant 1.3.0.5软件检索,使用错误发现率低于0.01的过滤结果[20],本研究鉴定到的N-糖肽的分子质量偏差均小于6×10-6,表明质谱鉴定结果准确度高(图1)。
选择3 次实验中至少有2 次以上具有鉴定结果的糖肽进行分析。如图2所示,在牛初乳和牛常乳乳清部分共鉴定到154 个N-糖蛋白和246 个糖基化位点,其中,牛初乳中鉴定到117 个N-糖蛋白和183 个糖基化位点,牛常乳中鉴定到109 个N-糖蛋白和145 个糖基化位点。牛初乳和牛常乳共同鉴定到62 个N-糖蛋白和82 个糖基化位点;牛初乳单独鉴定到55 个N-糖蛋白和101 个糖基化位点;牛常乳单独鉴定到37 个N-糖蛋白和63 个糖基化位点。
质谱技术在分析蛋白质及其糖基化中起到重要作用,Yang Yongxin等[13]采用糖蛋白质组学技术在牛常乳乳清中鉴定到72 个N-糖蛋白。除常乳外,本研究还对初乳N-糖蛋白进行了鉴定,并得到更多的牛乳乳清N-糖蛋白及其糖基化位点,这对于深入理解牛乳蛋白质糖基化修饰具有重要意义。牛乳乳清中几种主要的糖蛋白在初乳和常乳中均有表达,包括免疫球蛋白、多聚免疫球蛋白受体、乳铁蛋白、丛生蛋白和α-乳白蛋白等[21]。Le等[22]分别在牛初乳和牛常乳中鉴定到253 种和257 种蛋白[22],乌兰君等[23]分别在牛初乳和牛常乳中鉴定到290 种和325 种蛋白。然而,本实验在初乳中鉴定到的糖蛋白和糖基化位点数量均高于常乳。初乳的摄入,是初生小牛能够存活并健康成长发育的重要因素。与常乳相比,初乳含有更多的糖蛋白而且一些蛋白含有更多的糖基化位点,这可能与初乳需要提供更多的具有特殊功能的蛋白质有关,因为蛋白质糖基化修饰与蛋白质的功能密切相关,这些不同的糖基化位点连接的糖链可以提供不同的抗原识别表位,调控固有免疫和适应性免疫应答[24]。
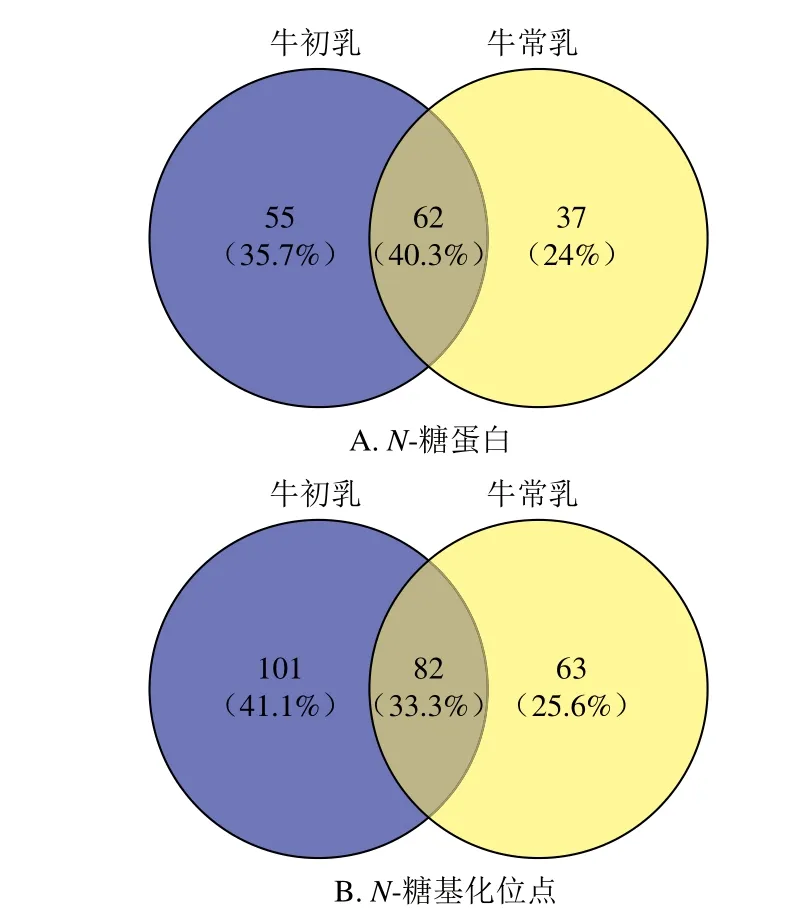
图2 牛初乳和牛常乳乳清N-糖蛋白和N-糖基化位点韦恩图Fig. 2 Venn diagrams of N-glycoproteins and N-glycosylation sites in bovine colostrum and mature milk whey
初乳中丛生蛋白(P17697)糖基化位点N-283表达量最高,是牛常乳的6.86 倍。此外,丛生蛋白糖基化位点N-80、N-139、乳凝集素(Q95114)糖基化位点N-227和α-乳白蛋白(P00711)糖基化位点N-93在初乳中表达量较高;常乳中α-乳白蛋白糖基化位点N-93表达量最高,是初乳的2.59 倍,此外,分泌球蛋白家族1D成员(A0JNP2)糖基化位点N-87、α-乳白蛋白糖基化位点N-64、α-1-酸性糖蛋白(Q3SZR3)糖基化位点N-136和血小板糖蛋白(P26201)糖基化位点N-172在常乳中表达量较高。丛生蛋白属于牛乳中的低丰度蛋白,本研究发现,其糖肽(FTENNDRTVCKEIRHN283STGCLRMKDQ CEKCQ)表达量在初乳中最高。丛生蛋白是细胞外伴侣分子,在刺激反应、信号转导和转录调控等方面发挥重要作用,参与补体通路,具有保护细胞免受应激引起的蛋白质损害,防止细胞凋亡和细胞溶解的作用[25]。α-乳白蛋白是牛乳乳清中的高丰度蛋白,其糖肽(IWCKDD QNPHSSNICN93ISCDKFLDDDLTDDI)表达量在常乳中最高。α-乳白蛋白具有生物活性,在调节乳糖合成及乳汁分泌过程中发挥着重要作用,同时,乳白蛋白含有丰富的氨基酸,对婴儿神经发育及健康生长等方面具有重要作用[26]。
2.2 糖基化位点分析
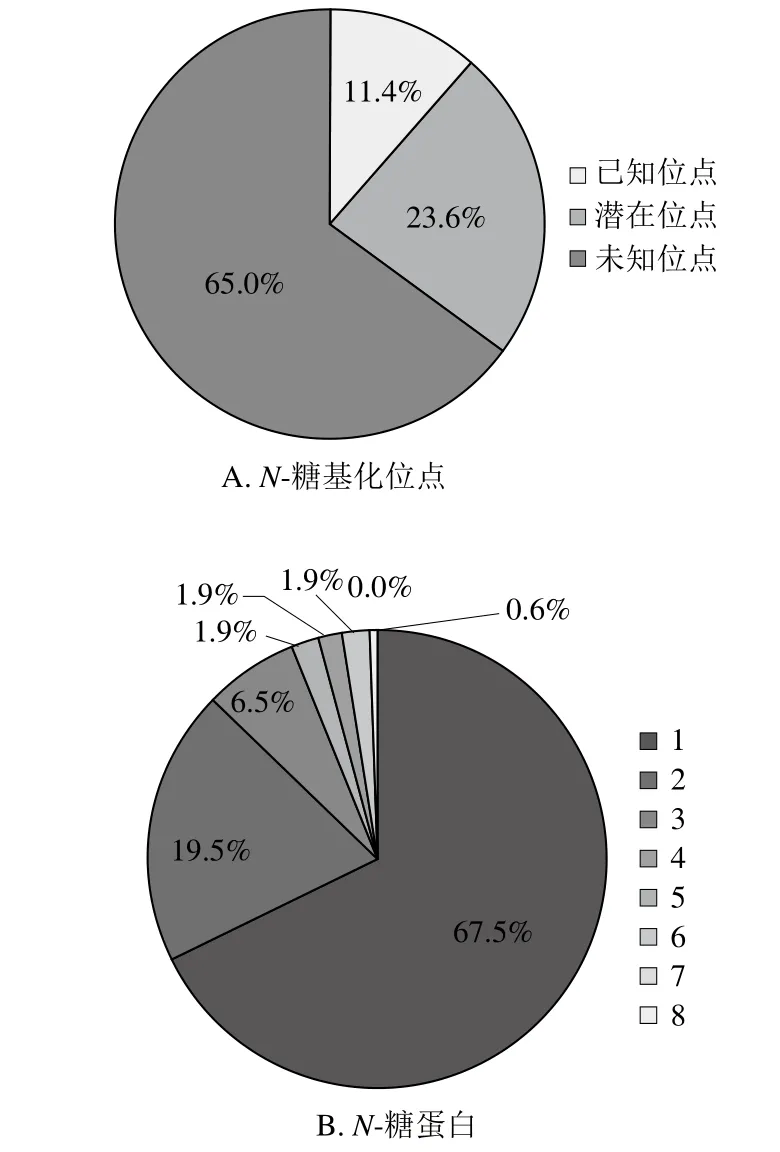
图3 N-糖基化位点注释信息和N-糖蛋白分布情况Fig. 3 N-glycosylation sites in UniProt database and their distribution
如图3A所示,检索UniProt数据库可知,牛乳鉴定到的246 个N-糖基化位点中,已有文献支持的糖基化位点有28 个(11.4%),潜在的糖基化位点58 个(23.6%),未知的糖基化位点160 个(65.0%)。如图3B所示,牛乳中鉴定到的N-糖蛋白含有1~8 个糖基化位点,其中104 个N-糖蛋白(67.5%)含有1 个糖基化位点,30 个N-糖蛋白(19.5%)含有2 个糖基化位点,10 个N-糖蛋白(6.5%)含有3 个糖基化位点,3 个N-糖蛋白(1.9%)含有4 个糖基化位点,7 个N-糖蛋白(4.4%)含有5 个及以上糖基化位点。这与人乳和牛乳乳清N-糖蛋白糖基化位点分布情况相似[13-14]。在牛乳乳清中,丛生蛋白具有最多的N-糖基化位点,在初乳和常乳中分别含有8 个和5 个糖基化位点;多聚免疫球蛋白受体在初乳和常乳中分别含有5 个和2 个糖基化位点,这些蛋白的糖基化位点数量在初乳中高于常乳。
2.3 牛初乳、牛常乳差异表达N-糖蛋白
采用非标记定量蛋白质组学技术,对牛初乳和牛常乳乳清N-糖蛋白进行比较分析[14]。选取N-糖基化位点表达量差异3 倍以上的糖蛋白整理为定量差异表达糖蛋白,共有40 个糖蛋白的53 个糖基化位点在初乳和常乳中差异表达,其中27 个糖蛋白的37 个糖基化位点在初乳中表达上调,15 个糖蛋白的16 个糖基化位点表达下调。选取牛初乳、牛常乳乳清的3 次重复样本中,其中3 次分析均无定量数据,而另一组中有2 次及以上定量数据的N-糖基化位点整理为特异性表达糖基化位点并记为有无差异,将初乳、常乳特异性表达糖蛋白分别归入上调组及下调组。初乳和常乳中共有106 个糖蛋白的137 个特异性表达糖基化位点,其中初乳中鉴定到64 个糖蛋白的85 个特异性表达糖基化位点,常乳中鉴定到46 个糖蛋白的52 个特异性表达糖基化位点。综合考虑定量差异及有无差异,初乳和常乳乳清中共鉴定到129 个糖蛋白的190 个差异表达糖基化位点,其中70 个糖蛋白在初乳中上调,49 个糖蛋白下调,10 个蛋白既有上调又有下调糖基化位点。
2.4 差异表达N-糖蛋白的GO功能注释分析
利用生物信息学软件对鉴定到的牛初乳和牛常乳乳清中差异表达的N-糖蛋白进行分析,可以进一步了解不同泌乳期牛乳蛋白质糖基化的功能。采用在线DAVID数据分析平台对乳清129 个差异表达糖蛋白进行GO功能注释分析,包括生物学过程、细胞成分和分子功能3 个方面。如图4所示,牛乳乳清差异表达糖蛋白参与的生物学过程是生物调节(24.5%)、刺激性反应(22.8%)、多细胞生物过程(15.2%)、定位(14.1%)、免疫系统过程(9.3%)、多生物过程(7.2%)和生物黏附作用(6.9%);这些差异表达糖蛋白主要分布为细胞外区域(29.8%)、细胞器(25.9%)、细胞外区域部分(24.3%)和膜(17.4%),少量蛋白分布在细胞外基质(2.6%);差异表达糖蛋白主要的分子功能是结合作用(47.6%)、催化活性(21.0%)、分子功能调节(11.9%)和转运活性(8.4%),此外还有分子转导活性、信号转的活性、结构分子活性和抗氧化活性。人乳乳清N-糖蛋白GO分析表明,不同泌乳期差异表达糖蛋白参与的生物学过程主要是定位、免疫系统过程刺激反应和生物调节等;细胞成分是细胞外区域部分;分子功能主要是结合作用和调节作用[14],这些GO功能注释类别与牛乳差异N-糖蛋白注释类别很多是重合的,包括刺激性反应、定位、免疫系统过程、生物调节等,说明牛乳作为生产婴幼儿配方乳的主要原料,其乳清差异表达糖蛋白的某些功能与人乳乳清是相似的,可以提供一些与免疫和生长发育相关的糖蛋白。
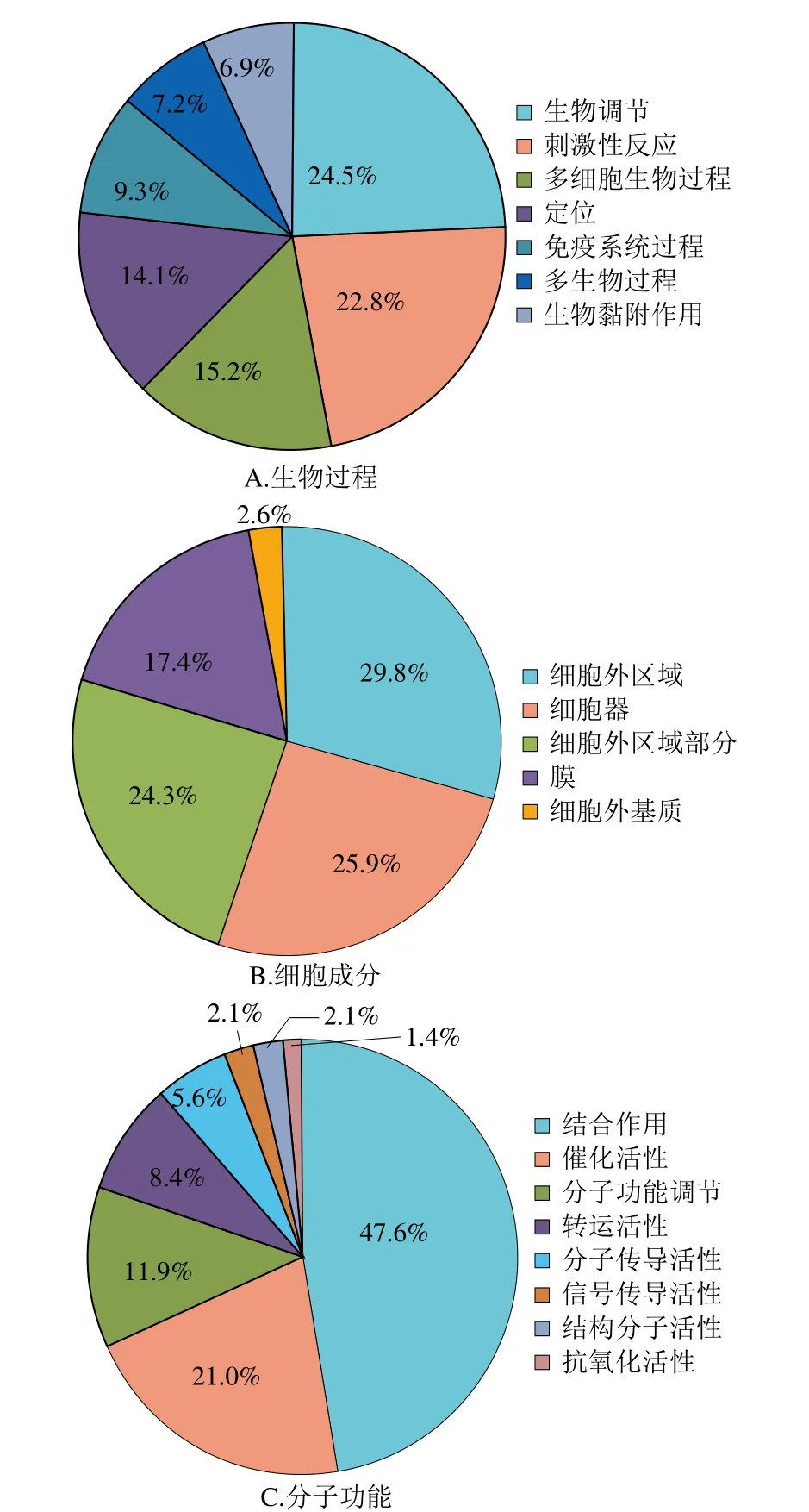
图4 牛乳乳清差异N-糖蛋白的GO注释图Fig. 4 GO annotation of the differentially expressed whey N-glycoproteins in bovine milk
2.5 差异表达N-糖蛋白的KEGG通路分析

图5牛乳乳清差异N-糖蛋白的KEGG通路图Fig. 5 KEGG pathway analysis of the differentially expressed whey N-glycoproteins in bovine milk
在生物体内,蛋白质与其他蛋白质构成信号通路以行使其生物学功能。因此,对牛初乳和牛常乳乳清差异表达糖蛋白进行KEGG分析可以更全面地了解它们参与的代谢通路,进而阐明其功能。对129 个差异表达糖蛋白进行KEGG代谢通路分析,共匹配到48 个代谢通路,其中主要的代谢通路如图5所示,包括补体与凝血级联、金黄色葡萄球菌感染、溶酶体、PI3K-Akt信号通路、吞噬作用、细胞外基质受体相互作用、肺结核、百日咳、造血细胞谱系、糖胺聚糖和其他聚糖降解。结合人乳乳清N-糖蛋白的研究与本研究发现,人乳乳清差异表达N-糖蛋白参与的KEGG代谢通路与牛乳乳清差异表达N-糖蛋白均参与了补体与凝血级联、金黄色葡萄球菌感染、溶酶体、PI3K-Akt信号通路、吞噬作用、细胞外基质受体相互作用和肺结核通路[14],说明牛乳与人乳乳清蛋白N-糖基化的部分功能具有重叠。
生物体内存在一套重要的免疫系统,它可以识别和排除抗原性异物,通过与机体其他系统相互作用来实现机体的内环境稳定和生理平衡。补体系统是一种重要的先天免疫途径,起到破坏和清除病原微生物的作用。补体系统由40多种蛋白质组成,其中大部分补体蛋白是糖蛋白,它们共同形成了一个蛋白酶级联反应体系[27]。在牛乳乳清差异表达N-糖蛋白中有18 种蛋白参与了补体与凝血级联通路,主要包括一些补体成分、补体因子和凝血因子等。牛乳乳清中,甘露聚糖结合凝集素丝氨酸肽酶的2 个糖基化位点在初乳中上调表达,补体成分C1,r亚组分的2 个糖基化位点和纤维蛋白原γ-B链的1 个糖基化位点下调表达。这些补体系统的上游因子对于激活补体经典途径和凝集素途径以及活化补体C3具有重要作用[27]。C3是哺乳动物补体系统最重要的组成部分,是该通路的激活和效应中心[28]。牛初乳乳清中鉴定到C3的两个上调糖基化位点,表明初乳的C3糖基化位点N-938和N-1649的修饰程度要高于常乳。同时,补体系统的激活不足与过度均可能造成有害影响,因此需要补体调节因子对其进行严格的调控[29]。本研究鉴定到与补体调节相关的补体因子H和I的1 个糖基化位点在牛初乳乳清中上调表达,因子B的1 个糖基化位点下调表达,这些差异表达糖蛋白反映了不同生长阶段小牛对蛋白质糖基化的不同需求,对于理解蛋白质糖基化在小牛生长发育过程中起到的作用具有重要意义。
2.6 差异表达N-糖蛋白的互作网络分析
蛋白质之间具有结合作用或相互作用是蛋白质彼此间相互调节和介导以行使其功能的基础。因此,对蛋白质之间的相互作用及其互作网络进行研究,对于揭示蛋白质的功能并找到具有重要功能的蛋白质具有重要意义。牛初乳和牛常乳129 个差异表达N-糖蛋白中有108 个N-糖蛋白在String数据库中收录,选取蛋白质互作得分大于0.9的筛选标准,共得到36 个差异表达糖蛋白(表1)的70 种相互作用(图6)。其中,F5、SERPINA1、ALB、APOH、CLU、LGALS3BP和SERPINF2连接度较高,具有9~12 个互作蛋白,这些具有高连接度的蛋白很可能是影响整个系统代谢和信号转导途径的关键点,具有重要作用[30]。

表1 蛋白互作网络中的差异表达糖蛋白Table 1 Differentially expressed whey N-glycoproteins in proteinprotein interaction network

图6 牛乳乳清差异N-糖蛋白的蛋白互作网络图Fig. 6 Protein-protein interaction network analysis of the differentially expressed whey N-glycoproteins in bovine milk
3 结 论
采用糖蛋白质组学技术,对不同泌乳期牛乳乳清N-糖蛋白的组成及其糖基化位点进行鉴定和差异分析,发现与常乳相比,初乳含有更多的糖蛋白,而且一些蛋白含有更多的糖基化位点。基于非标记定量,在牛初乳和牛常乳中鉴定到129 个糖蛋白的190 个差异表达糖基化位点。生物信息学分析表明,不同泌乳期牛乳乳清差异表达N-糖蛋白与不同泌乳期人乳乳清差异表达N-糖蛋白的GO功能注释和参与的KEGG代谢通路部分重叠,说明牛乳作为生产婴幼儿配方乳的主要原料,其乳清差异表达糖蛋白的某些功能与人乳乳清是相似的,可以提供一些与免疫和生长发育相关的糖蛋白,并参与到补体与凝血级联、吞噬作用和溶酶体等重要代谢通路中。本研究对蛋白质糖基化进行深入的研究,不仅丰富了乳N-糖蛋白质组成及其糖基化位点的相关信息,还阐明了不同泌乳期牛乳乳清差异表达糖蛋白的功能,找到了一些具有重要功能的糖蛋白,这为评价和改善牛乳品质、研发婴幼儿配方乳中糖蛋白质的改良及功能食品的生产提供理论依据。

