萤光素酶报告基因细胞模型在筛选靶向调控RAC1的大黄酸衍生物中的应用
李钊全,粟正英,梁丹丹,王春苗,蓝 富,李俊莹,田 炜,黎丹戎,侯华新
(广西医科大学1. 药学院,2. 生命科学研究院, 广西 南宁 530021;3. 广西国际壮医医院药学部, 广西 南宁 530201)
Ras相关的C3肉毒杆菌毒素底物1(Ras-related C3 botulinum toxin substrate 1,RAC1)是小分子G蛋白Rho GTPase家族Rac亚家族蛋白中的一员。大量文献报道,RAC1在细胞增殖、迁移、侵袭、细胞黏附、细胞运动、轴突形成等调控细胞生命活动中发挥重要作用[1]。RAC1在多种类型的恶性肿瘤中异常表达,包括肺癌、肝癌、乳腺癌、结肠癌、子宫颈癌等。RAC1在肿瘤细胞高表达会干扰细胞之间的黏附作用,促进细胞侵袭、迁移及肿瘤新生血管形成等[2]。解娜等[3]利用RNAi技术沉默结肠癌细胞RAC1的表达后,发现细胞增殖速度明显降低,并且能抑制裸鼠移植瘤的生长。抑制肿瘤细胞内RAC1的表达水平,有助抑制肿瘤的发生与发展。朱琳等[4]发现,RAC2能通过增强NADPH氧化酶活性,明显提高活性氧水平,增强黑色素瘤细胞的辐射敏感性。鼻咽癌(nasopharyngeal carcinoma,NPC)高发于我国华南、西南地区,是常见恶性肿瘤之一。放疗是NPC患者的主要治疗手段,但常发生放射抗拒,导致肿瘤的复发与转移。在课题组前期研究中,采用iTRAQ联合质谱技术,发现蒽醌化合物GXHSWAQ-1可调控NPC CNE1细胞RAC1蛋白表达,从而增加细胞对射线的敏感性[5]。这些研究结果提示,RAC1可能是肿瘤发生、发展的关键蛋白,可作为潜在的治疗靶点。
基于靶点设计与合成的候选化合物,其活性筛选的方法多种多样。萤光素酶报告基因系统是利用化学发光原理创建的一类新型药物筛选方法,具有高特异性、高灵敏度、不受激发光干扰、高通量筛选等优点,目前在靶点的筛选和验证应用中越来越广泛。本研究利用RAC1基因启动子序列,构建了萤光素酶-慢病毒重组质粒,转染至NPC CNE1细胞中,获得能稳定表达RAC1萤光素酶的稳转细胞株,通过萤光素酶活性和Western blot实验,检测课题组设计合成的系列化合物对RAC1靶向调控活性,为靶向RAC1的抗肿瘤化合物的筛选及修饰提供技术平台和理论依据。
1 材料与方法
1.1 材料
1.1.1质粒及细胞株 pLVX-AcGFP-Puro,由上海伯易生物科技有限公司提供。人高分化鼻咽鳞癌CNE1细胞,由广西肿瘤防治研究所提供。
1.1.2试剂与仪器 限制性内切酶EcoRI、BamHI、T4连接酶,购自日本TaKaRa公司;LipofectamineTM2000,购自美国Invitrogen公司;嘌呤霉素,购自北京索莱宝科技有限公司;萤光素酶报告基因检测试剂盒(ONE-GloTMReagent),购自美国Promega公司;GAPDH多克隆抗体,购自广州晶欣生物科技有限公司;RAC1单克隆抗体,购自美国Millipore公司。凝胶成像系统(美国Bio-Rad公司);EVOS FL Auto全自动细胞成像系统(美国Life Scientific公司);全波长酶标仪Microplate reader(美国Bio-Tek公司);Odessey双色红外成像系统(美国Licor公司)。
1.1.3受试化合物 化合物4a、H、B、C为课题组设计合成的系列大黄酸衍生物,其结构经过红外、质谱以及核磁共振波谱确证,化合物纯度经高效液相检测,达到98%以上,各化合物结构见Fig 1。大黄酸(rhein),购自南京郎泽生物医药;RAC1激活剂PMA,购自美国Cayman Chemical公司;RAC1抑制剂NSC23766,购自美国Selleck Chemicals公司。
1.2 含RAC1启动子萤光素酶报告基因细胞模型的构建与验证含RAC1启动子萤光素酶报告基因细胞模型的构建过程见Fig 2。
1.2.1含RAC1启动子萤光素酶报告基因质粒构建 以人RAC1启动子序列(GenBank:NM_006908)为靶序列,设计合成RAC1-promoter-Luc2重组序列,并加入EcoRI和BamHI酶切位点,经全基因合成后,获得质粒为pUC57-RAC1-promoter-Luc2载体。用EcoRI和BamHI对该载体和pLVX-AcGFP-Puro载体分别进行酶切获得目的片段,经PCR扩增和T4连接酶连接。重组构建pLVX-RAC1-Luc2-GFP-Puro质粒,并经酶切电泳和测序进行鉴定。
1.2.2慢病毒包装 将1.5×106个293T细胞接种于10 cm培养皿中,培养至细胞约80%融合。用LipofectamineTM2000转染试剂,将重组质粒和病毒包装质粒混合。转染48 h后,500×g离心10 min,收集病毒上清。
1.2.3稳转细胞系的构建 取对数生长期的CNE1细胞,以5×103个/孔的密度接种到6孔板。加入4 μL浓度为5 g·L-1的聚凝胺和500 μL的病毒液。病毒感染24 h后,撤去病毒液,胰酶消化细胞,将细胞按1 ∶100的稀释倍数接种至T75 cm2的培养瓶中。细胞贴壁24 h后,加入含2 ng·L-1嘌呤霉素的培养基,连续筛选2周,荧光显微镜观察细胞感染效率。获得稳定表达萤光素酶的CNE1细胞株,命名为CNE1-RAC1-Luc2。

Fig 1 Chemical structure of different tested compounds
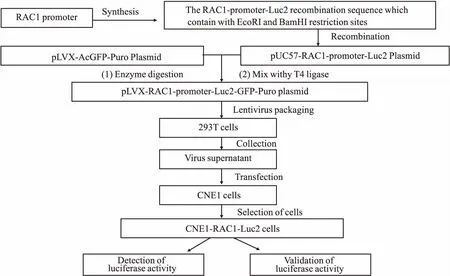
Fig 2 Workflow for construction of a cell model of luciferase reporter gene with RAC1 promoter
1.2.4萤光素酶报告基因活性检测 取对数生长期的CNE1和CNE1-RAC1-Luc2细胞,以5×103个/孔的浓度接种于萤光素酶检测专用的白色96孔板中,每孔细胞悬液100 μL,每组设置3个复孔。细胞贴壁24 h后,按照试剂盒(ONE-GloTMReagent)说明书,每孔加入100 μL含底物裂解液,于酶标仪上振荡裂解3 min后,立即检测各组细胞萤光素酶发光信号值。
1.2.5含RAC1萤光素酶报告基因检测系统的验证 取对数生长期的CNE1-RAC1-Luc2细胞,以5×103个/孔的数量接种于萤光素酶检测专用的白色96孔板中,每孔细胞悬液体积100 μL,每组设置3个复孔。细胞贴壁24 h后,分别加入浓度为对细胞抑制率小于20%的PMA(1.5 μmol·L-1)、NSC23766(30 μmol·L-1),孵育24 h后,按“1.2.4”的方法检测各组细胞萤光素酶发光信号值。
1.2.6Western blot检测RAC1激活剂与抑制剂对RAC1蛋白表达的调控 以无细胞毒浓度的RAC1激活剂与抑制剂处理细胞,以等量的完全培养液为空白对照。作用24 h后,加入RIPA/PMSF细胞裂解液,收集上清即为蛋白提取液。取100 μg蛋白样品,12% SDS聚丙烯酰胺凝胶电泳,湿法将蛋白转至NC膜。NC膜置于5%脱脂牛奶的TBST中孵育2 h。加入一抗RAC1(1 ∶500)和GAPDH(1 ∶1 000)孵育。加入远红外荧光二抗(1 ∶10 000)室温孵育,使用Odyssey红外扫膜仪扫描蛋白条带,通过灰度值统计软件测定各组样品灰度值。
1.3 受试化合物活性检测选取无细胞毒浓度的大黄酸衍生物4a(20 μmol·L-1)、H(2 μmol·L-1)、B(5 μmol·L-1)、C (5 μmol·L-1)、大黄酸(20 μmol·L-1)为实验组,同时设置不加药的空白对照组。各化合物作用CNE1-RAC1-Luc2细胞24 h后,按“1.2.4”的方法检测各组细胞萤光素酶发光信号值。同时,收集经上述各化合物处理24 h后的各组细胞,裂解后,采用Western blot检测各化合物对RAC1蛋白表达的影响。
2 结果
2.1 pLVX-RAC1-Luc2-GFP-Puro萤光素酶报告基因重组质粒鉴定含有RAC1基因启动子片段的重组质粒经EcoRI和BamHI双酶切后,在Fig 3条带1中的4 000 bp和9 000 bp附近可见到两条明亮的条带,与插入的RAC1-Luc2(3 700 bp左右)目的片段和pLVX-AcGFP-Puro(8 700 bp左右)载体片段长度一致,表明目的序列成功插入且序列大小正确,经过测序发现目的序列与预期设计的寡核苷酸序列完全一致,萤光素酶重组报告质粒成功构建。
2.2 CNE1-RAC1-Luc2稳转细胞株筛选经浓度为2 ng·L-1的嘌呤霉素连续筛选2周后,获得稳定表达萤光素酶的CNE1-RAC1-Luc2细胞,细胞感染绿色荧光(GFP)效率达90%以上,见Fig 4。
2.3 CNE1-RAC1-Luc2稳转细胞萤光素酶活性检测Fig 5的萤光素酶活性实验结果显示,以不感染病毒的CNE1细胞为空白对照,感染了慢病毒的CNE1-RAC1-Luc2细胞萤光素酶活性明显高于空白对照(P<0.05)。结果表明,RAC1基因启动子序列已经准确插入到萤光素酶基因上游,并在CNE1细胞内正常启动萤光素酶基因的表达。

Fig 3 Electrophoresis of recombinant plasmid of pLVX-PRAC1-Luc2-GFP-Puro digested with double restriction endonuclease
M:DNA marker; 1:Digested with EcoRI/BamHI; 2:Plasmid DNA.
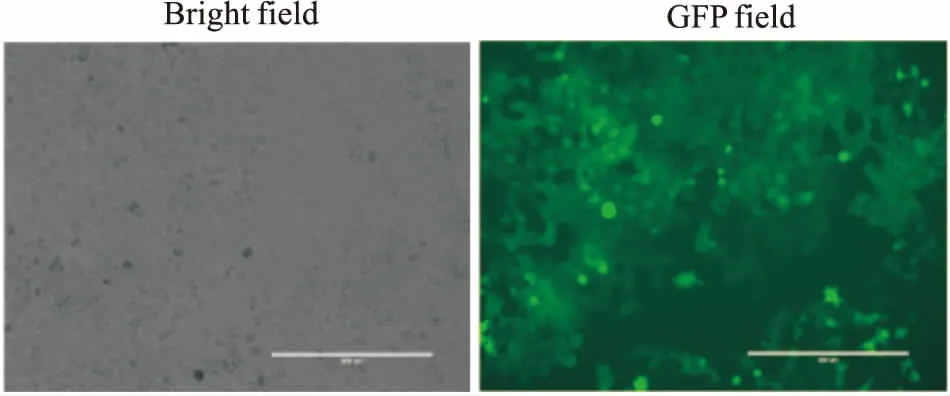
Fig 4 Expression efficiency of green fluorescence protein in CNE1-RAC1-Luc2 cells(×100)
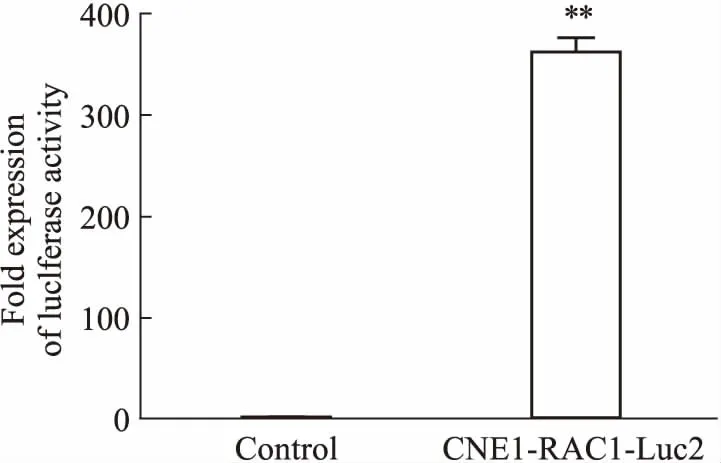
Fig 5 Expression activity of luciferase in CNE1-RAC1-Luc2

**P<0.01vscontrol
2.4 RAC1萤光素酶报告基因系统筛选活性验证采用无细胞毒浓度的RAC1激活剂PMA和抑制剂NSC23766作用CNE1-RAC1-Luc2细胞48 h后,检测对细胞萤光素酶RAC1活性的影响。如Fig 6A所示,与空白对照相比,RAC1激活剂PMA可提高萤光素酶活性(P<0.05),而RAC1抑制剂NSC23766抑制细胞的萤光素酶活性(P<0.05)。同时,采用Western blot检测NSC23766和PMA对RAC1蛋白表达的影响,如Fig 6B所示,与空白对照相比,NSC23766能有效下调CNE1细胞RAC1蛋白表达水平(P<0.05),而PMA则相反(P<0.05)。
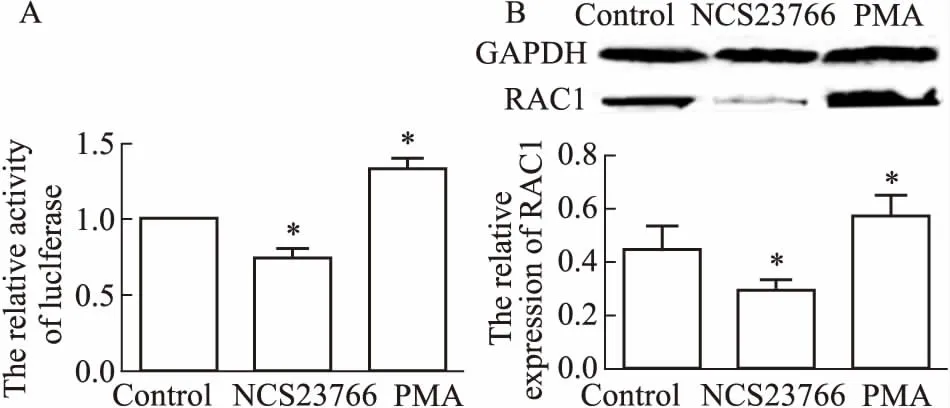
Fig 6 Validation of screening activity of RAC1 by
A:Effects of NSC23766 and PMA on luciferase activity of CNE1-RAC1-Luc2 cells; B:Expression of RAC1 after treatment with NSC23766 and PMA by Western blot.*P<0.05vscontrol.
2.5 系列化合物对RAC1的靶向调控作用大黄酸及其衍生物B、C、4a、H以无细胞毒浓度作用CNE1-RAC1-Luc2细胞48 h后,检测各组细胞萤光素酶活性的变化。与空白对照相比,大黄酸及衍生物C能够增加萤光素酶活性(P<0.05);而衍生物4a、H可抑制细胞的萤光素酶活性(P<0.05),衍生物B基本上不影响萤光素酶活性的变化(Fig 7A)。Fig 7B的Western blot结果显示,相比于空白对照,大黄酸及其衍生物C上调RAC1的表达(P<0.05),衍生物4a、H下调RAC1蛋白的表达(P<0.05)。
3 讨论
大多数药物通过与体内分子“靶标”的相互作用而产生疗效,靶点的发现已成为当今创新药物研究的焦点。目前,基于RAC1为靶点的抗肿瘤药物筛选、设计合成的研究已有一些报道。Xie等[6]发现,一个新型天然大环内酯类化合物F086能通过下调RAC1,抑制食管鳞状细胞癌细胞骨架的装配,促进细胞凋亡。Montalvoortiz等[7]还发现了一种新的Rac抑制剂EHop-016,比已有的Rac抑制剂效果更好,并在白血病治疗中显示出独特的优势。因此,以RAC1及其下游信号通路为靶点的抗肿瘤药物筛选细胞模型的构建,对促进靶向RAC1的抗肿瘤药物的设计与研发有积极意义。
迄今已报道的萤光素酶报告基因药物筛选体系主要有:(1)受体激动剂/抑制剂的筛选体系[8];(2)信号通路的筛选体系[9];(3)靶基因3’非编码区(3′UTR)的筛选体系[10];(4)靶基因启动子的筛选体系[11]。前3种方法由于存在靶向性低、假阳性或假阴性等结果的弊端,未能在药物的筛选中有效使用。基因启动子含有RNA聚合酶特异性结合和转录起始所需的保守序列,能对基因的转录水平进行调控[12-13]。因此,基于靶基因启动子的靶向药物筛选体系与上述3种体系相比具有一定的优越性,可以特异性筛选引起目的基因转录活性改变的活性小分子。本研究根据RAC1启动子序列设计合成pLVX-RAC1-Luc2-GFP-Puro萤光素酶-慢病毒重组质粒,转染至CNE1细胞中,成功获得稳定表达萤光素酶的CNE1-RAC1-Luc2细胞,为筛选靶向调控RAC1基因启动子活性和RAC1蛋白表达活性的候选化合物提供了一个实用的细胞模型。

Fig 7 Targeted regulation of RAC1 by a series
A:Effects of a series of rhein derivative compounds on luciferase activity; B:Expression of RAC1 after treatment with a series of rhein derivative compounds by Western blot.*P<0.05vscontrol.
课题组前期研究发现,含蒽醌母核结构的大黄素、大黄酸及多种蒽醌类化合物,可以靶向调控RAC1活性,增加NPC细胞对射线的敏感性,抑制卵巢癌细胞的转移与侵袭[14-15]。本研究所使用的受试物为在大黄酸蒽醌母核结构上引入喹唑啉环的系列化合物,期待能发现更多活性高、毒性低,针对RAC1靶向性良好的化合物。采用含RAC1启动子的萤光素酶报告基因检测系统发现:受试化合物对RAC1萤光素酶的活性的激活或抑制与Western blot结果一致。研究结果表明,所构建的含RAC1启动子的萤光素酶报告基因的细胞模型可用于靶向调控RAC1启动子化合物的筛选,具有快速、灵敏、操作简便的优点,可指导针对RAC1为靶点的化合物设计、修饰与筛选,提高药物的研发效率。
——一道江苏高考题的奥秘解读和拓展