光遗传技术通过Wnt/β-Catenin通路对新生神经元的影响*
夏天光, 朱 旭,2, 王景景, 魏孟广, 吕方方, 陈 翀, 梁 军, 姜 伟, 孙 倩, 孙洪涛△
(1. 武警特色医学中心脑创伤与神经疾病研究所, 天津 300162; 2. 邯郸市中心医院神经外科, 河北 056002; 3. 天津大学医学工程与转化医学研究院, 天津 300072)
创伤性脑损伤(traumatic brain injury,TBI)是导致青少年残疾和死亡的主要原因之一[1,2]。TBI可导致患者学习和记忆障碍,这是由于TBI引起的海马神经元死亡所致[3]。促进神经元再生被认为是较好的治疗TBI的策略之一,新生神经元在学习和记忆中起着重要的作用[4]。然而,创伤后不能成熟的新生神经元将在新生后第一周至第二周死亡。损伤区缺氧和毒素累积导致新生细胞成熟度下降[5,6]。因此,改善TBI后新生神经元的存活率和诱导神经元成熟是TBI后面临的主要挑战之一。
在神经元发育过程中,动作电位对新生神经元的成熟和功能性突触的形成至关重要[7]。研究人员利用电极刺激使细胞膜去极化产生动作电位激活神经元回路[8]。光遗传学方法中蓝光可激活视紫红质通道蛋白-2(channelrhodopsin-2,ChR2),使膜去极化并触发动作电位。特定启动子下的ChR2工程细胞为膜去极化和神经元兴奋的研究提供一种新的且强有力的方法。利用光遗传学方法产生动作电位克服了传统技术的局限性,可以从时间和空间上精确操控新生神经元的电生理活动。
Wnt信号通路主要调控细胞的增殖、分化、迁移和凋亡等过程,其中,经典的Wnt/β-actenin 信号通路在神经系统发育过程中起重要的作用[9]。本研究中,我们用携带DCX-ChR2-EGFP基因的慢病毒感染神经干细胞(neural stem cell,NSCs),DCX识别新生神经元并观察光遗传学能否通过ChR2通道蛋白诱导膜电位产生动作电位促进新生神经元成熟。同时,我们进一步研究体外诱导新生神经元成熟过程中Wnt/β-catenin信号途径相关分子水平的变化,以探索Wnt/β-catenin和新生神经元成熟的关系,为后续研究光遗传学诱导新生神经元成熟治疗TBI奠定基础。
1 材料与方法
1.1 实验动物、主要试剂与仪器
实验动物为孕14 d的SD大鼠,由军事医学科学院实验动物中心提供。实验仪器:离心机(美国Thermo Fisher公司),SA300V型全自动高压灭菌仪(美国Thermo Fisher公司),自动超纯水仪(美国Thermo Fisher公司),二氧化碳细胞培养箱(美国Thermo Fisher公司),相差倒置荧光显微镜及照相装置(德国Leica公司)。实验试剂:荧光标记二抗(Sigma公司),神经巢蛋白(Nestin)抗体(Pharmingen公司),胎牛血清和含有F12的DMEM培养基(美国Gibco公司)。DCX-ChR2-EGFP和DCX-EGFP基因的慢病毒(中国上海和元生物公司)。
1.2 NSCs的分离与培养
NSCs分离与培养步骤[10]如下:将SD大鼠乙醚麻醉后置于75%乙醇中浸泡1 min,冰上取胎鼠大脑皮层组织,眼科剪剪碎,置于培养基中用200目不锈钢滤网进行研磨,过滤后得到细胞悬液。将滤液转移至离心管中1 000 r/min离心5 min,弃上清液。经0.25%胰酶消化后再次离心5 min,弃上清后加入NSCs培养基(DMEM/F12,20 ng/ml EGF,20 ng/ml bFGF和2% B27添加剂)重悬细胞,细胞计数,以1.5×106cells/ml的密度接种于培养瓶中。2~3 d静置换液,每7 d传代1次。
1.3 实验分组与处理
实验细胞分为3组(n=3):对照组、NSCs+EGFP和NSCs+ChR2组。其中对照组为正常培养的NSCs(NSCs组);NSCs+EGFP组为携带DCX-EGFP基因慢病毒感染神经干细胞组;NSCs+ChR2组为携带DCX-ChR2-EGFP基因慢病毒感染神经干细胞组。
1.4 慢病毒感染携带DCX-ChR2-EGFP和DCX-EGFP基因的新生神经元并采用光学刺激新生神经元
分别用携带DCX-ChR2-EGFP和DCX-EGFP基因的慢病毒感染新生神经元。病毒颗粒滴度约为每毫升3×108粒。感染复数(MOI)为1∶50。然后采用470 nm DPSS激光器(OEM 激光系统)激发产生蓝色激光,通过标准的40倍浸水显微镜物镜照射在培养基中(脉冲5 ms,2Hz)。病毒感染48 h后,连续3 d蓝激光照射各组NSCs。
1.5 采用L-型钙通道阻断剂维拉帕米或β-catenin抑制剂Dkk1干预NSCs+ChR2组细胞
慢病毒DCX-ChR2-EGFP感染NSCs 48 h后,采用L-型钙通道阻断剂100 μmol/L维拉帕米或50 μg/ml的β-catenin抑制剂Dkk1处理NSCs+ChR2组细胞,然后行Western blot检测各组MAP2、NeuN、Neurog2、NeuroD1和GluR2蛋白表达水平。
1.6 Western blot检测各组MAP2、NeuN、Neurog2、NeuroD1、GluR2、TCF4和β-catenin蛋白表达水平
提取对照组、NSCs+EGFP组和NSCs+ChR2组细胞蛋白,根据BCA试剂盒测定上清液中蛋白质的浓度,12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离,NC膜转膜,5%脱脂牛奶封闭1 h,加入一抗(MAP2、NeuN、Neurog2、NeuroD1、GluR2、TCF4和β-catenin),4℃孵育过夜,次日,小鼠或抗兔IgG二抗(1∶5 000)在37℃下孵育1 h,ECL化学发光显色法显色并曝光显影。用定量软件(Bio-Rad)测定灰度值。
在NSCs+ChR2组培养基中加入100 μm维拉帕米或50 μg/ml Dkk 1进行功能阻断实验。再按照上述步骤测定MAP2、NeuN、Neurog2、NeuroD1和GluR2蛋白的表达。
1.7 免疫荧光染色检测各组DCX和NeuN的表达情况
光刺激3 d后,各组细胞采用4%多聚甲醛固定30 min,加入0.5% Triton X-100破膜30 min, BSA封闭15 min,加入一抗DCX和NeuN 4℃孵育过夜,次日,加入相应的荧光二抗孵育1 h,然后行Hoechst染色后缓冲甘油封片,在倒置荧光显微镜下观察。
1.8 统计学处理
2 结果
2.1 3组NeuN+阳性细胞和NeuN+/Hoechst比值的比较
各组细胞经470 nm 蓝光连续照射3 d后,NSCs组、NSCs+EGFP和NSCs+ChR2三组均有成熟神经元表达的NeuN+(红色),NeuN+细胞密度分别为7350±632、8400±713、18700±1185。NSCs+ChR2组NeuN+阳性细胞密度显著高于NSCs组和NSCs+EGFP组(图1A,P<0.01),而NSCs组和NSCs+EGFP组二者之间比较差异无统计学意义。三组NeuN+/Hoechst比值分别为82±7、80±4和93±8。NSCs+ChR2组NeuN+/Hoechst比值显著高于NSCs组和NSCs+EGFP组(P<0.05,图1见彩图页Ⅰ)。
2.2 ChR2通道对MAP2、NeuN、Neurog2、NeuroD1、GluR2蛋白表达水平的影响
与NSCs组和NSCs+EGFP组相比,MAP2、NeuN、Neurog2、NeuroD1、GluR2蛋白在NSCs+ChR2组呈高表达(P<0.01)。NSCs组与NSCs+EGFP组两者比较,差异无统计学意义(图2,表1)。
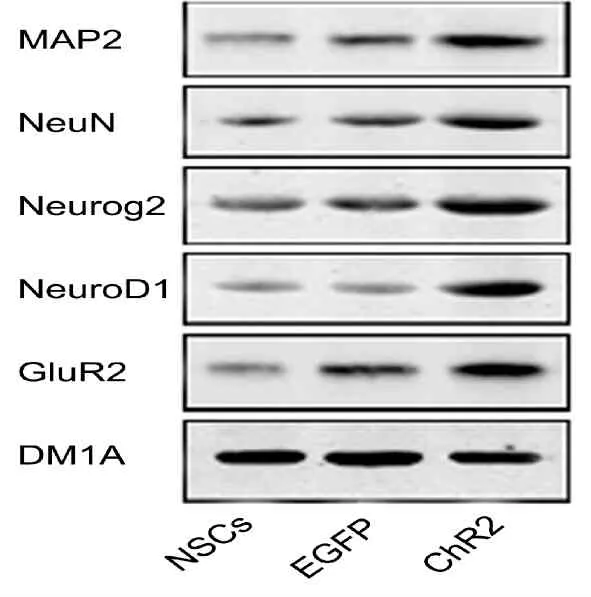
Fig.2The effects of ChR2 channel on the expressions of MAP2, NeuN, Neurog2, NeuroD1and GluR2 protein
2.3 维拉帕米拮抗钙离子通道对MAP2、NeuN、Neurog2、NeuroD1、GluR2蛋白表达水平的影响
与NSCs组对比, MAP2、Neurog2、NeuroD1、GluR2蛋白在NSCs+ChR2组呈高表达(P<0.05,P<0.01)。加入维拉帕米抑制剂(Verap组)后,与NSCs+ChR2组相比,MAP2、Neurog2、NeuroD1、GluR2蛋白表达明显被抑制(P<0.05)。NeuN蛋白在NSCs+ChR2组呈高表达,与NSCs组对比,差异具有统计学意义。加入维拉帕米抑制剂(Verap组)后,NeuN蛋白表达明显被抑制,与NSCs+ChR2组对比(图3,表2)。

Tab. 1 Quantitative analysis of the expressions of MAP2, NeuN, Neurog2, NeuroD1 and GluR2 n=3)
NSCs: Neural stem cells
**P<0.01vsNSCs group

Fig.3The effects of calcium channel blocker verapamil on the expressions of MAP2, NeuN, Neurog2, NeuroD1 and GluR2 protein
2.4 Wnt/β-catenin信号通路相关蛋白β-catenin和TCF4的表达结果
β-catenin和TCF4蛋白在NSCs+ChR2组呈高表达,与NSCs组和NSCs+ EGFP组相比,差异具有统计学意义(P<0.01,图4,表1)。
2.5 β-catenin抑制剂Dkk1对MAP2、NeuN、Neurog2、NeuroD1、GluR2蛋白表达的影响
MAP2、NeuN、Neurog2、NeuroD1、GluR2蛋白在NSCs+ChR2组呈高表达,与NSCs组对比,差异具有统计学意义(P<0.01)。加入β-catenin抑制剂Dkk1(Dkk1组)后,与NSCs+ChR2组对比,MAP2、Neurog2、NeuroD1、GluR2蛋白表达明显被抑制(P<0.05,P<0.01)。NeuN蛋白表达明显被抑制,与NSCs+ChR2组对比,差异具有统计学意义(P< 0.05,图5,表3)。
3 讨论
TBI后新生神经元的成熟度较低,本研究选择光遗传学方法激活新生神经元产生动作电位,以提高神经元的成熟度。为了得到具有DCX-ChR2-EGFP阳离子通道的新生神经元,本研究利用携带DCX-ChR2-EGFP基因的慢病毒感染从胎鼠提取并在体外培养的神经干细胞。470 nm的蓝光可以有效刺激ChR2通道开放,阳离子内流产生细胞膜动作电位。这些电生理的变化可以通过Wnt/-catenin信号通路促进新生神经元的成熟。
电活动存在于成体神经发生的各个阶段,通过基因表达和信号调节影响新生细胞的成熟,尤其在神经分化阶段起着关键作用[11,12]。研究表明,有丝分裂后神经细胞通过膜去极化引起钙离子通道开放,钙离子内流来影响神经元的存活、成熟并产生功能活动[13]。细胞膜上的钙通道开放可以抑制新生神经元分化为胶质细胞并激活NeuroD基因使新生神经元向神经元转化[7]。细胞去极化的方法很多,然而传统的电生理技术缺乏精确控制对靶向细胞的刺激,无法达到调控神经元或特定种类细胞电生理活动的目的[14]。光遗传学是利用基因工程将光敏感性离子通道蛋白转入细胞或动物体内,以特定波长的外源性光照射(刺激)激活或抑制表达在细胞或动物体内的光敏感通道蛋白形成离子流,引起细胞膜电位超级化或去极化,从而达到调控从时间和空间上精确调控细胞的电生理活动的目的[15]。如今,光遗传学通过激活靶向基因刺激神经元电生理活动的技术已被用于多种实验模型中研究复杂神经元网络的功能[16,17]。然而,大多数研究使用光遗传学调控细胞群或神经回路。光遗传学调控光敏阳离子通道ChR2产生动作电位促进神经元成熟很少被研究。本研究中,光遗传学作为细胞膜去极化产生动作电位的工具,CHR2通道是细胞产生电活动变化的途径,利用DCX-ChR2-EGFP慢病毒感染细胞并表达,验证光遗传学促进新生神经元成熟的可行性。结果发现NSCs组、NSCs+EGFP和NSCs+ChR2三组均有成熟神经元表达,NSCs+ChR2组成熟神经元阳性细胞密度显著高于NSCs组和NSCs+EGFP组。提示光遗传学能通过ChR2通道蛋白诱导神经元产生动作电位并促进新生神经元成熟。同时,还进一步研究体外诱导新生神经元成熟过程中Wnt/β-catenin信号途径相关分子水平的变化,以探索Wnt/β-catenin和新生神经元成熟的关系,结果发现应用L-型钙通道阻断剂维拉帕米或β-catenin抑制剂Dkk1后,神经元的成熟过程受到抑制,说明光诱导ChR2通道产生动作电位与钙离子内流具有较高的相关性。

Tab. 2 Quantitative analysis of the expressions of MAP2, NeuN, Neurog2, NeuroD1 and GluR2 n=3)
*P<0.05,**P<0.01vsthe NSCs group;#P<0.05,##P<0.01vsChR2 group
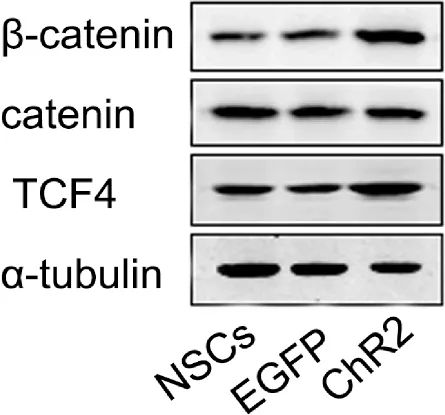
Fig.4The expressions of β-catenin and TCF4 associated with Wnt/β-catenin signal channel
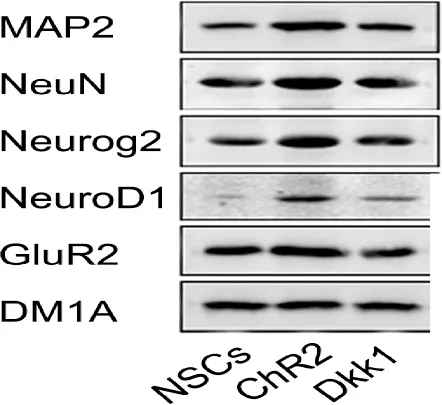
Fig.5The effects of β-catenin inhibitor Dkk1 on the expressions of MAP2, NeuN, Neurog2, NeuroD1 and GluR2 protein
Tab. 3 Quantitative analysis of the expressions of MAP2, NeuN, Neurog2, NeuroD1 and GluR2 protein n=3)
*P<0.05,**P<0.01vsthe NSCs group;#P<0.05,##P<0.01vsChR2 group
DCX(Doublecortin)基因编码一种40 kDa的双链微管相关蛋白,缺乏DCX的新生神经元会产生严重的形态学缺陷和迟发性迁移。DCX主要在神经元前体和新生神经元中表达[18,19]。研究证实,新生细胞成熟经历了两个关键时期,一个是中间祖细胞和神经母细胞时期,另一个是未成熟神经元整合时期[20]。新生神经元在这两个关键时期均表达DCX。Walker等[21]从孕鼠,新生鼠和成年鼠脑中分离DCX阳性细胞,发现DCX阳性细胞在神经元前体阶段的表达是较高的。另外,在成年人的神经发生过程中,DCX只在增殖的神经元祖细胞和有丝分裂后的神经元前体中短暂表达[22]。慢病毒转入DCX基因使新生神经元具有较长的观察时间窗。在本实验中,用携带DCX-ChR2-EGFP基因的慢病毒感染新生神经元,利用DCX的表达水平检测光遗传学对细胞成熟度的影响,发现激光照射3 d后新生神经元的DCX表达量明显下降,证明光遗传学方法促进新生神经元成熟是可行的。
Wnt信号通路在新生神经元的神经分化中起着重要的作用,近年来成为各种疾病机制研究的热点[23]。Wnt信号通路中,β-catenin是TCF/LEF转录因子的转录激活因子,同时调节Wnt靶基因的表达,其中包括NeuroD1[24]。NeuroD1被证明在神经元分化过程中具有至关重要的作用[25]。本研究用Western blot检测β-catenin和TCF4蛋白表达水平,并用β-catenin抑制剂Dkk1抑制Wnt/β-catenin信号通路后检测神经元成熟的相关蛋白MAP2、NeuN、Neurog2、NeuroD1、GluR2,发现新生神经元的成熟与Wnt/β-catenin信号通路密切相关。
本研究结果表明,光遗传学通过激活ChR2通道蛋白诱导膜电位产生动作电位促进新生神经元成熟。体外诱导新生神经元成熟过程中Wnt/β-catenin信号发挥了至关重要的作用。为后续实验研究光遗传学诱导新生神经元成熟治疗TBI奠定基础。
——从一道浙江选考生物学试题谈起

