Exendin-4对成年小鼠脑室下区神经干细胞分化作用的体外研究*
赵 飞, 徐会友, 马 柯, 江继鹏, 张 健, 代 晨, 靳 颖, 李 平, 孙洪涛, 王振国△, 陈旭义△
(1. 锦州医科大学研究生院, 辽宁 锦州 121000; 2. 武警特色医学中心脑科中心, 武警部队脑创伤与神经疾病研究所, 天津市神经创伤修复重点实验室, 天津 300162)
成年哺乳动物大脑中的NSCs不断产生新的神经元和神经胶质细胞,这一过程被称为成体神经发生,主要发生在SVZ和海马齿状回[1]。在临床上NSCs的这一能力提供了基于细胞的药物疗法,如帕金森病,阿尔茨海默病,亨廷顿舞蹈病和脊髓损伤[2]。但是,成熟脑中NSCs的行为仍知之甚少。理论上讲,NSCs可以用于治疗脊髓损伤和其他神经系统疾病,因为分化的神经元将有可能取代受伤的神经元重建神经回路。然而,实际情况中只有少数NSCs分化为神经元,其大部分分化为神经胶质细胞[3]。研究如何促进NSCs分化为神经元揭示其中所涉及的分子和信号通路的作用,对促进创伤和退行性神经疾病治疗的发展至关重要。
胰高血糖素样肽-1 (glucagon-likepeptide1,GLP-1)是由肠道分泌的肠道胰岛素,其增加细胞葡萄糖摄入以降低血糖[4]。最近的研究表明,GLP-1的功能不仅可以降低血糖,还可以作为神经元存活,神经突向外生长的神经营养因子,保护突触可塑性和记忆形成[5]。据报道,静脉给予的GLP-1受体激动剂Ex-4可以穿过血脑屏障到达大脑发挥作用,调节摄食,葡萄糖和脂质代谢,控制体重,认知功能,心血管功能和情绪反应[6]。由于Ex-4在中枢神经系统中的多效性,我们开始研究Ex-4是否可以调节成熟小鼠脑SVZ中NSCs的增殖和分化。
1 材料与方法
1.1 实验材料
5周龄C57BL/6J小鼠购于北京维通利华实验动物有限公司(NO.2017-1218)。DMEM/F12培养基,碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF),表皮细胞生长因子(epidermal growth factor,EGF),B27无血清培养添加剂,0.25%胰蛋白酶/EDTA,Accutase酶等购自美国Hyclone公司,Ex-4购自美国Cayman公司,shRNA序列由中国上海Gene Pharma合成,BCA蛋白定量试剂盒,蛋白酶抑制剂,磷酸酶抑制,RIPA裂解液,磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自美国Sigma公司,GLP-1R抗体,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体, GFAP抗体,β-tublin III抗体,nestin抗体,Western blot二抗和免疫荧光二抗购自美国Abcam公司,如无另行说明,其余试剂耗材购自美国Cell Signaling Technology公司。
1.2 NSCs的提取培养
取5周龄C57BL/6J小鼠,分离侧脑室的前壁置于补充有100 U/ml青霉素和100 μg/ml链霉素的PBS溶液中,在0.25%胰蛋白酶/ EDTA中消化机械解离。 通过70 μm细胞过滤器将细胞以800 r/min离心沉淀5 min。 然后将细胞重悬于含有1%B27, 20 ng/ml EGF和20 ng/ml bFGF的DMEM/F12培养基中。 细胞培养3 d增殖形成神经球。 用Accutase酶解离神经球,取培养第3代的细胞用于实验。
1.3 实验设计
从5周龄C57BL/6J小鼠SVZ提取神经球传至第三代行免疫荧光染色鉴定nestin以及GLP-1R的表达,用不含细胞因子bFGF,EGF的培养基进行培养以观察其分化,在分化的第14日行β-tublin III,GFAP,GLP-1R和p-CREB的荧染色观察。在敲低GLP-1R时,将靶序列以及对照序列包装慢病毒载体,以40感染复数(multiplicity of infection,MOI)配置含病毒的感染液,以105cells/ml的密度制备NSCs单细胞悬液接种于6孔板,加入6 μg/ml 的poly-brene于37℃,5%CO2条件下感染48 h,Western blot验证shRNA的敲低效果。将细胞分为对照组,Ex-4组,GLP-1R 敲低组,GLP-1R敲低+Ex-4组,各组细胞用100 nmol/L Ex-4处理20 min后Western blot检测细胞内CREB的活化,在分化第14日行β-tublin III和GFAP的免疫荧光染色,用Image J软件统计β-tublin III阳性细胞的比例,每组设置三个孔,每孔评估至少10个随机区域。研究MAPK和PI3K通路时,将细胞以105cells/ml密度重悬于6孔板,将U0126以0.07 μmol/L预处理细胞30 min以抑制MAPK通路,将LY294002以50 μmol/L的浓度预处理2 h以抑制PI3K通路,将NSCs分为对照组,Ex-4组,U0126组,U0126+Ex-4组,LY294002组,LY-294002+U0126组,Ex-4处理24 h,Western blot检测细胞中CREB的活化情况,每组设置三个孔。
1.4 shRNA敲低GLP-1R
GLP-1R shRNA靶序列是5'-GCCCTCAAGTGGATGTATAGC-3'。 ctrl shRNA序列5'-TTCTCCGAACGTGTCACGT-3'作为对照序列,由Gene Pharma公司合成并包装慢病毒颗粒。按照MOI分为对照组,20,40,60组并分别制备含病毒载体的感染液,将NSCs以105cells/well用感染液制备成单细胞悬液接种于6孔板上,于37℃,5%CO2条件下培养10 h后更换新鲜培养基。于48 h观察各组荧光表达情况,确定最佳MOI的感染效率,加入不同浓度的poly-brene 2、3、6 μg/ml重复感染步骤,观察细胞生长情况和感染效率,确定最佳MOI为40,最佳poly-brene浓度为6 μg/ml,使用此感染条件重复感染收集细胞,Western blot检测GLP-1R的敲低。
1.5 免疫荧光检测NSCs分化为神经元的比例
分化培养14 d用PBS漂洗细胞三次,用4%多聚甲醛固定15 min后PBS漂洗三次。用含有 0.1%TritonX-100的PBS 室温孵育20 min用PBS洗涤,室温下5%BSA封闭1 h,将一抗4℃孵育过夜。本研究使用以下一抗:抗nestin抗体,抗GFAP抗体,抗β-tublin III抗体和抗p-CREB抗体。用PBS洗涤细胞三次,选择合适的荧光二抗在室温下温育2 h,然后用DAPI染色细胞核。荧光显微镜观察细胞。从三个不同的孔计数β-tublin III和GFAP阳性细胞的数量,每孔评估至少10个随机区域。基于DAPI阳性细胞的总数来计算神经元占总细胞的百分比。
1.6 Western blot检测细胞表型及CREB的活化
用PBS漂洗细胞,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液。在几次冻融循环收集裂解溶液,通过在13 000 r/min离心20 min提取总蛋白质。使用BCA蛋白质测定系统测定蛋白质浓度。通过SDS-PAGE分离蛋白,100 V转膜90 min将蛋白转移到PVDF膜上。用10%脱脂牛奶在PBST(含有0.1%Tween-20的PBS)中封闭膜1h。将PVDF膜在4℃下与一抗孵育过夜,使用的一抗有:抗GLP-1R抗体,抗GFAP抗体,抗β-tublin III抗体,抗nestin抗体,抗CREB抗体,抗p-CREB抗体和抗GAPDH抗体。过夜孵育后用PBST洗涤三次,用对应的二抗室温下温育2 h。用PBST洗涤PVDF膜三次,用M5 Hiper ECL Western HRP发光液显现PVDF膜上的蛋白采集图片。用Image J软件定量条带的灰度值。
1.7 统计学处理
2 结果
2.1 Ex-4促进NSCs向神经元分化
从成年C57BL/6J小鼠脑SVZ中分离的细胞悬浮培养,在第3日形成神经球(图1A)。免疫荧光染色观察到NSCs中nestin阳性(图1B)。在分化14 d,相比于对照组(图2左),100 nmol/L Ex-4的处理产生了更多神经元样的细胞(图2右)。Western blot提示此时Ex-4组的神经元标志物β-tublin III的表达升高(图3)。
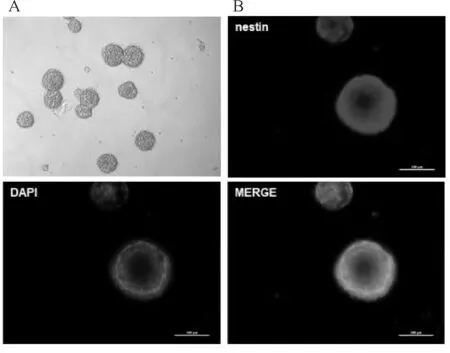
Fig.1Immunofluorescence identification of NSCs drived from SVZ
A: SVZ-derived neural stem cells derived from 5-week-old mice proliferate to form neurospheres in a medium containing B27, bFGF, and EGF (×100); B: NSCs were labeled with nestin and DAPI (×250)
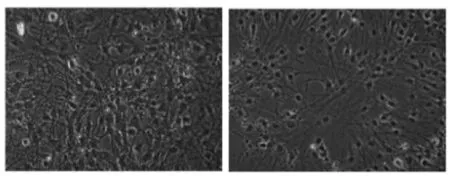
Fig.2Cell morphology after 14 days of control (left) and Ex-4 (right), note the cells with more neuronal morphology in the right panel (×100)

Fig.3Expression of β-tublin III in control or Ex-4 group after 14 days of differentiation of NSCs
2.2 NSCs分化时神经元和神经胶质细胞中GLP-1R的表达
免疫荧光观察到神经球中nestin以及GLP-1R的阳性(图4)。更换不含bFGF和EGF的培养基后NSCs开始分化,免疫荧光观察到分化过程中nestin和GLP-1R的表达(图5)。在分化的第14日,免疫荧光观察到β-tublin III和GLP-1R的共标记,提示神经元细胞中存在GLP-1R的表达(图6),GFAP和GLP-1R未发现共标记,提示神经胶质细胞中可能不存在GLP-1R的表达(图7,图4至图7见彩图页Ⅱ)。
2.3 敲低GLP-1R后Ex-4对NSCs分化为神经元的影响
为了研究Ex-4在NSCs分化中的作用,用shRNA敲低NSCs中的GLP-1R用Western blot检测效果(图8)。将敲低GLP-1R的NSCs用Ex-4处理分化14 d,用β-tublin III(灰色)和GFAP(红色)标记细胞(图9,见彩图页Ⅰ)。对每组β-tublin III阳性细胞的计数分析显示,NSCs分化14 d时对照组仅有10%的神经元,Ex-4组这一比例提升至22%,而GLP-1R 敲低+Ex-4组神经元的比例为11%(表1)。这表明Ex-4促进NSCs向神经元分化。
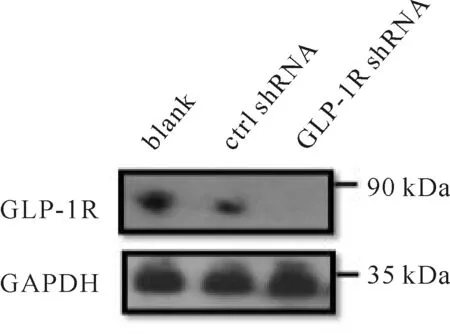
Fig.8NSCs after 48 h shRNA transfection(MOI=60, polybrene=6 μg/ml)
2.4 NSCs分化时Ex-4对CREB的活化作用
有研究指出Ex-4通过活化细胞内CREB信号来产生神经保护作用[7]。之前的研究发现,GLP-1R在神经元细胞中有所表达,但似乎不在神经胶质细胞中表达。而CREB的活化状态似乎也与之相关:Ex-4的处理可以显著增加β-tublin III阳性细胞中CREB的活化(图10,见彩图页Ⅱ),GFAP阳性的星形胶质细胞中没有观察到CREB的活化 (图11,见彩图页Ⅱ)。Western blot数据表明,Ex-4可以显著增加NSCs中CREB活化,敲低GLP-1R使Ex-4对CREB的活化作用消失(图12,表1)。


Groupβ-tubulin III-positive cells (%)Activation of CREB (%)ctrl shRNA10.010±2.366100.167±7.985ctrl shRNA+Ex-422.333±2.875**445.833±19.793##GLP-1R shRNA10.963±2.71498.333±9.395GLP-1R shRNA+Ex-411.890±2.449100.833±10.187
**P<0.01vsGLP-1R shRNA+Ex-4 group;##P<0.01vsGLP-1R shRNA+Ex-4 group
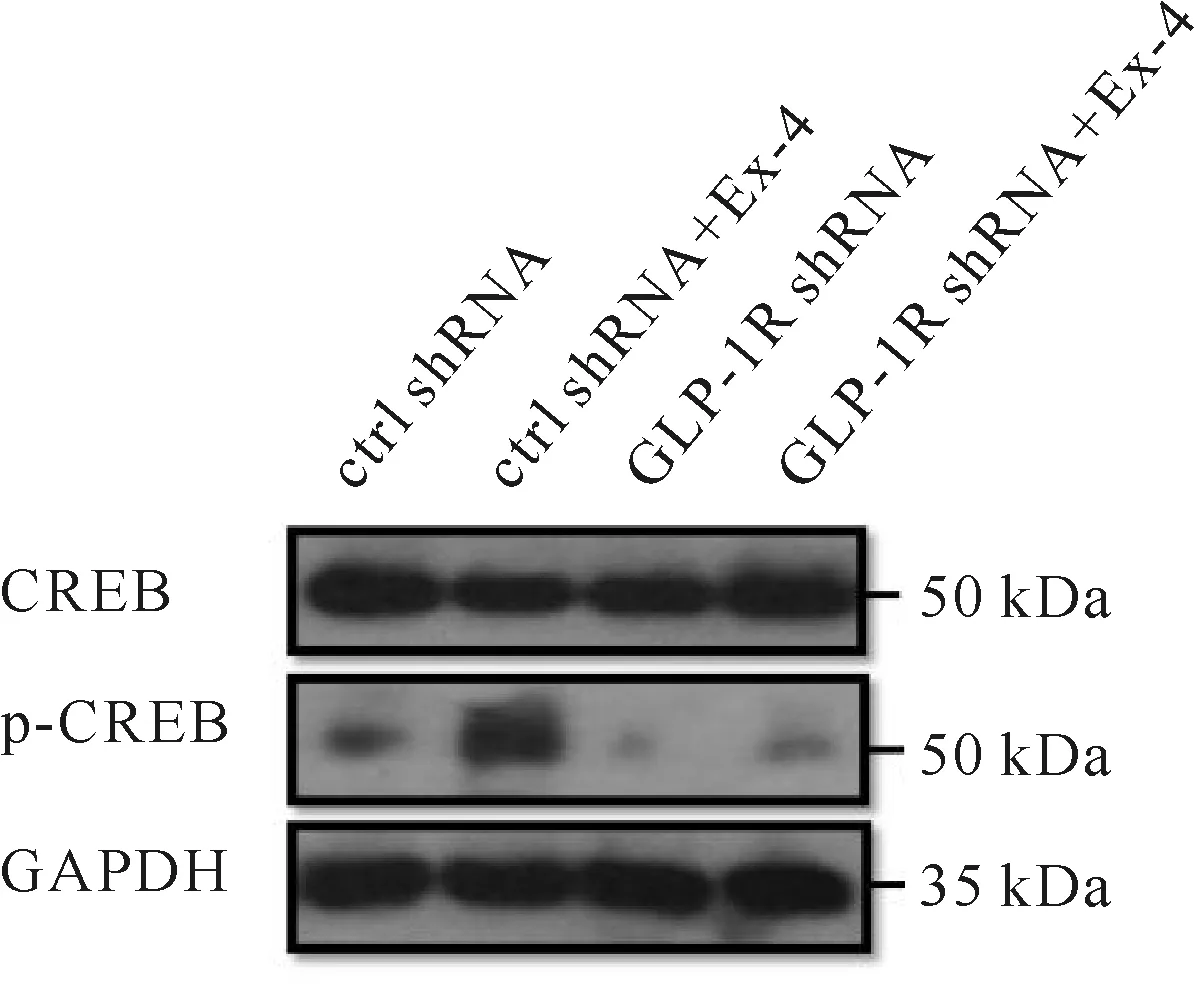
Fig.12Effects of Ex-4 on CREB activation after knockdown of GLP-1R. NSCs were treated with 100 nmol/L Ex-4 for 20 minutes and Western blot was used to detect CREB activation. Representative Western blot were from three independent experiments
2.5 Ex-4通过PI3K途径活化CREB发挥促其分化作用
有研究指出在人体的其他组织中,GLP-1R的活化通过PI3K和MAPK两种途径分别起不同的作用[8],目前尚不清楚Ex-4如何活化NSCs中的CREB。本研究用U0126和LY294002分别阻断了MAPK和PI3K途径进一步研究了NSCs中CREB的活化状态。数据表明,U0126的处理未对Ex-4介导的CREB活化产生影响(图13,表3),LY294002可以消除Ex-4对NSCs中CREB的活化作用(图14,表3),表明Ex-4可能通过PI3K途径活化CREB以达到促进神经元分化的作用。
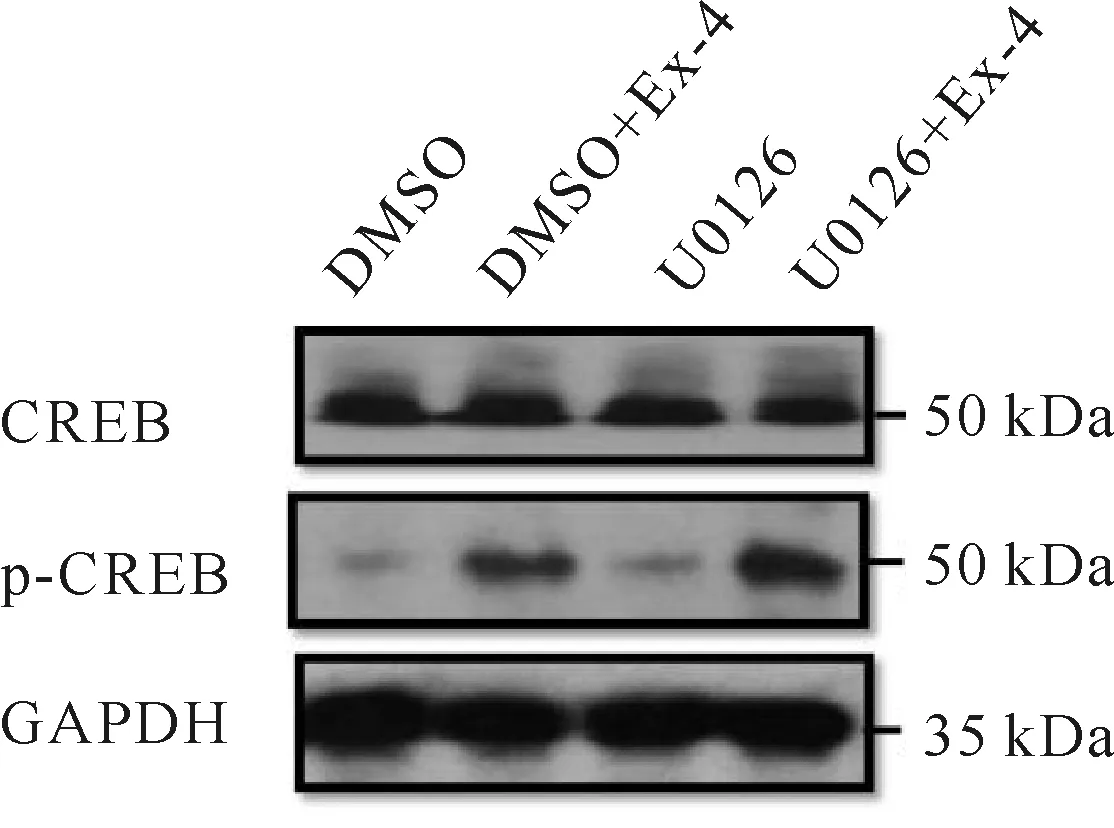
Fig.13Activation of CREB after treated with U0126, NSCs were preincubated with 0.07 μmol/L U1026 for 30 min and then stimulated with 100 nmol/L Ex-4 for 20 minutes, p-CREB in each group was subsequently examined by western blot

Fig.14Activation of CREB after treated with LY294002, NSCs were preincubated with 50 μmol/L LY294002 for 2 h and then stimulated with 100 nmol/L Ex-4 for 20 minutes, p-CREB in each group was subsequently examined by western blot


Groupβ-tubulin III-positive cells (%)Activation of CREB (%)ctrl shRNA10.010±2.366100.167±7.985ctrl shRNA+Ex-422.333±2.875**445.833±19.793##GLP-1R shRNA10.963±2.71498.333±9.395GLP-1R shRNA+Ex-411.890±2.449100.833±10.187
**P<0.01vsU0126 group;##P<0.01vsDMSO+Ex-4 group
3 讨论
促进脑SVZ的NSCs向神经元分化是脑损伤,阿尔茨海默病等疾病治疗的关键[9]。体外试验证明Ex-4可促进成年C57BL/6J小鼠脑SVZ的NSCs向神经元分化。分子生物学分析显示Ex-4通过GLP-1R/PI3K/CREB途径起作用。这表明GLP-1R激动剂在治疗中枢神经系统损伤以及神经退行性疾病中具有独特的作用。
Ex-4已被证明可以增强胚胎干细胞产生胰岛素的细胞分化[10],然而,几乎没有证据表明Ex-4在CNS中具有再生活性。本研究证明了Ex-4具有调节成熟小鼠脑SVZ中NSCs活性的潜力。研究发现Ex-4的受体GLP-1R在成年小鼠脑SVZ中NSCs中的表达,且Ex-4的处理导致表达神经元标记β-tublin III的细胞百分比增加。表明Ex-4可以促进NSCs向神经元谱系分化。
有研究在多种模拟神经元的细胞模型中证明了GLP-1R激动剂的神经保护作用,例如过表达GLP-1R的人神经母细胞瘤细胞系能够免受氧化应激诱导的细胞死亡[11]。 GLP-1减少谷氨酸诱导的大鼠海马神经元死亡并保护PC12细胞免受甲基乙二醛诱导的氧化应激损伤等[12]。本研究发现在体外培养NSCs的分化过程中,正常分化为神经元的细胞极少,其中大部分为神经胶质细胞。Ex-4的处理可以显著提高NSCs分化为神经元的比例。本研究观察到在NSCs以及分化的早期GLP-1R的表达,在分化第14日,仅在神经元细胞中观察到GLP-1R表达,神经胶质细胞中似乎不存在GLP-1R的表达。有研究指出Ex-4可以通过GLP-1R活化细胞内的CREB来保护神经元的存活。本研究也观察到Ex-4对神经元中CREB的活化作用,而对神经胶质细胞中的CREB活性没有影响。这一发现似乎能够解释Ex-4的促神经分化作用:在分化的早期产生的神经元细胞较多,随着时间的延长神经元逐渐被增殖的胶质细胞所取代,Ex-4通过GLP-1R活化神经元中的CREB从而发挥神经保护作用,因此在分化的第14日仍能观察到较多的神经元细胞存活。
已有研究报道指出在外周神经组织中CREB的活化可以产生神经保护作用[13],但目前尚不清楚在NSCs中Ex-4是通过何种途径使CREB活化。研究表明,PI3K信号通路的阻断使Ex-4的活化作用失效,但是阻断MAPK途径未使Ex-4的作用消失,表明Ex-4可以通过PI3K-CREB途径促进神经元的分化,维持其神经表型。
总之,本研究证实了GLP-1R在成熟小鼠脑的SVZ中的表达,发现Ex-4可以显著促进NSCs分化成神经元表型。分子生物学研究显示Ex-4通过GLP-1R/PI3K/CREB途径起作用。这意味着GLP-1R激动剂对中枢神经系统损伤以及神经退行性疾病具有独特的治疗作用。
致谢:衷心感谢武警特色医学中心脑科研究所提供的细胞培养设备,Western blot电泳和显影仪器、倒置显微镜以及荧光显微镜,感谢武警特色医学中心全体师生的支持和帮助。

