珊瑚砂微生物固化条件优化的正交试验研究
陈 适,方祥位,申春妮,宋 平,4
(1.陆军勤务学院 军事设施系, 重庆 401311; 2.重庆大学 土木工程学院, 重庆 400045;3.重庆科技学院 建筑工程学院, 重庆 401331;4.中国人民武装警察部队武汉特勤疗养中心, 湖北 武汉 430072)
岩土微生物固化技术的原理为,利用微生物自身生命活动特点,在提供金属离子和氮源的条件下生成碳酸盐胶结物质,这些胶结物质可以胶结砂土颗粒,使砂土固化为整体[1-3]。这一技术具有操作简单,反应过程稳定可控的优点,且生成物粘结性强,砂土固化后的强度较高,因此应用前景良好[4-6]。
珊瑚砂微生物固化技术的影响因素众多,影响机理复杂。欧益希等[7-8]研究了溶液盐度和颗粒粒径对珊瑚砂微生物固化的影响,阐明了珊瑚砂微生物固化技术可以在海洋环境中使用,且中砂的固化效果最好。李捷等[9-11]研究了颗粒级配和脲酶活性对珊瑚砂微生物固化体力学性能的影响,得到了单因素的最佳取值。宋平等[12]研究了纤维掺量对珊瑚砂微生物固化体力学性能的影响。从目前的研究成果来看,珊瑚砂微生物固化技术的研究以单因素试验为主,对于固化技术中重要因素的筛选和试验条件的优化还鲜有报道。本试验采用正交试验的方法,选取颗粒粒径、脲酶活性、溶液配比和溶液浓度四个主要影响因素,对珊瑚砂微生物固化条件进行优化研究,得到最优固化条件,为实际应用提供参考。
1 试验方案
1.1 试验材料
1.1.1 珊瑚砂
试验用珊瑚砂为我国南海某岛礁陆域吹填珊瑚砂,主要成分为碳酸钙,颗粒具有多孔隙、形状不规则、易破碎等特征。
1.1.2 巴斯德芽孢杆菌
试验采用巴斯德芽孢杆菌。将菌种活化处理后接种到100 mL液体培养基中,置于震荡培养箱培养48 h,培养结束后进一步扩大培养得到初始脲酶活性在2.0 mmol/(L·min)以上的菌液。
1.1.3 底物溶液试剂
试验所用底物溶液由纯度为AR级的尿素和氯化钙经去离子水溶解后混合而成,其溶液浓度和两种试剂的配比由具体试验需要确定。
1.2 试验装置
试验所用模具为内径×高度=50 mm×300 mm的对开有机玻璃管,将模具组装好后放置于试验架台上,并在模具下端的橡胶塞中插入硅胶硬管,硅胶硬管与变径接头和软管相连,且软管底部接有蠕动泵,可以调节溶液在模具中的流动速度。
1.3 试验方案
1.3.1 固化试验方案
在模具中装入珊瑚砂350 g后开始固化试验。首先取100 mL菌液倒入试样中,待菌液从低端软管口流尽后,将流出的菌液再重复通入三次,使菌液充分吸附到砂颗粒表面;再通入200 mL底物溶液,在底物溶液流出的过程中,利用蠕动泵控制溶液流速为3 mL/min左右,并将流出的底物溶液反复流通2次~4次,确保固化反应充分进行,完成一次固化。更换溶液并重复上述操作5次左右后,试样渗透性降低至接近0,此时固化试验结束。
1.3.2 力学试验方案
固化试验结束后,拆除模具,并将固化体在95℃的条件下持续烘干36 h。将烘干后的固化体切割并磨平为力学试验标准试验尺寸(直径×高度=50 mm×100 mm)。
无侧限抗压强度试验采用重庆交通大学河海学院实验室的RMT-150C岩石力学伺服试验机。试验采用位移控制式加载,加载速度为0.005 mm/s。
1.4 正交试验方案
本试验选取颗粒粒径、脲酶活性、底物溶液浓度和配比四个主要影响因素,每个因素取三个水平,采用三水平四因素正交试验表进行试验设计。
1.4.1 颗粒粒径
将珊瑚砂的颗粒分成不同粒组并进行人工组合,新的粒径组合为颗粒粒径的三个水平(用大写字母A、B、C表示),如表1所示,颗粒级配曲线如图1所示。
由图1可求得各粒径组合的粒径参数[13],如表2所示。粒径组合A为不良级配,粒径组合B、C为良好级配,且由A组至C组,颗粒粒径逐渐变粗。


图1 级配曲线
1.4.2 脲酶活性
在扩大培养所得的菌液中加入适量生理盐水可以调节菌液脲酶活性。在脲酶活性的单因素试验中,固化效果最好的脲酶活性为1.5 mmol/(L·min)[16]。本文取脲酶活性为1.0 mmol/(L·min)、1.5 mmol/(L·min)和2.0 mmol/(L·min)的菌液作为脲酶活性的三个水平(分别用小写字母a、b、c表示)。
1.4.3 底物溶液配比
在底物溶液配比的单因素试验中,当溶液配比为1∶1时,固化效果最好[15]。本文设计三种尿素与CaCl2配比(0.75∶1、1∶1和1.25∶1)作为底物溶液配比的三个水平(分别用1、2、3表示)。
1.4.4 底物溶液浓度
底物溶液浓度可以直接影响每次固化产生胶结物质的量,进而影响固化体的固化效果,所以不同浓度的底物溶液对珊瑚砂微生物固化效果具有较大影响。设置三种浓度作为底物溶液浓度的三个水平(分别用Ⅰ、Ⅱ、Ⅲ表示),具体浓度如表3所示。

表3 溶液浓度
1.4.5 正交试验方案
将上述影响因素及水平汇总,具体的试验固化条件如表4所示。

表4 固化条件
2 结果分析与讨论
本文正交试验以无侧限抗压强度和干密度作为考察指标。处理试验数据时,首先利用极差分析法和方差分析法对单个指标进行分析,讨论各因素对试验指标影响的主次顺序,再综合分析各因素和水平对试验指标的影响,得出最优试验条件[14,16-17]。
2.1 表观特征
图2为部分固化好的微生物珊瑚砂柱。由图2可见,在不同试验条件下,珊瑚砂均可以通过微生物固化反应形成整体。不同组的固化体在表面光滑程度上有差别,这是因为个别组的固化条件较差,导致珊瑚砂固化效果较差,固化体表面较为粗糙。

图2部分固化好的砂柱
2.2 固化体的无侧限抗压强度分析
2.2.1 直观分析
表5为抗压强度结果直观分析表。其中K值为各影响因素在不同水平条件下的平均抗压强度,从中可以得到每个因素的最佳水平;R值为各影响因素在不同水平下抗压强度平均值的极差,该值越大,所对应的因素对试验结果的影响越大。
由表5可知,各因素对固化体抗压强度影响的主次顺序为:颗粒粒径、脲酶活性、底物溶液配比、底物溶液浓度。由于抗压强度值越大表明固化效果越好,则选取最优水平时,以K值最大为原则。所以在抗压强度为指标的情况下,各因素与水平最优组合为:颗粒粒径取C组,脲酶活性取2.0 mmol/(L·min),底物溶液配比取0.75∶1,底物溶液浓度取1 mol/L。
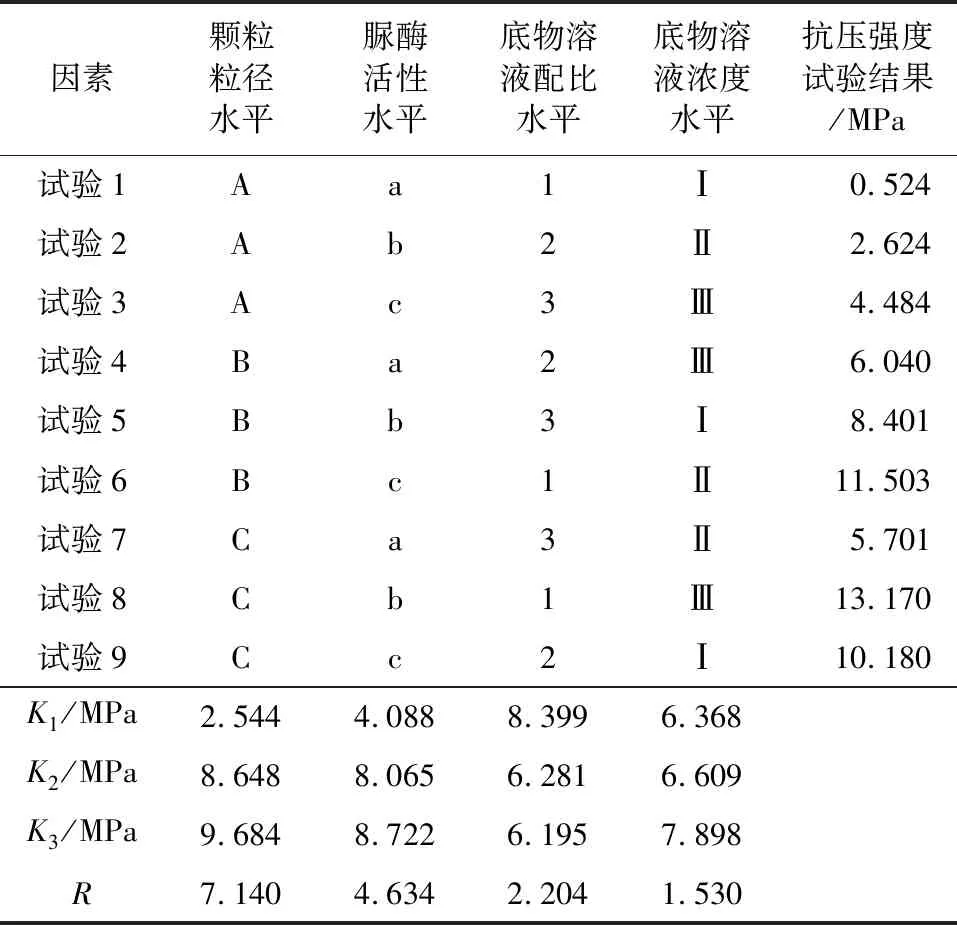
表5 抗压强度结果直观分析
由表5中颗粒粒径K值可以看出,固化体抗压强度随颗粒粒径增大而增加。原因可能为珊瑚砂颗粒越细,内部孔隙越少,固化体越容易因局部孔隙被填堵而使试验提前结束,此时固化不完全,固化体强度较低。而较大的颗粒粒径可以避免这一问题。但是当颗粒粒径过大时,胶结物质无法有效连结砂颗粒,可能导致固化体抗压强度降低,所以固化体抗压强度不会随颗粒粒径的增大而继续增大。
由表5中脲酶活性K值可以看出,固化体抗压强度随着脲酶活性的增高而增大。当脲酶活性较低时,固化效率低,反应的生成物较少,颗粒连结效果较差,固化体抗压强度较低。当脲酶活性较高时,可以有效解决这一问题,固化效果较好,固化体抗压强度更高(见图3(a))。但是当脲酶活性过高时,每次固化反应速率过快,胶结物质生成量过多,造成局部孔隙堵塞,导致固化反应提前结束,此时固化体强度降低,因此固化体抗压强度不会随脲酶活性的增大而持续增大(见图3(b))。
由表5中底物溶液配比K值可以看出,固化体抗压强度随溶液配比的增大而减小。在固化反应中,尿素与CaCl2消耗比例为1∶1。当底物溶液配比增大时,底物溶液中Ca2+的含量降低,这会导致生成的CaCO3减少,使固化体抗压强度降低(见图3(c))。当底物溶液配比较小时,Ca2+含量较高,CaCO3生成量较多,固化效果更好,固化体抗压强度较高。但是当溶液配比过小时,Ca2+含量过高,每次试验产生的CaCO3过多,容易导致固化体局部孔隙堵塞,进而影响固化效果,导致抗压强度降低(见图3(d)),因此固化体抗压强度并不会随底物溶液配比的减小而一直增高。

图3不同MICP胶结珊瑚沙的SEM试验结果
由表5中底物溶液浓度K值可以看出,在本文选取浓度范围内,固化体抗压强度随着底物溶液浓度的减小而增加。当底物溶液浓度较高时,每次固化反应中胶结物质生成量更多,容易导致局部区域的孔隙被填堵而使固化体固化效果变差,固化体强度降低(见图3(e))。而底物溶液浓度较低时可以避免这一问题。但是,当底物溶液过低时,反应可以产生的胶结物质较少,无法满足固化需求,从而导致固化体强度降低,因此固化体抗压强度不会随底物溶液浓度的降低而持续增加(见图3(f))。
2.2.2 方差分析
采用正交试验方差分析法处理试验数据,显著性水平取0.10、0.05和0.01,由于底物溶液浓度的离差最小,所以将其作为误差进行分析处理,方差计算结果如表6所示。
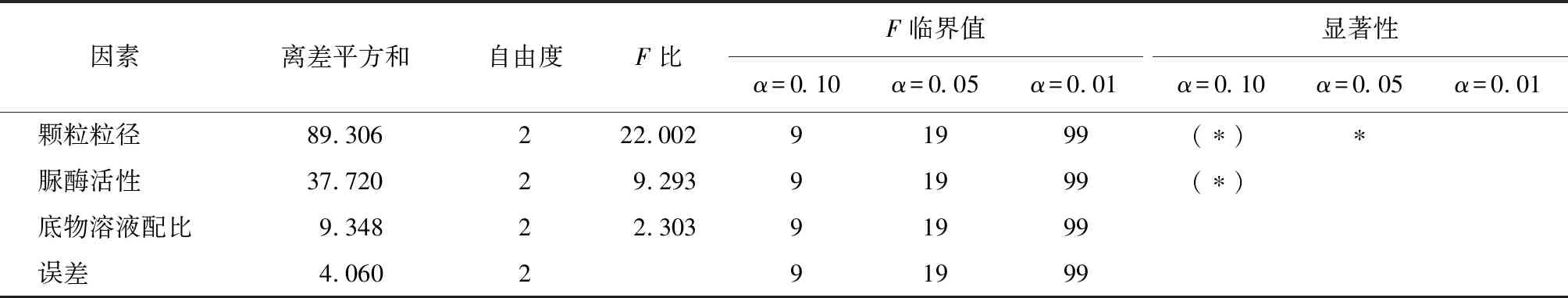
表6 抗压强度结果方差分析
由表6可知,对于珊瑚砂微生物固化体的抗压强度来说,颗粒粒径的F比最大,达到了显著水平,其次为脲酶活性,达到了较为显著水平,溶液配比的影响虽然不显著,但是其离差平方和比误差大,说明试验是合理的。
2.3 固化体的干密度增量分析
2.3.1 直观分析
表7为干密度增量结果直观分析表。表中K和R的含义与2.2节中一致。由表7可知,各因素对固化体干密度增量影响的主次顺序为:脲酶活性、颗粒粒径、底物溶液配比、底物溶液浓度。由于干密度增量值越大表明固化效果越好,则选取最优水平时,以K值最大为原则,各因素与水平最优组合为:颗粒粒径取C组,脲酶活性取1.5 mmol/(L·min),底物溶液配比取0.75∶1,底物溶液浓度取1 mol/L。

表7 干密度增量结果直观分析
由表7中颗粒粒径K值可以看出,固化体干密度增量随颗粒粒径增大而增大,与固化体强度变化规律一致。
由表7中脲酶活性K值可以看出,固化体干密度增量随脲酶活性增高先增加后降低。当脲酶活性较低时,固化反应无法充分将Ca2+转化为沉淀,反应生成的胶结物质较少,固化体干密度增量较小;当脲酶活性过高时,部分Ca2+被快速消耗,生成的CaCO3随液体排出流失,有效胶结沉淀的生成效率低,干密度增量相对较小。
由表7中底物溶液配比K值可以看出,固化体干密度增量随尿素与CaCl2比值增大先降低后增加。当尿素与CaCl2比值较小时,底物溶液中尿素含量较低,微生物通过生命活动生成的CO32-较少,但是Ca2+含量较高,过量的Ca2+可以保证CO32-充分沉淀,使得每次固化反应生成的胶结沉淀较多,固化体干密度增量较大;当尿素与CaCl2比值较大时,底物溶液中Ca2+含量较低,但是尿素含量较高,细菌生命活动旺盛,生成的CO32-较多,过量的CO32-可以保证Ca2+充分沉淀,所以固化体干密度增量较大。当尿素与CaCl2比值接近1时,沉淀不能充分产生,导致固化体干密度增量较小。
由表7中底物溶液浓度K值可以看出,固化体干密度增量随着底物溶液浓度的减小而增加,与固化体强度变化规律一致。
2.3.2 方差分析
利用正交试验方差分析法处理试验数据,显著性水平取0.10、0.05和0.01,因为底物溶液浓度的离差最小,所以将其作为误差进行分析处理,方差计算结果如表8所示。
由表8可知,对于珊瑚砂微生物固化体的干密度增量来说,脲酶活性的F比最大,达到了显著水平,其次为颗粒粒径,达到了较为显著水平,底物溶液配比的影响虽然不显著,但是其离差平方和比误差大,说明试验是合理的。
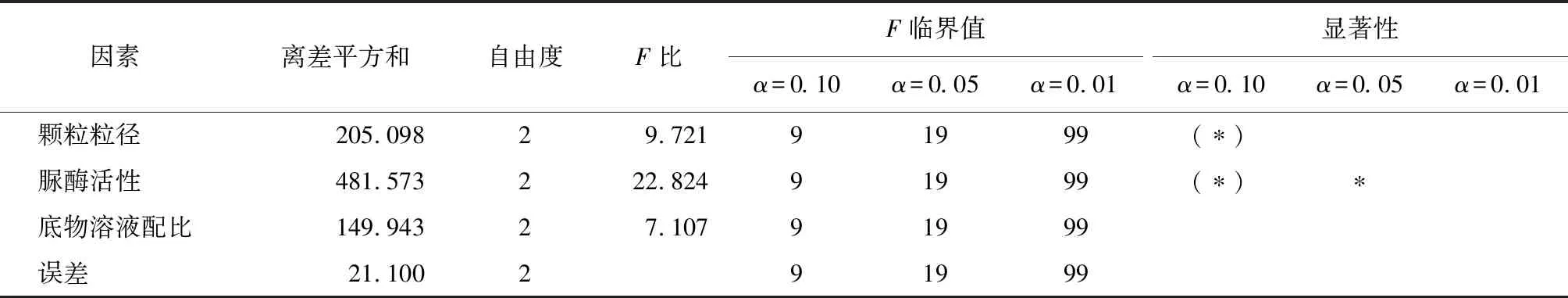
表8 干密度增量结果方差分析
2.4 固化效果的综合分析
结合固化体抗压强度和干密度增量综合分析可以得出珊瑚砂微生物固化的最优固化条件,抗压强度和干密度增量综合分析图如图4所示。
由图4(a)可知,固化体的抗压强度和干密度增量均随砂中颗粒粒径的增粗而增大,则最优水平取曲线最高点,即颗粒粒径为C组。
由图4(b)可知,固化体的抗压强度随菌液脲酶活性的增大而增大,干密度增量随菌液脲酶活性的增大先增大后减小,则最优水平取曲线交点,曲线交点有两个,取其中对应较大值的点,即脲酶活性为1.85 mmol/(L·min)左右。
由图4(c)可知,固化体的抗压强度随底物溶液配比的增大而减小,干密度增量随底物溶液配比的增大先减小后增大,则最优水平取使两个指标同时达到最高值的点,即底物溶液配比为C(urea):C(CaCl2)=0.75∶1。
由图4(d)可知,固化体的抗压强度和干密度增量均随底物溶液浓度的减小而增大,则最优水平取曲线的最高点,即底物溶液浓度为1 mol/L。

图4抗压强度和干密度增量综合分析图
3 结 论
(1) 珊瑚砂微生物固化试验中各因素对固化体抗压强度影响的主次顺序为:颗粒粒径、脲酶活性、底物溶液配比、底物溶液浓度,其对应值为颗粒粒径取C组(粗粒组),脲酶活性取2.0 mmol/(L·min),底物溶液配比取0.75∶1,底物溶液浓度取1 mol/L。
(2) 珊瑚砂微生物固化试验中各因素对固化体干密度增量影响的主次顺序为:脲酶活性、颗粒粒径、底物溶液配比、底物溶液浓度,其对应值为颗粒粒径取C组(粗粒组),脲酶活性取1.5 mmol/(L·min),底物溶液配比取0.75∶1,底物溶液浓度取1 mol/L。
(3) 珊瑚砂微生物固化试验最优固化条件为颗粒粒径取C组(级配良好的较粗粒组),脲酶活性取1.85 mmol/(L·min),底物溶液配比取0.75∶1,底物溶液浓度取1 mol/L。

