前纵隔弥漫性大B淋巴瘤与侵袭性胸腺瘤的鉴别诊断*
杨新蕊 姜 玲 程玉卉 朱建忠
1. 山东第一医科大学(山东省医科院),山东 泰安 271016; 2. 泰山医学院附属医院影像科,山东 泰安 271000
发生于成人的纵隔肿瘤,胸腺瘤占一半左右[1],好发于前纵隔,组织学上由胸腺上皮细胞与反应性淋巴细胞组成。胸腺瘤可以分为6个亚型[2],其中A型、AB型和B1型为良性胸腺瘤,而B2型、B3型和C型(胸腺癌)为恶性胸腺瘤,即为侵袭性胸腺瘤[3-4]。淋巴瘤是一种发生于血液系统的恶性疾病,起源于淋巴结或者其他器官中的淋巴组织,分为霍奇金淋巴瘤、非霍奇金淋巴瘤两大类。纵隔淋巴瘤以非霍奇金淋巴瘤常见,可作为全身淋巴瘤的一部分出现,也可原发于纵隔,在纵隔肿瘤中约占20%[1],以中纵隔好发,前纵隔少见。
1 资料与方法
1.1 临床资料
病例1,男,26岁。前胸部疼痛10余天,胸部CT发现前纵隔占位7天入院,术后病理证实为胸腺弥漫性大B细胞淋巴瘤。病例2,女,40岁。2月前发现左侧胸壁肿物,无明显压痛,在外未行特殊处理,门诊以“胸壁肿物”收入院,胸壁肿物穿刺病理结果证实为弥漫性大B细胞淋巴瘤。
1.2 检查方法
采用飞利浦256层ICT扫描系统行胸部CT平扫+增强扫描。检查前患者禁食8h,扫描前口服水500~1000 ml。取仰卧位,用高压注射器经肘正中静脉团注碘佛醇,注入量为80~100ml(按每公斤体重1.0~1.5ml计算),注射速度为2.5 ml/s~3 ml/s,行动脉期(25 s~30 s)、静脉期(55 s~60 s)扫描。扫描参数为:螺距1.0,层厚5 mm,矩阵512×512,管电压120 Kv,管电流300 mA,扫描层间距为5 mm。将原始图像(层厚0.65 mm)和重建图像传至工作站,行冠状位和矢状位多平面重组(MPR)后处理,软组织窗及肺窗观察。
1.3 图像分析
由放射科两位高年资医生对图像进行盲法审阅,评价内容主要包括肿瘤生长部位、形态与边缘、密度、强化方式、同邻近心脏大血管的关系以及有无邻近结构侵犯。
2 结 果
病例1 胸部CT平扫 (图1a)、胸部增强扫描(图1b.c):前中上纵隔偏右侧可见一类圆形软组织密度肿块影,边缘呈分叶状改变,内部密度欠均匀,可见多发不规则低密度区,病灶最大层面测量约110 mm×72 mm,边界尚清晰,实性成分双期增强扫描后呈不均匀性中度强化,低密度区未见强化,邻近心包、主动脉及上腔静脉呈受压推移改变,病灶与上腔静脉间脂肪间隙显示不清。主动脉旁见淋巴结,长径约10 mm。体格检查:未触及浅表淋巴结肿大。血乳酸脱氢酶(LDH)183U /L(参考值120~250 U/ml),肿瘤标志物CA-125 40 U/ml(正常值0~35 U/ml),术前诊断为侵袭性胸腺瘤。根据CT扫描结果和纵隔肿瘤治疗原则,行纵隔肿瘤、胸腺扩大切除术,术中可见肿块位于前上纵隔,局部浸润邻近右肺上叶肺动脉、上腔静脉、左侧无名静脉及心包,行纵隔肿瘤联合右肺上叶完整切除,清扫纵隔淋巴结,术后患者恢复良好。病理于1周后返回 (图1d.e),提示为胸腺弥漫性大B细胞淋巴瘤,生发中心来源型。免疫表型: CD20 (+)、CD10(+)、CD3 (T细胞+)、CD56(-)、CD99(-)、Ki-67(约80%+)、BCL-6(+)、Mum-1(+)、Syn(-)、CK(-)、HMB-45(-)。后送天津市血研所,FISH结果显示CEP9/CDKN2A基因阳性、BCL-2、BCL-6基因及MYC基因重排阴性,考虑为IIIESB组(Ann Arbor分期)。术后结合病理结果给予R-EPOCH方案化疗。
病例2 胸部CT平扫(图2a)、胸部增强扫描(图2b.c):心脏左前方可见一软组织肿块影,边缘清、可见分叶,沿肋间隙向前突至胸大肌后方,与胸大肌分界欠清,病灶密度欠均匀,增强扫描可见整体呈中等程度强化,内部低密度区轻度强化,动脉期见小血管影穿行,周围可见多发淋巴结,前上纵隔见多发结节状软组织密度影,病灶与肺交界面尚清晰,邻近肺野可见条索状高密度影。体格检查中未触及浅表淋巴结肿大,双肺听诊呼吸音粗,心尖部可闻及病理杂音。血清乳酸脱氢酶(LDH)443U /L。胸壁肿物穿刺结果:送检组织内见小圆细胞弥漫增生,可见细胞异型、核分裂像,免疫组化(图2d.e): CD20 (+)、CD23 (+)、CD3 (-)、CD10(-)、CD5(-)、BCL-2(+)、BCL-6(局部+)、Ki-67(约60%+)、CyclinD1(-)、Mum-1(+)、CK(-)、Vim(-)、CD38(-),结合免疫组化诊断弥漫性大B细胞淋巴瘤(I期A组),非生发中心来源。评估无化疗禁忌后予以R-CHOP方案化疗。
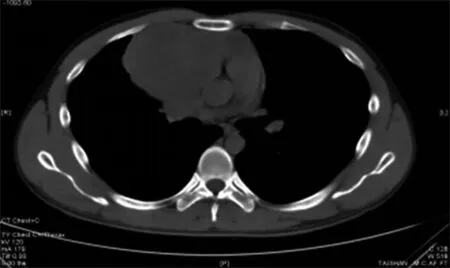
图1a CT平扫
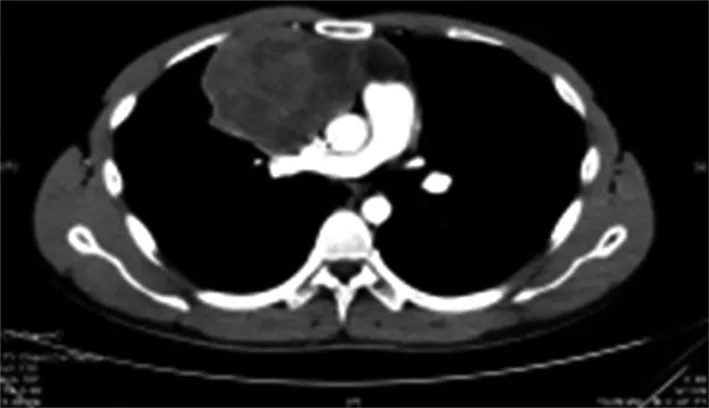
图1b CT增强扫描动脉期
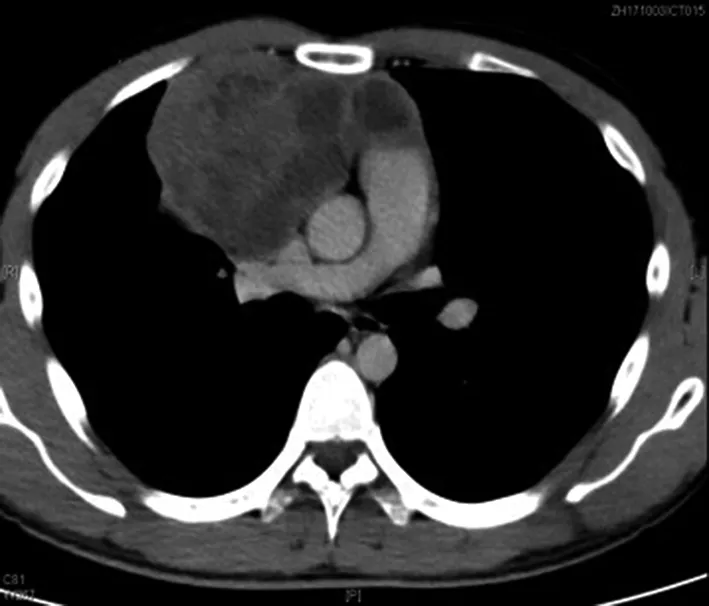
图1c CT增强扫描静脉期
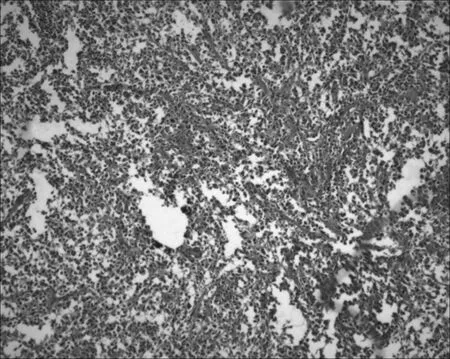
图1d
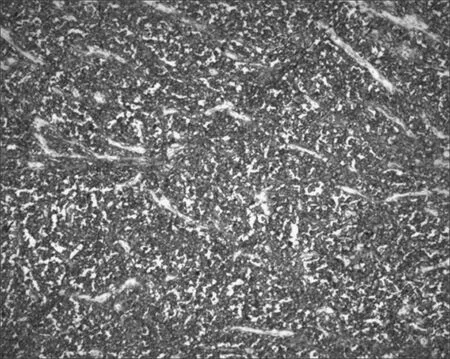
图1e
图1 男,26岁。胸部CT平扫(a)、胸部CT增强(b.c)表现为前中上纵隔偏右侧类圆形软组织肿块,边界尚清,内部密度欠均匀,可见多发不规则低密度区,增强扫描后实性成分呈不均匀性中度强化,低密度区未见强化,邻近心包、主动脉及上腔静脉受压移位,病灶与上腔静脉间脂肪间隙显示不清。病理结果(d、e)显示为弥漫性大B细胞淋巴瘤。
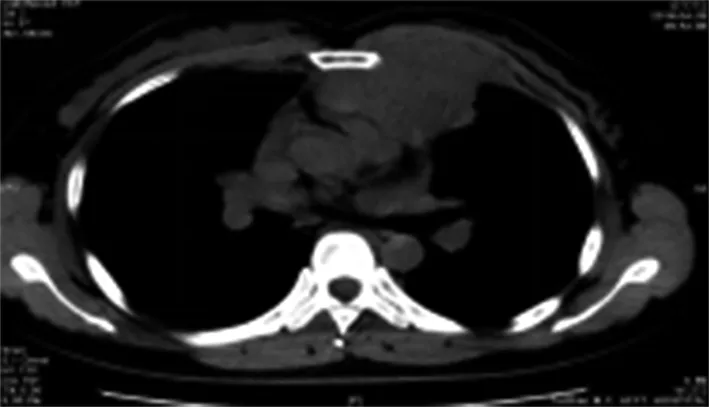
图2a CT平扫
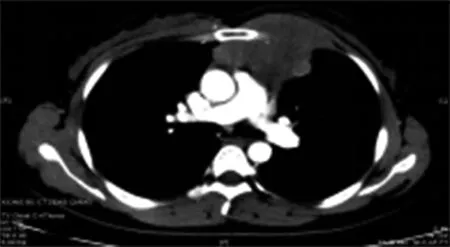
图2b CT增强扫描动脉期
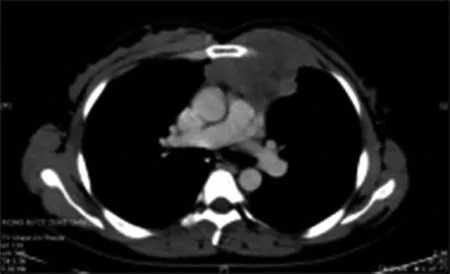
图2c CT增强扫描静脉期
图2d
图2e
图2 女,40岁。胸部CT平扫(a)、胸部CT增强(b.c)表现为心脏左前方一软组织肿块影,边缘可见分叶,内部密度欠均匀,病灶沿肋间隙向前突至胸大肌后方,与胸大肌分界欠清,增强扫描可见整体呈中等强化,内部低密度区轻度强化,病灶与肺交界面尚清。病理结果(d、e)显示为弥漫性大B细胞淋巴瘤。
3 讨 论
侵袭性胸腺瘤和前纵隔淋巴瘤均是前纵隔常见肿瘤,加之二者的影像学特征和生物学特性颇有相似之处,因而容易误诊。然而两者在临床治疗上有极大的差异,因此如何正确鉴别诊断具有重要的临床指导意义,笔者通过病例CT表现,并查阅相关文献,就其鉴别点进行如下分析,以增进认识,防止误诊误治。
3.1临床特点
胸腺瘤患者发病年龄>40岁多见,常合并各种不同类型的副肿瘤综合征,其中有35%~40%合并重症肌无力[5];而淋巴瘤以40岁以下者居多[6],特征性表现为全身多发浅表淋巴结肿大伴低热,常出现颈部淋巴结肿大,因此对于前纵隔肿块若怀疑淋巴瘤,体格检查时应特别注意其它部位淋巴结情况,进展期实验室检查淋巴细胞比值降低[7],70%的患者还可出现乳酸脱氢酶(LDH)的升高[8]。此两例患者查体时均未触及浅表淋巴结肿大,诊断淋巴瘤临床证据不足,病例2患者入院时血乳酸脱氢酶水平明显高于正常值上限,在第一个疗程化疗结束后复查降至正常参考范围。
3.2 影像学特征
侵袭性胸腺瘤多表现为前纵隔内偏向一侧生长的分叶状或不规则软组织肿块,边缘可见结节状或棘状突起[9],与周围心脏大血管分界不清,常沿血管间隙浸润,呈灌铸型接触[10],密度不均,内部常见大而不规则的低密度灶,对应于病理上瘤组织内部的陈旧性出血、坏死或囊变[11],同时还可见到多发斑点样无定形钙化[12],增强扫描时坏死囊变区强化不明显,实性部分呈中度-显著强化,CT值增强幅度多>30HU[13]。周围结构受侵时表现各异,累及纵隔胸膜使其呈结节状增厚[14]并出现胸腔积液,若突破胸膜侵犯肺组织,则出现瘤-肺界面的片状影或毛刺影[10],侵犯心包可造成心包结节状增厚和心包积液,侵犯心膈角时可见到心膈角区的软组织肿块影,还可出现腹腔内淋巴结的增大、粘连或融合[10],胸骨和肋骨的直接受侵、转移。前纵隔淋巴瘤常跨越中线向两侧对称性生长,相对而言边缘比较光整,少见分叶状改变,薄层扫描常可见到周围伴发多个大小不一的淋巴结,呈融合或孤立存在,肿块与血管分界显示清楚,心脏、大血管整体均匀一致地向后方推压移位,肿块围绕血管生长使血管被包埋犹如血管“插入”肿块内呈莲蓬状[15],最常受侵的是上腔静脉和左侧头臂静脉[16],病灶密度通常比较均匀,治疗前钙化少见[17],增强扫描呈轻-中度强化,CT值增强幅度多<30HU[18]。淋巴瘤也常并发胸腔积液或心包积液,有文献报道称原发性前纵隔大B 细胞性淋巴瘤胸腔积液、心包积液发生率分别为 25%~45%、15%~25%[19]。
此两例患者病灶主体均偏向一侧,边缘可见分叶状改变,内部均可见到不规则的低密度区,尤其病例1中低密度区多发且呈大片状,这些征象都是造成误诊的原因。但仔细分析,病灶整体边界尚清,周围可见到多个大小不等的淋巴结影,病例1病灶与上腔静脉间及病例2病灶与肺动脉根部间脂肪间隙模糊,但其余层面观察病灶与血管分界显示尚可并可见到大血管受压向后方移位,增强扫描后实性部分呈中度强化,CT值增强幅度均<30 HU,所以一定程度上还是支持淋巴瘤的诊断。另外淋巴瘤虽然可形成较大的软组织肿块但较少出现骨质受侵,如病例2病变虽然沿肋间隙向前突出至胸大肌后方,但并未侵犯相应肋骨骨质,也反映了肿块质地较软,因此高度提示淋巴瘤。
综上所述,前纵隔淋巴瘤和侵袭性胸腺瘤各自具有一定的影像学特征,以往普遍认为治疗前的淋巴瘤较少发生液化、坏死[20],现在看来密度均匀对于淋巴瘤的诊断并不可靠,尤其弥漫性大B细胞型相对于其他病理类型的淋巴瘤来说容易发生出血、囊变、坏死[5],较为可靠的征象如下:病变治疗前少见钙化,边缘通常比较规整,但也可出现分叶状改变,周围脂肪间隙整体较为清晰,常伴发多个淋巴结,增强扫描实性成分强化幅度<30 HU,包埋推移心脏大血管,少见胸膜心包结节。因此以后诊断时必须抓住病灶的可靠征象、全面整体分析,并密切结合临床才能够提高影像诊断和病理诊断的符合率,当然还希望在日后工作中对于此类误诊病例能够多做总结,这样才能逐步提高认识。

