青蛤多肽的酶法制备及对前列腺癌DU-145细胞的抑制活性
张亚茹,闫海强,杨最素,余方苗,丁国芳,3,龚戬芳,*
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022;2.浙江海洋大学东海科学技术学院,浙江 舟山 316004;3.浙江省海洋水产研究所,浙江 舟山 316022)
前列腺癌发病率在男性恶性肿瘤发病率中位居首位,易发于老年男性。在世界范围内,前列腺癌的发病率因环境、基因、饮食等因素不同而有很大差异[1-3]。在我国,前列腺癌发病率呈逐年上升趋势,居泌尿系统肿瘤发病率的首位,严重威胁老年男性的健康[4-5]。传统治疗方法如手术、放疗和冷冻治疗等效果并不理想,复发率较高,并且当复发的前列腺癌转化为非雄激素依赖性时将更难治疗;而化疗药物产生耐药性后疗效更差且毒副作用明显。因此,寻找抗前列腺癌药物成为学者们研究的热点。海洋是发现新型抗癌药物的丰富的资源宝库,其中,海洋多肽类物质因其分子质量小、活性高、毒性低等优点日益成为国内外学者研究的焦点。从双壳贝类中提取的文蛤多肽Mere15、菲律宾蛤仔寡肽对人慢性骨髓性白血病K562细胞、前列腺癌细胞具有增殖抑制作用,并能够浓度依赖性地诱导细胞凋亡[6-7]。
青蛤(Cyclina sinensis)属于软体动物门鳃瓣纲异齿亚纲帘蛤目帘蛤科,含有高含量的蛋白和不饱和脂肪酸,味道鲜美,具有很高的营养价值[8-10]。青蛤在民间具有悠久的入药历史,是一种重要的海洋药物,具有软坚散结、清热燥湿及镇咳的作用[11-13]。目前,已证实青蛤中富含的蛋白质、多糖和脂类具有良好的生物学活性,如抗肿瘤、抗氧化、免疫调节、抗炎等[14-18]。Jiang Changxing等[19-21]从青蛤中提取出的多糖具有抗氧化和保肝活性,对人胃癌BGC-823细胞的生长具有强烈的抑制作用。赵莎莎等[22]利用碱性蛋白酶酶解青蛤内脏获得的水解物具有较好的体外抗氧化能力。叶盛旺等[23]发现青蛤肉经酶解法制备的青蛤多肽对RAW 264.7巨噬细胞有较好的免疫调节作用,认为其具有激活巨噬细胞、增强机体免疫力的潜在作用。酶法提取生物活性肽具有特异性强、效果好、副反应少、能耗低、易于被人体吸收等优点,并且酶法水解蛋白还因具有安全性高、价廉、易于推广等特性而成为当前研究的热点。然而,目前关于提取青蛤抗肿瘤活性多肽的报道并不多,本研究采用蛋白酶酶解青蛤内脏,采用正交试验方法获得最佳酶解条件,经分离纯化筛选出活性多肽,探讨其体外抗人前列腺癌DU-145细胞的活性,以期为青蛤活性多肽的制备及其抗癌作用研究提供实验依据。
1 材料与方法
1.1 材料与试剂
青蛤购于舟山市菜市场,经浙江海洋大学赵盛龙教授鉴定为青蛤。人前列腺癌DU-145细胞购于中国科学院上海生命科学院生化细胞所,由浙江省海洋生物医用制品工程技术研究中心传代保存。
碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、胃蛋白酶 北京亚太恒信生物科技有限公司;F12培养基 美国Gibco公司;胎牛血清 杭州四季青生物工程公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、胰蛋白酶美国Sigma公司;吖啶橙/溴化乙锭(acridine orange/ethidium bromide,AO/EB) 杭州昊天生物技术有限公司;JC-1细胞线粒体膜电位试剂盒 上海贝博生物公司;非转移性克隆23型(nm23H1)单克隆抗体(工作浓度按体积比1:100稀释) 美国Santa Cruz Biotechnology公司;免疫组织化学试剂盒 丹麦DAKO有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CF16RXⅡ型高速低温离心机、H-7650透射电子显微镜 日本日立公司;Forma3111 CO2培养箱 美国Thermo Scientific公司;Cogent u Scale超滤系统 德国默克密理博公司;Apurifier UPC 100快速蛋白液相色谱系统 GE医疗生命科学有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪美国安捷伦公司;超净工作台 上海智城分析仪器制造有限公司;CKX4倒置显微镜、BX2-FLB3荧光显微镜、CCD-NC6051显微摄像仪 日本Olympus公司;酶标仪美国Bio-Rad公司;easy Cyte6 HT-2L流式细胞仪 美国Millipore公司。
1.3 方法
1.3.1 细胞培养
将DU-145细胞培养在含双抗(100 U/mL青霉素、100 U/mL链霉素)和质量分数10%胎牛血清的F12培养液中,放置在37 ℃、含有体积分数5% CO2的培养箱中孵育,当细胞密度达到80%以上时用质量分数0.25%胰蛋白酶消化传代,取对数生长期的细胞进行实验。
1.3.2 青蛤内脏酶解液的制备
1.3.2.1 最佳酶种类的选择
分别取10.0 g匀浆青蛤内脏,以碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶和胃蛋白酶这5 种酶为供试酶,在各自最适酶解温度及pH值条件(表1)下,加1 200 U/g、保温6 h进行酶解。随后灭活15 min,于4 ℃、12 000 r/min离心10 min,取其上清液,采用甲醛电位滴定法测定氨基氮(amino nitrogen,ANN)含量。

表1 5 种蛋白酶的最适酶解温度和pH值Table 1 Optimum temperature and pH of proteases
1.3.2.2 酶解条件的优化
在初步确定酶种类的基础上,以对DU-145细胞的增殖抑制率(IR)为指标,以料液比、pH值、加酶量、温度、时间5 个因素进行L16(45)正交试验(表2),确定最优酶解条件。

表2 木瓜蛋白酶酶解青蛤内脏正交试验因素水平Table 2 Coded levels and corresponding actual levels of independent variables used for orthogonal array design
1.3.3 酶解多肽的分离纯化
1.3.3.1 超滤
取最佳酶及最优酶解条件下的上清液,用截留分子质量为8 kDa的超滤膜在Cogent u Scale超滤系统上进行超滤,得到小于8 kDa和大于8 kDa的两种超滤液。再用截留分子质量为5 kDa的超滤膜对小于8 kDa的部分超滤,截留获得大于5 kDa且小于8 kDa和小于5 kDa的两种超滤液。换用截留分子质量为3 kDa的超滤膜对小于5 kDa的部分超滤,截留获得大于3 kDa且小于5 kDa和小于3 kDa的两种超滤液。分别取不同分子段酶解液冷冻干燥样品配制成质量浓度15 mg/mL进行MTT实验,筛选出对DU-145细胞抑制率最高的超滤组分备用。
1.3.3.2 琼脂糖凝胶层析
取1.3.3.1节的超滤组分进行琼脂糖凝胶层析分离,酶解液质量浓度为0.05 g/mL,离心后取上清液过0.22 µm滤膜,在Apurifier UPC 100快速蛋白色谱系统上进行洗脱。色谱柱规格:300 mm×10 mm;色谱柱填料:琼脂糖凝胶;色谱柱料颗粒尺寸:(10±2)µm;上样量:500 µL;流动相:超纯水;洗脱液流速:0.5 mL/min;检测波长:280 nm;自动收集体积:3.2 mL/管。收集各峰溶液进行冷冻干燥,采用MTT法检测抑制率最高的峰组分。
1.3.3.3 HPLC法分离制备及纯度检测
取1.3.3.2节抑制率最高的峰组分通过HPLC进一步分离,其质量浓度为1.0 mg/mL。色谱柱:ZORBAX SB-C18分析型色谱柱(250 mm×4.6 mm,5 μm);检测波长:214、280 nm;流速:0.8 mL/min;流动相A为乙腈(含0.05%三氟乙酸),流动相B为超纯水(含0.06%三氟乙酸),采用梯度洗脱方式:0%(体积分数,下同)流动相B,4 min;0%~100%流动相B,25 min;100%流动相B,6 min,柱温:25 ℃;自动进样,进样量:100 μL。收集MTT法检测抑制率最高的峰组分,冷冻干燥,即得到青蛤多肽(Cyclina sinensis peptides,CSP)。
1.3.4 DU-145细胞抑制活性检测
1.3.4.1 细胞增殖抑制实验
将DU-145单细胞悬液以1×104个/mL的密度每孔200 μL接种至96 孔板。24 h后弃去培养液,设置空白对照组(正常培养基培养)及加药组(CSP质量浓度分别为2、4、8、12、15 mg/mL),每组设5 个平行孔。培养24 h后去培养液,每孔加含质量分数10% MTT的磷酸盐缓冲液(phosphate buffered saline,PBS)200 μL,继续孵育4 h。实验结束后弃去孔中液体,每孔加二甲基亚砜150 μL,充分振荡10 min。采用酶标仪于490 nm波长处测定各孔的OD值,每组实验重复3 次。按下式计算细胞增殖抑制率并计算其半数抑制浓度(half maximal inhibitory concentration,IC50)。

1.3.4.2 倒置显微镜观察细胞形态
将经泡酸、消毒处理后的盖玻片置于6 孔板内,接种密度为1×105个/mL的DU-145细胞悬液,常规孵育24 h,弃去孔中液体,设空白对照组(正常培养基培养)和加药组(CSP质量浓度分别为2、8、12 mg/mL),培养24 h,于倒置显微镜下观察各组细胞形态变化。
1.3.4.3 Hoechst 33258荧光染色观察
细胞接种密度、实验分组及药物处理同1.3.4.2节方法。24 h后终止培养,弃去各孔中液体并用体积分数2.5%戊二醛固定20 min,pH 7.2 PBS洗2 次,0.5 μg/mL Hoechst 33258荧光染液室温染色15 min,然后用PBS洗2 次,于荧光显微镜下观察拍照。
1.3.4.4 ROS检测
活性氧(reactive oxygen species,ROS)检测中细胞接种密度、实验分组及药物处理同1.3.4.2节方法。培养24 h后,细胞用胰酶消化并进行离心收集(1 000 r/min、6 min),按照体积比1:1 000用无血清的F12营养液和2,7-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)均匀悬浮细胞,浓度约为2×106个/mL。于37 ℃、5% CO2细胞培养箱内孵育20 min,为了使探针和细胞更充分地接触,每隔3~5 min将离心管上下颠倒混匀。孵育结束后用不含有血清的F12营养液洗涤细胞3 次,用来充分除去没有进入细胞中的DCFH-DA。于荧光显微镜下观察并拍照。
1.3.4.5 透射电子显微镜观察细胞微观形态
DU-145细胞接种于培养瓶中,设空白对照组(正常培养基培养)和加药组(CSP质量浓度分别为2、8 mg/mL)。培养24 h,取消化后的细胞悬液以体积分数2.5%戊二醛及锇酸双重固定,丙酮梯度脱水,中性618树脂包埋。超薄切片机切片,于透射电子显微镜下观察并拍照。
1.3.4.6 流式细胞仪检测细胞线粒体膜电位变化
细胞接种密度、实验分组及药物处理同1.3.4.2节方法。取消化的细胞悬液,于2 000 r/min离心5 min,PBS洗2 次。按试剂盒说明书操作,取1 μL JC-1试剂加入500 μL 1×Incubation Buffer混匀,10 000 r/min离心1 min,上清液即JC-1工作液;取500 μL JC-1工作液悬浮细胞并孵育20 min,室温下2 000 r/min离心5 min,并用1×Incubation Buffer洗细胞,重复2 次。混匀悬浮细胞并过200 目筛,于流式细胞仪进行检测。
1.3.4.7 免疫组织化学法检测DU-145细胞nm23H1蛋白的表达
细胞接种密度、实验分组及药物处理同1.3.4.2节方法。取出盖玻片,用丙酮固定20 min。加入体积比1:100的单克隆抗体4 ℃过夜;滴加EnVision液室温孵育30 min;使用二氨基联苯胺进行显色,光学显微镜下观察控制显色时间,自来水冲洗;苏木精复染5 min后用乙醇梯度脱水、二甲苯透明,并用中性树胶封片。于光学显微镜下观察并拍照。
1.4 数据统计与分析
实验结果以 ±s表示,数据使用SPSS 18.0软件进行单因素方差分,P<0.05表示差异有显著性。采用Excel软件作图。
2 结果与分析
2.1 酶解条件的优化
2.1.1 5 种蛋白酶的酶解结果
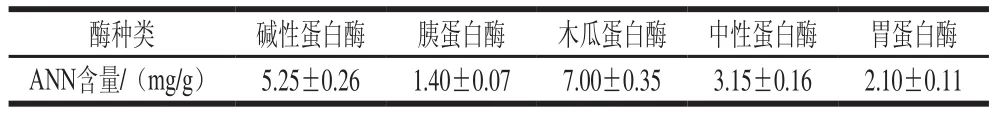
表3 5 种蛋白酶酶解青蛤内脏的ANN含量Table 3 Comparison of amino nitrogen contents of Cyclina sinensis hydrolysates produced using five proteases
每种酶在其最适的酶解温度、pH值条件下可以得到最好的酶解效果,即以最少的投料使酶解产物含量最大化,使水解彻底。ANN含量与水解度成正相关,在各自最适酶解条件下,如表3所示,木瓜蛋白酶酶解物的ANN含量最高,达到了(7.00±0.35)mg/g,碱性蛋白酶次之。说明木瓜蛋白酶对青蛤内脏的水解效果最好,故选定木瓜蛋白酶为本实验最佳酶。
2.1.2 木瓜蛋白酶酶解青蛤内脏的正交试验结果

表4 木瓜蛋白酶酶解青蛤内脏正交试验结果Table 4 Orthogonal array design with experimental results
如表4所示,从抑制率大小可知,5 个因素对酶解效果皆有影响,由极差(R)大小得D(温度)>B(pH值)>E(时间)>A(料液比)>C(加酶量),且A4B4C4D1E2组合效果最好,即料液比1:4、pH 7.0、加酶量1 500 U/g、温度45.0 ℃、酶解时间4 h。每个实验重复3 次,所得结果均为此组合效果最佳,即正交试验结果具有可靠性。
2.2 酶解液的分离纯化结果
2.2.1 超滤截留结果
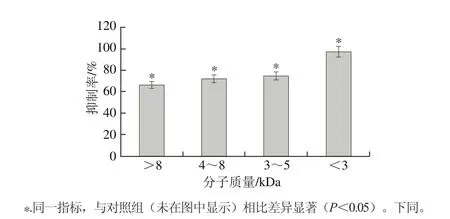
图1 酶解液的超滤截留组分对DU-145细胞的增殖抑制作用Fig. 1 Inhibitory effect of hydrolysate fractions obtained by ultrafiltration on DU-145 cells
如图1所示,小于3 kDa的酶解液对DU-145细胞的抑制率最高,达到(89.46±4.47)%。故选定小于3 kDa酶解液进行下步分离纯化。
2.2.2 Superose 12 10/300 GL层析分离纯化结果
取小于3 kDa冷冻干燥样品进行琼脂糖凝胶层析,于280 nm波长处出现3 个峰,即峰1、峰2和峰3,如图2所示。MTT法显示峰1对DU-145细胞的抑制活性最高。
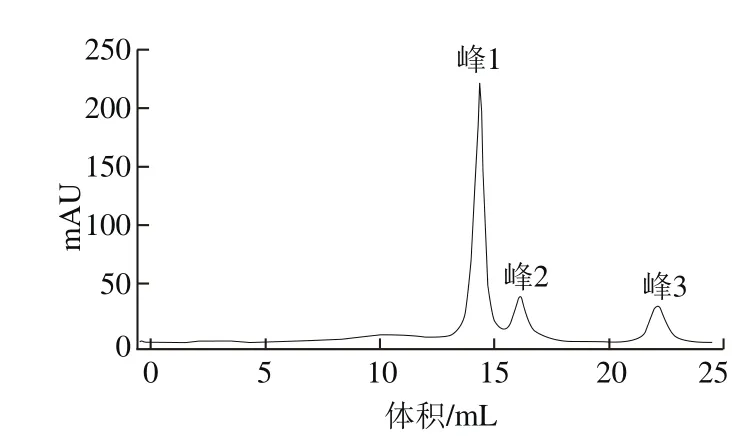
图2 琼脂糖凝胶柱洗脱峰Fig. 2 Elution peaks on agarose gel column
2.2.3 HPLC法分离制备及纯度检测结果


图3 峰1组分及保留时间12 min时峰组分的高效液相色谱图Fig. 3 High performance liquid chromatography of peak 1 and the peak of retention time 12 min
选取图3a中保留时间约为12 min的峰组分(峰面积16.32,峰高1 999.79)进行收集,经N端测序得出该肽的氨基酸序列为:Ile-Leu-Tyr-Met-Pro,分子质量635.82 Da,命名为CSP。收集12 min时峰纯品再次采用HPLC法检测纯度,在280 nm波长处约7 min时出现主要单一峰,如图3b所示。
2.3 细胞增殖抑制实验结果
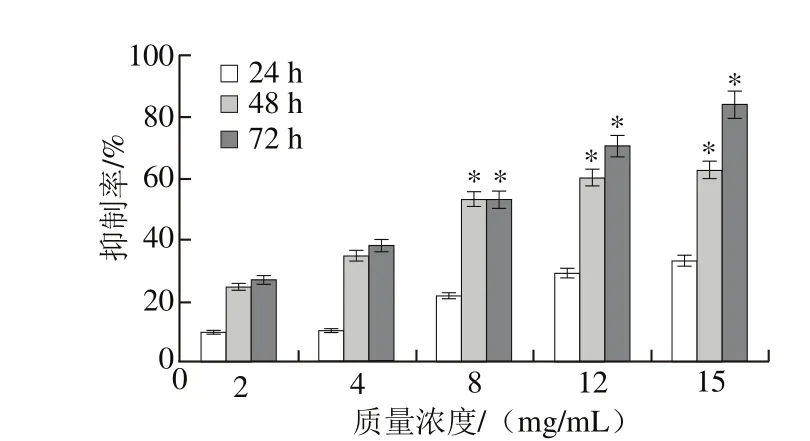
图4 CSP对DU-145细胞的增殖抑制作用Fig. 4 Antiproliferative effect of CSP on DU-145 cells
如图4所示,随CSP质量浓度的增加和作用时间的延长对DU-145细胞的增殖抑制率明显上升。当CSP质量浓度为2 mg/mL、作用时间为24 h时抑制率为(9.89±0.49)%;而当CSP质量浓度为15 mg/mL、作用时间72 h时抑制率达到(84.17±4.21)%,IC50为(5.36±0.27)mg/mL,与对照组相比差异显著(P<0.05)。
2.4 倒置显微镜观察细胞形态结果
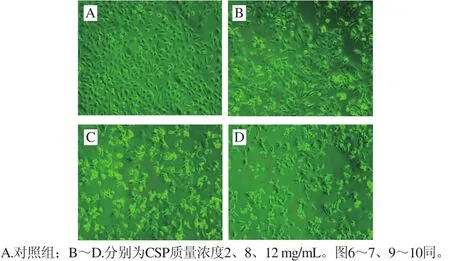
图5 倒置显微镜下DU-145细胞的形态变化(×200)Fig. 5 Morphologic changes of DU-145 cells under inverted microscope (× 200)
如图5所示,对照组DU-145细胞形态饱满、生长良好,视野下细胞数目较多(图5A);2 mg/mL组细胞间隙增大、轮廓模糊(图5B);而高质量浓度(12 mg/mL)组细胞变圆、变亮,形态更加不规则,细胞数目明显少于对照组,同时可见较多悬浮在培养液中的死细胞(图5D)。
2.5 Hoechst 33258荧光染色结果

图6 Hoechst 33258染色观察DU-145细胞形态变化(×400)Fig. 6 Morphologic changes of DU-145 cells observed by Hoechst 33258 staining (× 400)
如图6所示,对照组细胞核呈现出淡蓝色荧光,且细胞形态规则;而CSP作用后可见个别细胞核皱缩呈亮蓝色;随着质量浓度的增加,视野中细胞数减少,部分核呈碎片状或点状且形态不规则,蓝色荧光增加,同时出现了凋亡小体。
2.6 ROS检测结果
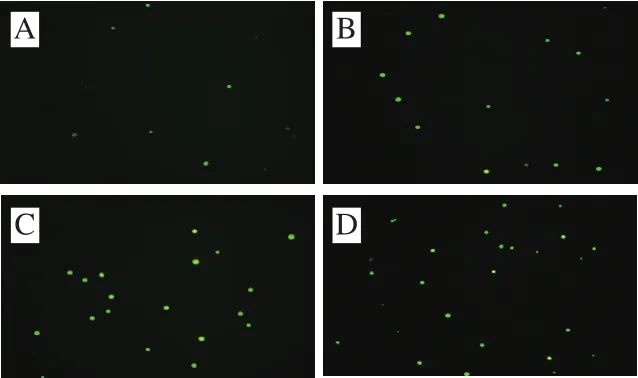
图7 CSP诱导DU-145细胞中ROS的产生Fig. 7 CSP induces ROS generation in DU-145 cells
如图7所示,对照组出现极少量的绿色荧光;与对照组比较,经CSP作用后荧光强度明显增加,且随着质量浓度的增加荧光强度依次增强。这表明DU-145细胞内ROS的产生量随着CSP质量浓度的增加呈明显增加趋势。
2.7 透射电子显微镜观察细胞微观形态结果
如图8所示,对照组DU-145细胞培养24 h后可见细胞表面有微绒毛,胞核形态规则,具有完整的核膜,染色质均匀分布,含有一个核仁。CSP处理后细胞的超微结构发生明显改变,染色质电子密度增高并浓缩聚集至核膜边缘,部分细胞膜有“出芽”现象,出现凋亡小体;随着CSP质量浓度的增加,细胞的微绒毛消失,细胞质内可见大量空泡形成,并出现了大小不一的自噬体,细胞核固缩明显,表现出凋亡细胞的特点。
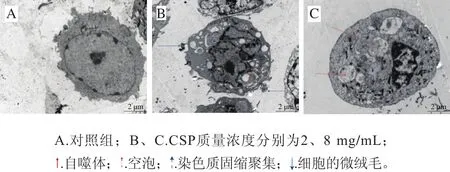
图8 CSP作用24 h后DU-145细胞的超微结构(× 3 700)Fig. 8 Ultrastructural changes of DU-145 cells incubated with CSP for 24 h (× 3 700)
2.8 细胞线粒体膜电位变化结果
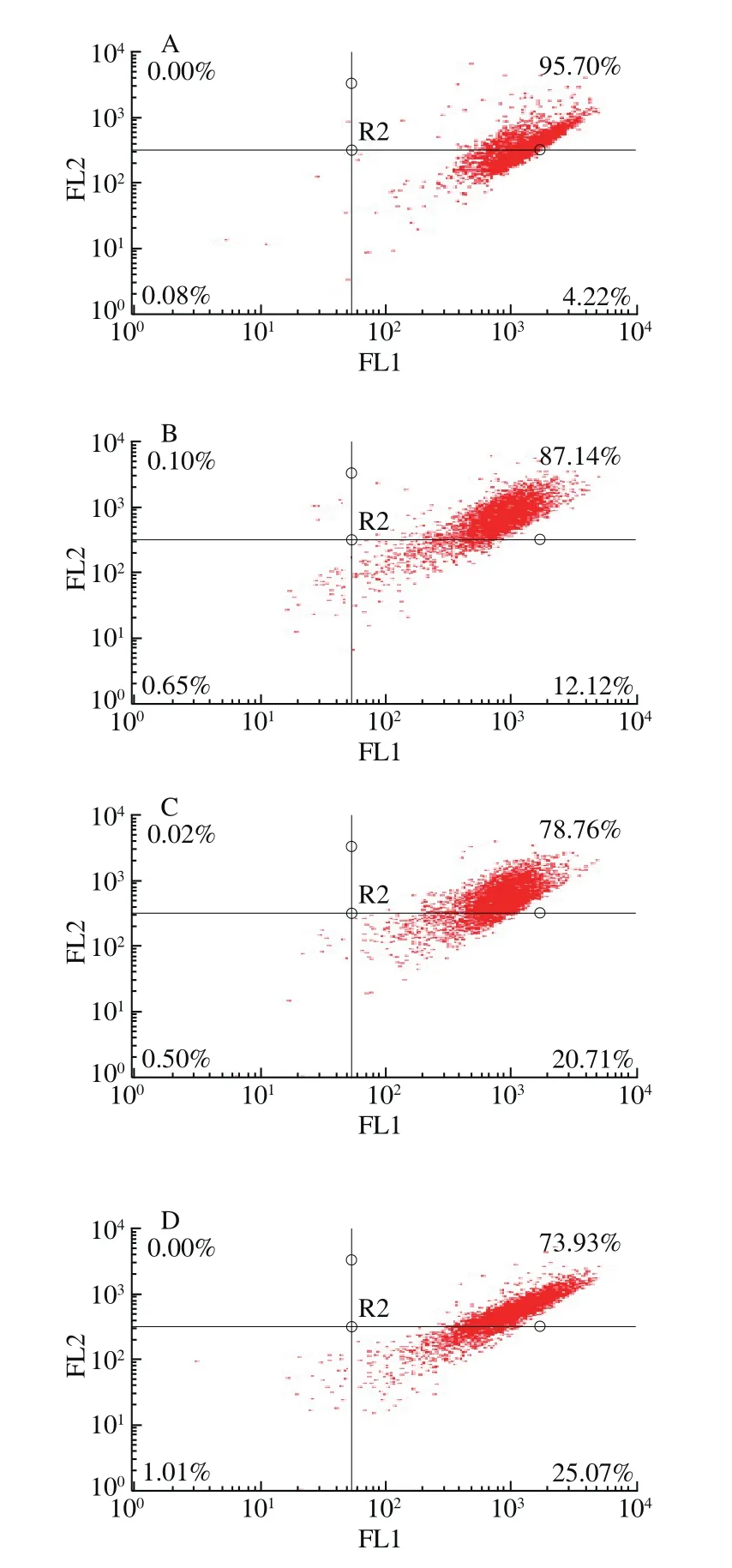
图9 CSP对DU-145细胞线粒体膜电位的影响Fig. 9 Changes in mitochondrial membrane potential of DU-145 cells treated with CSP
从图9可以看出,右上象限表示正常的膜电位比例,右下象限表示下降的膜电位比例。与对照组相比,2、8 mg/mL和12 mg/mL组膜电位下降率分别为12.12%、20.71%和25.07%。随CSP质量浓度的增大,线粒体膜电位下降率随之增大,即发生细胞凋亡的细胞数呈显著性增加趋势。
2.9 免疫组织化学法检测CSP对DU-145细胞nm23H1蛋白的阳性表达结果
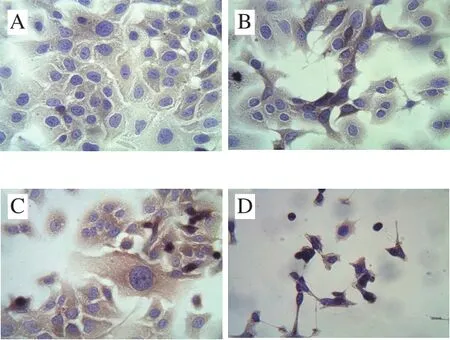
图10 CSP对DU-145细胞nm23H1蛋白表达的影响(×400)Fig. 10 Changes in expression of nm23H1 in DU-145 cells treated with CSP (× 400)
如图10所示,nm23H1蛋白阳性表达为细胞质内出现棕色结构对照组大部分细胞胞浆内呈浅棕色,个别细胞呈现阴性(图10A)。随着CSP质量浓度的增加,视野下的细胞数量明显减少,细胞质内的阳性部位颜色逐渐加深,出现了巨核细胞,部分细胞核呈固缩状态。
3 讨 论
近年来研究发现海洋生物活性肽具有较好的抗肿瘤作用[24-26],其体外抗肿瘤细胞活性常用MTT法进行筛选[27]。本研究采用酶解法提取CSP,经MTT法检测,结果显示,随着CSP质量浓度的增加和作用时间的延长,其对DU-145细胞的增殖抑制率明显上升,且具有明显的时间及剂量依赖性。当CSP质量浓度为15 mg/mL、作用72 h后,抑制率高达84.17%,IC50为5.36 mg/mL。同时DU-145细胞的形态也发生变化,表现为细胞间隙变大、形态不规则、核固缩、细胞质内出现空泡和形成凋亡小体,其中凋亡小体的形成表明CSP抑制DU-145细胞的增殖与细胞凋亡相关。
ROS是诱导细胞发生凋亡的一种重要因素,因其通过与细胞内的脂质、核酸、蛋白质发生反应,导致机体组织脂质过氧化、DNA氧化损伤和细胞内蛋白变性,对细胞造成损伤;ROS还可作为细胞内信使,活化许多信号传导通路如细胞凋亡通路,间接导致细胞损伤[28],从而使细胞内产生更多ROS。在ROS积聚的情况下,除了主动的细胞凋亡外,其能通过激活一系列信号通路来诱导细胞凋亡,导致细胞凋亡失调而使得细胞过度凋亡,引发自身免疫疾病和炎症。本研究结果表明,CSP作用后DU-145细胞ROS的产生量明显增加,且呈剂量依赖性。研究发现药物抗肿瘤作用的机制与其作用于线粒体导致功能紊乱、抑制肿瘤细胞血管生成能力等相关[29],而线粒体膜电位(线粒体膜通透性)的降低是细胞凋亡早期的不可逆事件。经流式细胞术检测,与对照组细胞相比,CSP作用后DU-145细胞的线粒体膜电位呈显著性下降趋势,随着CSP质量浓度增加,其膜电位下降率明显增加,从4.22%增加到25.07%。因此推测CSP可能通过刺激DU-145细胞产生大量的ROS引起线粒体膜通透性改变,从而启动细胞凋亡。由此可见线粒体凋亡的信号通路在CSP所诱导的DU-145细胞凋亡过程中发挥着关键性作用。
据报道,90%肿瘤病人最终的死亡原因都是肿瘤的复发、侵袭和转移,因此防止肿瘤转移的方法或药物越来越受肿瘤临床医生及患者的重视,一些与肿瘤细胞发病机制密切相关的分子靶点不断被发现,靶向药物的筛选成为当前抗肿瘤药物研究最为活跃的领域之一。nm23H1是目前研究较多的转移抑制基因,其表达程度可作为判断肿瘤有无转移的重要指标。前期的研究结果显示,nm23H1蛋白的表达与前列腺癌的发生、转移和生存率密切相关,且与前列腺癌患者的存活率呈正相关[30]。免疫组织化学法结果表明,对照组DU-145细胞中nm23H1蛋白的表达程度较低,CSP作用后表达量随着CSP质量浓度的增加逐渐增高。说明CSP能够促进nm23H1蛋白在DU-145细胞中表达,对于抑制其转移具有重要的作用,nm23H1蛋白表达量可以成为筛选CSP活性的指标。
4 结 论
本实验采用木瓜蛋白酶,在料液比1:4、pH 7.0、加酶量1 500 U/g、温度45.0 ℃、酶解时间4 h条件下对青蛤内脏匀浆液进行酶解,经超滤截留、琼脂糖凝胶层析、HPLC分离纯化最终获得CSP,经氨基酸测序得到其氨基酸序列为Ile-Leu-Tyr-Met-Pro。研究结果表明,CSP能抑制DU-145细胞的增殖,且呈现时间与剂量依赖,并使细胞出现凋亡的形态学特征,其作用机制与DU-145细胞ROS、nm23H1蛋白表达量的增加以及线粒体膜电位的降低相关。至于其通过何种信号传导通路引起凋亡的机制有待于后续研究证实。

