鸡蛋清磷酸化蛋白质组鉴定与分析
杨 燃,宋洪波,黄 群,*,刘丽莉,邱 宁,马美湖
(1.福建农林大学食品科学学院,福建 福州 350002;2.河南科技大学食品与生物工程学院,河南 洛阳 471023;3.华中农业大学食品科学技术学院,湖北 武汉 430070)
鸡蛋清具有重要的生理作用,其黏稠特性可为蛋黄和孵化中的鸡胚提供减振缓冲和物理防护作用[1-2]。在孵化过程中,鸡蛋清逐渐被鸡胚吸收,为胚胎提供水分和营养物质[3]。此外,鸡蛋清中含有溶菌酶、抗生物素结合蛋白、卵转铁蛋白等多种抗菌蛋白质,形成抵抗微生物入侵的化学屏障[4-5]。因鸡蛋清蛋白质具有优异的热凝胶性和起泡性,除了发挥生理作用和营养功能,其亦被作为食品加工的重要原料和辅料。
磷酸化修饰对鸡蛋清蛋白质的生物活性和加工特性均具有重要影响。研究表明,磷酸化可使卵转铁蛋白的β-折叠结构含量增加,并增强其抗菌活性[6-7];磷酸化卵白蛋白可促进肠道对铁的吸收[8]。此外,化学磷酸化改性蛋清粉的乳化活性及稳定性都有一定程度地提高[9],且其起泡性与泡沫稳定性都显著提高[10];卵白蛋白的化学磷酸化修饰亦能增强其凝胶性及在油-水界面的稳定性[11-12]。
然而,当前的研究主要集中在鸡蛋清及其主要蛋白(如卵白蛋白、卵转铁蛋白)的化学磷酸化修饰方面,对鸡蛋清蛋白质自身的翻译后磷酸化修饰尚鲜有系统的研究与报道。基于此,本研究通过固定化金属螯合亲和层析(immobilized metal chelate affinity chromatography,IMAC)富集鸡蛋清磷酸肽,并基于纳升液相色谱-串联质谱(nano-liquid chromatography-tandem mass spectrometry,nLC-MS/MS)的蛋白质组学技术策略,对鸡蛋清磷酸化蛋白质组进行分析;在此基础上,利用生物信息学方法对鉴定到的鸡蛋清磷酸化位点的基序特征、磷酸化蛋白质的功能等进行分析,旨在为鸡蛋清蛋白质的相关研究提供关键的蛋白质磷酸化修饰结构信息。
1 材料与方法
1.1 材料与试剂
‘白来航’鸡蛋由华中农业大学家禽研究中心农场提供,蛋鸡品种为‘白来航’,30~50 周龄,笼养,标准饲喂;鸡蛋产后24 h内进行采样,每次取7 个鸡蛋的蛋清进行混合,样品经液氮快速冻结后置于-80 ℃保存;重复取样3 次。
胰蛋白酶(质谱纯) 美国Promega公司;乙腈(色谱纯) 美国Fisher Chemical公司;甲酸(色谱纯)美国Fluka公司;碘代乙酰胺、二硫苏糖醇、尿素(均为生化试剂)、三氟乙酸(分析纯) 美国Sigma-Aldrich公司;蛋白酶抑制剂 德国Calbiochem公司;BCA蛋白定量试剂盒 上海碧云天生物技术有限公司。
1.2 仪器与设备
IMAC色谱柱 美国Bio-Rad公司;C18ZipTips脱盐色谱柱 美国Millipore公司;EASY-nLC 1000型超高效LC、Q Exactive HF-X型MS 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 鸡蛋清总蛋白提取与酶解
将鸡蛋清样品从-80 ℃取出,加入4 倍体积酚抽提缓冲液(含0.01 mol/L二硫苏糖醇、质量分数1%蛋白酶抑制剂、1%磷酸酶抑制剂),混匀后进行超声抽提。加入等体积Tris平衡酚,在4 ℃、5 500×g离心10 min,取上清液加入5 倍体积0.1 mol/L乙酸铵/甲醇过夜。离心取蛋白沉淀,用丙酮洗涤3 次,最终沉淀复溶于8 mol/L尿素中。通过BCA蛋白定量试剂盒测定总蛋白质量浓度。总蛋白提取重复3 次,样品合并后进行后续操作。
向鸡蛋清总蛋白提取溶液中加入二硫苏糖醇使其终浓度为5 mmol/L,于56 ℃还原30 min。加入碘代乙酰胺使其终浓度为0.01 mol/L,室温避光孵育15 min;将样品溶液的尿素浓度稀释至低于2 mol/L,然后以胰蛋白酶与蛋白质量比1∶50加入胰蛋白酶,于37 ℃酶解过夜;再以胰蛋白酶与蛋白质量比1∶100加入胰蛋白酶,二次酶解4 h。
1.3.2 鸡蛋清磷酸肽的亲和富集
将酶解后的肽段溶解于富集缓冲溶液(体积分数50%乙腈、6%三氟乙酸)中,并将上清液注入IMAC填料中,在旋转摇床上孵育1 h;用富集缓冲溶液洗涤IMAC填料3 次,除去未结合的非磷酸化多肽;使用体积分数10%氨水洗脱IMAC填料上结合的磷酸肽。收集洗脱液并用C18ZipTips柱脱盐,样品真空冷冻干燥后用于nLC-MS/MS分析。
1.3.3 nLC-MS/MS分析
富集后的蛋清磷酸肽样品用流动相A(含体积分数2%乙腈、0.1%甲酸的溶液)溶解后使用EASY-nLC 1000超高效LC系统进行分离。流动相B为含体积分数0.1%甲酸和90%乙腈的溶液,梯度洗脱程序为:0~40 min,5%~25%(体积分数,下同)流动相B;40~52 min,25%~36%流动相B;52~56 min,36%~80%流动相B;56~60 min,80%流动相B。流速为700 nL/min。
将分离后的蛋清磷酸肽注入纳喷电离源进行电离,然后用Q Exactive HF-X型MS进行分析。MS参数:离子源电压为2.0 kV;扫描范围为m/z 350~1 550,MS扫描分辨率为60 000,MS/MS扫描分辨率为30 000;数据采集模式为数据依赖型扫描,即在MS扫描后选择信号强度前20 位的肽段母离子,依次进行MS/MS分析;MS/MS裂解方式为高能碰撞裂解,碰撞能量为35%;MS/MS扫描的动态排除时间为15 s。实验流程如图1所示。
1.3.4 数据库搜索和生物信息学分析
MS数据使用Maxquant 1.5.2.8软件进行处理和数据库检索,数据库为UniProt Gallus gallus(29 480 条蛋白质序列)。检索参数:酶切方式设置为Trypsin/P,漏切位点数设为2;肽段最小长度设置为7 个氨基酸残基,肽段最大修饰数设为5;初次检索和主检索的一级母离子质量误差容忍度分别设为20×10-6和5×10-6,二级碎片离子质量误差容忍度为0.02 Da;半胱氨酸烷基化设置为固定修饰,可变修饰包括甲硫氨酸的氧化、蛋白N端的乙酰化,以及酪氨酸/丝氨酸/苏氨酸的磷酸化;蛋白鉴定、磷酸化修饰鉴定的伪发现率设置为1%。
通过Web-Logo在线工具(http://weblogo.berkeley.edu/logo.cgi)对磷酸化修饰位点序列进行统计分析和可视化;基于UniProt基因注释数据库(http://www.ebi.ac.uk/GOA),对鉴定到的鸡蛋清磷酸化蛋白质进行基因本体分析;利用IBS在线工具(http://ibs.biocuckoo.org/)对鉴定到的主要蛋清蛋白质磷酸化修饰位点进行标注和可视化展示。
2 结果与分析
2.1 鸡蛋清蛋白质的磷酸化修饰位点
由于鸡蛋清中磷酸化修饰蛋白质的丰度相对较低,为提高MS鉴定的丰度和精度,本研究首先通过IMAC材料对鸡蛋清磷酸肽进行亲和富集,再将富集到的磷酸肽进行nLC-MS/MS鉴定。基于MS数据,通过数据库检索,共匹配到285 个多肽,除去未磷酸化多肽和重复序列,共鉴定到33 个磷酸化修饰多肽。如图2A所示,所有被鉴定出的磷酸肽均具有较高的精度,其质量误差均小于5×10-6。鉴定到的磷酸肽包含41 个磷酸化修饰位点,归属于25 个鸡蛋清蛋白质(表1)。对鉴定到的磷酸化位点进行统计分析,结果显示,蛋清磷酸化修饰主要发生在丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)残基上,位点数量分别为38、2 个和1 个。进一步通过Web-Logo在线工具对修饰位点附近的序列特征进行统计,结果显示,基序“S-X-E”出现频率最高,其次为“S-X-[S/Y/G]”(图2B)。与其他畜产品磷酸化蛋白质组研究结果相比,不同物种样品中磷酸化修饰位点的序列特征具有较大差异,如“S-X-E”基序在猪肉的磷酸化修饰位点中较少见[13-14]。

图2 鸡蛋清磷酸化修饰多肽的质量误差分布(A)和磷酸化修饰序列特征(B)Fig. 2 Mass error distribution of identified CEW phosphorylated peptides (A) and phosphorylation sequence characteristics (B)

表1 鉴定到的鸡蛋清磷酸化蛋白和磷酸化修饰位点Table 1 Summary of the identified phosphoproteins and phosphorylation sites in CEW
2.2 磷酸化鸡蛋清蛋白质的基因本体功能分析
将鉴定到的鸡蛋清磷酸化蛋白质进行基因本体功能注释分析,结果如表2所示。在“分子功能”分类中,有13 个鸡蛋清磷酸化蛋白质具有“结合”功能,主要包括“离子结合”(11 个)、“蛋白质结合”(5 个)、“小分子结合”(5 个)。表明鸡蛋清磷酸化蛋白具有多种结合能力,暗示这些蛋白质在鸡胚发育营养递送方面具有重要作用,在功能性食品开发等领域具有潜在开发价值。有5 个鸡蛋清磷酸化蛋白质被注释为具有“分子功能调控”作用,其主要与内肽酶活性、细胞因子和神经肽激素受体活性等的调控相关。有4 个蛋清磷酸化蛋白质具有“催化活性”,涉及磷酸基团转移酶、异构酶和蛋白质水解酶。

表2 鸡蛋清磷酸化蛋白质的基因本体功能分析结果Table 2 Gene ontology analysis of identified CEW phosphoproteins
在“细胞组分”分类中,有10 个蛋清磷酸化蛋白质被注释为“细胞外区域部分”。蛋清蛋白质是由输卵管膨大部细胞合成和分泌的[15],因此,大多数属于细胞外蛋白。此外,7 个蛋清磷酸化蛋白质被注释为“细胞组分”、5 个为“细胞器”、4 个为“膜组分”。
在“生物过程”分类中,鸡蛋清磷酸化蛋白质主要参与“生物调节”、“应激响应”、“发育过程”、“细胞过程”、“转运”和“免疫响应”。其中,应激响应和免疫响应主要包括“体液抗菌反应”和“外界生物刺激响应”,表明鸡蛋清磷酸化蛋白在蛋清抗菌中发挥着重要作用。
2.3 鸡蛋清的主要磷酸化修饰蛋白质
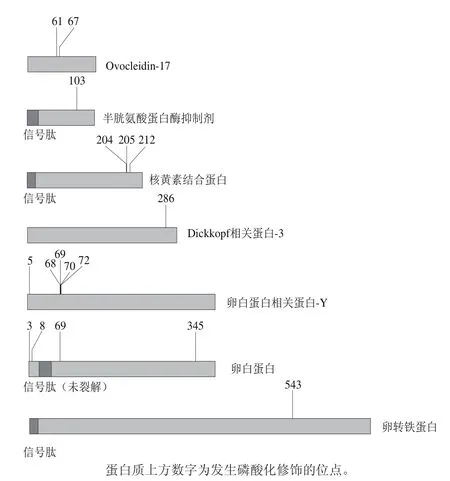
图3 鸡蛋清中7 种重要的磷酸化修饰蛋白质及其位点分布Fig. 3 Seven important phosphorylated proteins and distribution of their phosphorylation sites in CEW
在鉴定到的25 个鸡蛋清磷酸化蛋白中,卵白蛋白具有4 个磷酸化修饰位点,是磷酸化位点最多的蛋白质。多数(17 个)蛋清磷酸化蛋白质具有单个磷酸化位点(表1)。以下选择7 种在鸡蛋清中含量较高或具有重要功能的磷酸化蛋白质,对其磷酸化修饰位点进行可视化展示(图3),并对磷酸化修饰对该蛋白质功能的潜在影响分别进行讨论。
2.3.1 卵白蛋白
卵白蛋白是鸡蛋清中含量最高(约占54%)的蛋白质,具有良好的凝胶性、起泡性和乳化性。卵白蛋白在鸡蛋中的生物学作用至今尚不完全清楚,有学者认为其主要作为胚胎发育的营养来源[16]。研究显示,卵白蛋白磷酸化改性会增强其乳化性和溶解度,并能增加其与钙的结合能力,形成蛋白螯合钙,有利于钙的吸收[17-18],说明卵白蛋白的磷酸化修饰对其功能特性和生物活性具有重要作用。
本研究共鉴定到卵白蛋白的4 个磷酸化修饰位点,其中S69(SIE)、S345(SAE)是之前研究中已报道的磷酸化修饰位点[19]。这两个位点所在肽段的MS/MS数量(该数值与磷酸化修饰多肽在样品中的丰度呈正相关)在所有鉴定到的磷酸肽中最高,分别为151和144,表明这2 个位点所在的磷酸肽丰度最高。卵白蛋白的另外2 个磷酸化修饰位点S3(SIG)和S8(SME)是本研究中新发现的磷酸化修饰位点,其MS/MS数量均为1,表明这两个位点所在磷酸肽的丰度较低。4 个磷酸化修饰位点丰度的差异也证明了卵白蛋白磷酸化修饰的不均一性,即卵白蛋白的S69和S345位点发生磷酸化修饰的几率高,而S3和S8位点发生磷酸化修饰的几率很低,仅约为前者的1/100。
2.3.2 卵白蛋白相关蛋白-Y
卵白蛋白相关蛋白-Y在鸡蛋清中的相对含量较低,其与卵白蛋白都属于丝氨酸蛋白酶抑制剂家族,但不同于卵白蛋白,卵白蛋白相关蛋白-Y具有抑制丝氨酸蛋白酶的作用[16]。Nau等通过二维凝胶电泳结合免疫印迹技术,寻找卵白蛋白相关蛋白-Y的磷酸化修饰位点,结果发现其未发生磷酸化修饰[20]。然而,本研究共鉴定到该蛋白的3 个磷酸化位点:S5、S68或T69、T70或S72。Qiu Ning等发现卵白蛋白相关蛋白-Y在受精鸡蛋与未受精鸡蛋中的丰度具有显著差异,认为其可能在胚胎发育中起重要作用[21]。本研究对该蛋白质磷酸化修饰位点的鉴定将有助于其生物学功能的深入研究。
2.3.3 卵转铁蛋白
卵转铁蛋白约占蛋清总蛋白含量的12%,具有铁离子结合能力。在以前的研究报道中,鲜有发现卵转铁蛋白发生磷酸化修饰。但在相关研究中,二维凝胶电泳上的卵转铁蛋白均显示为多个蛋白点,表明其具有不同的分子质量和等电点,推测其发生了糖基化或磷酸化等翻译后修饰。本研究鉴定到卵转铁蛋白的一个磷酸化修饰位点(Y543),其MS/MS数量为1,表明该磷酸化修饰位点的丰度较低,即卵转铁蛋白在该位点发生了较低几率的磷酸化修饰。卵转铁蛋白的化学磷酸化修饰改性可增强其对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑制活性[7],而其翻译后修饰过程中发生的低频率、单位点磷酸化修饰在其分子功能中的作用需待进一步研究。
2.3.4 半胱氨酸蛋白酶抑制剂
早期研究表明,半胱氨酸蛋白酶抑制剂具有磷酸化修饰和未磷酸化修饰两种形式,部分蛋白的S103位点发生了磷酸化修饰,改变了其表面电荷性质,等电点由6.5降至5.6[22]。本研究再次证实了半胱氨酸蛋白酶抑制剂位于该位点的磷酸化修饰。磷酸化修饰虽不影响半胱氨酸蛋白酶抑制剂的抑制活性[22],但研究发现在胚胎发育过程中,磷酸化修饰参与调控其从蛋清到卵黄囊的转运过程[23]。
2.3.5 核黄素结合蛋白
核黄素结合蛋白是在鸡蛋清、鸡蛋黄以及鸡血清中均存在的蛋白质,其分子中具有两个相对独立的功能域:核黄素结合区域和磷酸化区域。核黄素结合区域以1∶1的物质的量比与核黄素结合,在胚胎发育过程中为其提供足够的核黄素。磷酸化区域不参与核黄素的结合,但参与了核黄素结合蛋白的转运,并在其与卵黄生成素的相互作用中起到关键作用[24]。文献[25]报道核黄素结合蛋白被鉴定出8 个磷酸化位点,但本研究仅鉴定到其中的3 个位点,对其磷酸化修饰结构的进一步研究将有助于深入了解其功能和转运机制。
2.3.6 Ovocleidin-17
Ovocleidin-17被认为是主要的蛋壳基质蛋白之一,在蛋清中亦有少量分布。在蛋壳矿化过程中,Ovocleidin-17可能作为钙离子结合的初始“锚点”,对蛋壳碳酸钙晶体的成核和生长具有重要作用[26]。研究显示,Ovocleidin-17具有2 个磷酸化的丝氨酸位点S61和S67[27],这两个磷酸化修饰位点在本研究中亦被鉴定到。Hecker等研究发现,Ovocleidin-17的磷酸化修饰是其钙结合能力的基础,并推测其酸性氨基酸的羧基和丝氨酸残基的磷酸基团共同构成了钙离子的结合位点[28]。
2.3.7 Dickkopf相关蛋白-3
研究显示,Dickkopf相关蛋白-3基因的mRNA在小鸡眼睛中高度表达[29],说明该基因在胚胎发育过程中起重要作用。此外,其他动物的相关研究显示,Dickkopf相关蛋白-3有可能在抑制肿瘤增长、分化、转移中发挥作用[30]。本研究鉴定出蛋清Dickkopf相关蛋白-3的1 个磷酸化位点(S286),该位点所在磷酸肽的MS/MS数量为12,表明该位点所在磷酸肽的丰度较高。磷酸化修饰往往与信号传递、蛋白质互作等相关,Dickkopf相关蛋白-3的磷酸化可能对其功能具有重要的作用。
3 结 论
本研究对鸡蛋清的磷酸化修饰蛋白质组进行系统分析,共鉴定出25 个鸡蛋清磷酸化修饰蛋白质和41 个磷酸化修饰位点。分析显示,鸡蛋清蛋白质的翻译后磷酸化修饰发生在丝氨酸、苏氨酸、酪氨酸残基上,“S-X-E”为鸡蛋清磷酸化修饰位点的主要基序。功能分析表明,鸡蛋清磷酸化蛋白质主要具有“结合”功能,主要参与“应激响应”等生物过程。本研究结果为进一步探究鸡蛋清相关科学问题提供了蛋白质结构信息。

