几类不同食物对肠道菌群调节作用的研究进展
聂启兴,胡婕伦,钟亚东,聂少平*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
肠道不仅是人体消化吸收的重要场所,同时也是最大的免疫器官,在维持正常免疫防御功能中发挥着极其重要的作用[1]。人体肠道中寄居着种类繁多的微生物,这些微生物称为肠道菌群。种类繁多的肠道细菌组成一个庞大而复杂的微生态系统,与宿主一同进化,直接参与人体的消化、营养吸收、能量供应、脂肪代谢、免疫调节、抗病等诸多方面,在人体健康中扮演着重要的角色[2]。并且在长期的共生中,人类和肠道菌群在基因水平上形成了人类-肠道菌群的基因复合体,因此,人的表型由2个基因组的信息内容及其分子互相作用共同决定[3]。此外,肠道微生物产生的一些代谢产物比如短链脂肪酸(short-chain fatty acids,SCFAs)(主要为乙酸、丙酸和丁酸)也能够调节宿主糖脂代谢、肠道屏障功能、免疫应答以及炎症状态等[4-5]。
肠道微生态平衡是宿主与肠道菌群之间相互作用的一个动态平衡。肠道菌群通过肠-脑轴途径(免疫途径、神经内分泌途径和迷走神经途径)影响宿主行为,通过免疫系统、激素水平和代谢通路影响宿主生理状态[6]。而肠道微生态平衡被破坏可能会诱发多种疾病,包括肥胖、糖尿病等代谢综合征。研究表明,肥胖个体中拟杆菌门/厚壁菌门的比例低于正常人群,同时体内含有较高丰度的产脂多糖的革兰氏阴性菌及较低丰度的嗜黏蛋白阿克曼氏菌属(Akkermansia spp.)[7]。与正常人群相比,糖尿病患者肠道菌群的厚壁菌门、梭菌目明显减少,双歧杆菌数目显著降低,产丁酸细菌减少、机会致病菌增加[8]。
肠道菌群的复杂结构与宿主的生理状态、遗传、饮食习惯、年龄和环境等多重因素密切相关[9]。其中,膳食可能是改变肠道菌群最为重要的因素[10]。膳食与肠道菌群多样性密切相关,尽管不同物种其肠道菌群存在差异性,但具有相同饮食结构的不同物种的肠道菌群结构更相似。食草动物、杂食动物与食肉动物的肠道菌群组成彼此各不相同。食草动物肠道菌群多样性最高,其次为杂食动物,食肉动物的菌群多样性最低[11]。毛螺菌属(Lachnospira)和普雷沃氏菌属(Prevotella)与植物性膳食呈正相关,而瘤胃球菌属(L-Ruminococcus)与链球菌属(Streptococcus)则与动物性膳食呈正相关,并且与植物性膳食呈负相关[12]。高脂饮食能够诱导肠道内产内毒素的革兰氏阴性菌数目增多以及保护肠屏障的双歧杆菌丰度减少,从而促进氧化应激和增加肠道通透性[13-15]。这些结果均表明膳食对肠道菌群影响的重要性。而膳食中含有的膳食纤维、多酚、低聚糖等物质能够通过调节肠道菌群的组成和丰度,通过调节肠道微生态改善宿主生理状态(图1)[16-19]。本文将根据国内外研究成果,重点介绍日常膳食中常见的一些食物或其有效成分对肠道菌群的调节作用,展望以肠道菌群为靶点、膳食干预代谢性疾病的预防与治疗前景。
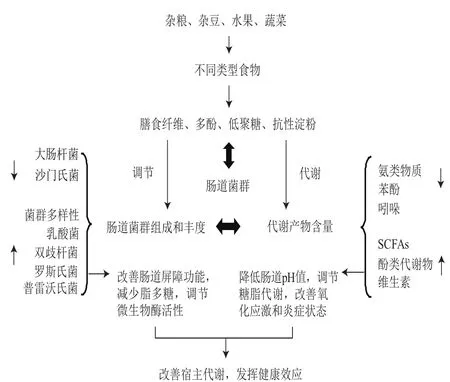
图1 膳食功能性成分对肠道微生态的影响[16-19]Fig. 1 Impact of functional compounds from diet on gut microbiota [16-19]
1 几类食物对肠道菌群的影响
1.1 谷物类
谷物在农业形成伊始就是人类膳食的一部分,并逐渐成为人类饮食结构的主要组成部分,为人类提供碳水化合物、蛋白质等大量营养素和B族维生素、矿物质等微量营养素。随着生产力的发展,谷物的加工精度也变得越来越高。相比于全谷物食物,长期摄入精制谷物可能会增加某些疾病的发病率(如2型糖尿病、增加内脏脂肪等),表明丢弃的谷糠中可能还含有其他保健功能成分[20-21]。全谷物含有更全面的营养价值,摄入后可通过调节肠道菌群有益于身体健康[22]。
1.1.1 麦类食物
Martinez等[23]研究全谷物大麦、糙米以及大麦和糙米混合物(质量比1∶1)对人体肠道菌群的影响,发现这3种全谷物食物一定程度上能够通过调节肠道菌群从而改善部分代谢紊乱相关性指标。28 位健康人群每天分别摄入60 g大麦、糙米及混合全谷物食物,结果表明3种食物摄入后增加了肠道菌群的多样性、厚壁菌门/拟杆菌门的比例以及Blautia菌属的丰度,并且大麦的摄入还增加了罗斯氏菌属(Roseburia)、双歧杆菌属(Bifidobacterium)和小杆菌属(Dialister)的丰度。3 种食物(尤其是大麦和糙米混合物)降低了血浆白细胞介素-6(interleukin-6,IL-6)含量和餐后血糖水平,而IL-6的含量又与肠道内小杆菌属的丰度呈正相关,与红蝽菌科(Coriobacteriaceae)的丰度呈负相关。此外,在种水平上直肠真杆菌(Eubacterium rectale)的丰度与餐后血糖和胰岛素密切相关,表明肠道菌群的变化与宿主血糖调节存在密切相关性。全谷物青稞干预8 周后显著降低了高脂饮食诱导的肥胖小鼠肠道内拟杆菌属(Bacteroides)丰度,以及增加产SCFAs的普雷沃氏菌属(Prevotella)和厌氧弧菌属(Anaerovibrio)的丰度,这几类菌的变化可能是青稞发挥降血脂和降胆固醇效果主要原因[24]。de Angelis等[25]发现全谷物大麦的摄入显著增加健康人群肠道内瘤胃球菌属(Ruminococcus sp.),罗斯拜瑞氏菌属(Roseburia hominis)和梭菌科(Clostridiaceae)的丰度,显著降低厚壁菌门(Firmicutes)和梭菌属(Fusobacteria)的丰度。而且粪便SCFAs(乙酸、丙酸、丁酸)的含量也显著上升,表明全谷物大麦能够调节肠道菌群的组成和代谢途径,从而导致SCFAs的增加。赵兰涛等[26]通过体外酵解探究全谷物对人体肠道菌群的影响,以5 种全谷物(燕麦、大麦、全麦、糙米、黑米)和1 种精制谷物(大米)为研究对象,通过对菌落计数发现全谷物样品酵解后双歧杆菌数量显著增加,肠杆菌科和梭状芽孢杆菌数量显著下降,除黑米外其他谷物发酵液中乳酸杆菌含量也显著增加,而精制谷物大米酵解后的结果与全谷物发酵结果相反,尤其是肠杆菌科的数量由7.231(lg(CFU/mL))增长到8.041(lg(CFU/mL))。
这些结果可能是由麦类全谷物中含有的膳食纤维、酚类和脂类等物质共同作用产生[27]。其中β-葡聚糖作为麦类中广泛存在的一种膳食纤维,摄入后不被消化道的胃酸和酶类消化,进入大肠后为双歧杆菌、普雷沃氏菌、梭菌和拟杆菌等肠道菌提供营养源,使其迅速增殖并产生大量SCFAs及一些抗菌素物质,降低肠道内pH值以及抑制肠道内氨和吲哚等有害物质生成、抑制有害菌生长,从而改善肠道微生态[18]。尤其是β-葡聚糖发酵的主要产物——丙酸,不仅能够调节碳水化合物和脂肪代谢以及抑制脂肪生成酶的活性,还能抑制胆固醇的合成从而影响血脂水平,所以燕麦等食物在降低血清胆固醇等方面具有较好的效果[22]。由于不同麦类食物中β-葡聚糖的结构和分子质量不同,对调节肠道菌群的效果也有一定的差异,因此不同来源的β-葡聚糖可能发挥不同的益生菌保护效应[28-29]。此外,麦类中的酚类物质通常与膳食纤维结合,摄入后在大肠中被微生物分解代谢,通过其代谢产物对肠道微生态和宿主健康产生影响[27]。
1.1.2 其他谷物
科多小米(Kodo millet)摄入后增加了高脂饮食小鼠肠道内有益菌双歧杆菌属(Bifidobacteria)、乳酸杆菌属(Lactobacillus sp.)、嗜黏蛋白阿克曼氏菌属(Akkermansia)和罗斯氏菌属(Roseburia spp.)的丰度,并显著增加盲肠乙酸和总SCFAs的水平。同时高脂饮食导致的血清高血脂、高胆固醇、脂多糖和IL-6含量也出现显著下降,表明科多小米可能能够作为功能性膳食调节肠道菌群从而缓解高脂饮食诱导的生理病变[30]。以全谷黑米为基质进行体外酵解也能够提高小鼠肠道益生菌数量,降低肠杆菌科丰度,对肠道发挥益生作用[26]。
全谷物玉米(48 g/d)摄入21 d后显著增加了健康人群肠道内双歧杆菌的丰度,而停止食用3 周后双歧杆菌的数量回到初始状态[31]。Costabile等[32]根据剂量耐受程度和肠道菌群的变化确定了健康人群摄入玉米可溶性膳食纤维(主要为葡聚糖)的最佳剂量,结果表明每天摄入6 g玉米可溶性膳食纤维能够显著增加粪便中双歧杆菌属的含量,且乳酸杆菌/肠球菌的比例也高于12 g/d和18 g/d组,这些结果表明全谷物玉米可能会对肠道双歧杆菌进行特异性的增殖。
Xiao Shuiming等[33]采用以薏仁、玉米、燕麦、荞麦和山药等含有大量膳食纤维的全谷物膳食为主,辅以中医药食同源食物和益生元的混合膳食对123 名肥胖患者进行饮食干预,结果表明肥胖患者肠道菌群结构能够得到明显改善,主要表现在条件致病菌或产脂多糖菌、肠杆菌科和脱硫弧菌科丰度的降低(肠杆菌和脱硫弧菌所产脂多糖内毒素活性较高)以及双歧杆菌科丰度的增加。同时患者体内血压、血脂、肝功能、糖代谢和炎症指标等各项生理生化指标得到显著改善。尤其是一名患者经过6 个月的干预后体质量下降60.5 kg,糖化血红蛋白质量分数从7.58%下降至4.52%,分析后发现其肠道菌群中一种肠杆菌科的细菌异常增殖。经过分离培养,得到一株产脂多糖的阴沟肠杆菌(Enterobacter cloacae B29),该菌被认为能够引起宿主肥胖和胰岛素抵抗[34]。
高粱脂质提取物摄入后显著增加了仓鼠肠道内双歧杆菌的丰度,降低了红蝽菌科的丰度,同时双歧杆菌的丰度与高密度脂蛋白胆固醇含量呈正相关,因此通过高粱提取物对肠道菌群进行膳食调节可能在调节胆固醇代谢甚至治疗心血管疾病方面具备较好的前景[35]。
薏仁多酚也具有类似的效果,能够调节肠道菌群以及缓解高胆固醇饮食诱导的代谢紊乱。薏仁多酚的摄入减少了动物体内丹毒丝菌科、梭状芽孢杆菌科以及毛螺菌科中Blautia luti属的丰度,而这3 种菌均与体内脂代谢平衡有着重要的关系[36]。Guo Mingzhang等[37]通过体外实验也发现薏仁能够抑制有害病原菌的生长以及促进有益菌的生长,同时动物实验表明薏仁能够缓解三硝基苯磺酸诱导的溃疡性结肠炎,增加体内乳酸杆菌的水平,但是同时体内大肠杆菌的丰度也有相应的增加。
杂粮谷物具有更全面的营养价值,其调节肠道菌群机制可能是因为杂粮膳食纤维摄入后在结肠作为微生物底物被选择性的分解和发酵,产生的SCFAs既能被宿主肠壁快速吸收利用,参与一系列物质能量代谢通路,也能通过激活一系列的受体产生胰高血糖素样肽、酪酪肽和瘦素等肠道激素从而调节宿主生理状态[18]。膳食纤维被肠道双歧杆菌和乳酸杆菌等有益菌利用后,一方面分泌乳酸、乙酸刺激肠壁,促使肠道蠕动,保护肠屏障功能;另一方面通过降低肠道pH值抑制大肠杆菌和沙门氏菌等病原菌的生长,减少有毒发酵产物的形成,进而改善肠道微环境[38-39]。同时,当膳食纤维等基质被肠道菌群酵解时,杂粮中的小部分酚类物质逐渐被释放并吸收,而大部分未被吸收的酚类能够发挥抗氧化与抗菌作用从而抑制肠道病原菌的增殖,因此全谷物中膳食纤维与酚类物质的结合能够提升全谷物对肠道菌群的调节以及对机体的健康效应。此外,酚类物质也被认为能够发挥类似益生元的效应,促进有益菌以及抑制肠道病原菌的增殖[40-41]。
1.2 豆类
豆类作为人类三大食用作物之一,具有非常高的营养价值和生理功能特性。除富含蛋白质、碳水化合物、脂肪以及维生素外,豆类中还含有丰富的膳食纤维(质量分数8%~10%)[42]。豆类膳食纤维中可溶性与不可溶性的比例均衡,可有效降低人体血清胆固醇水平以及冠心病、糖尿病、肠癌的患病几率,尤其是其含有的抗性淀粉及大豆多糖、低聚糖,摄入后能够增加饱腹感和调节肠道菌群[42]。因此豆类食物在改善能量代谢、代谢综合征以及肥胖方面可能具有非常重要的作用[43]。
水溶性大豆多糖主要由半乳糖、阿拉伯糖、半乳糖醛酸、鼠李糖、岩藻糖、木糖和葡萄糖等组成。张树和等[44]建立体外人体肠道酵解模型,使用选择性培养基检测大豆多糖酵解物中肠杆菌、肠球菌、双歧杆菌和乳酸杆菌的活菌数,观察大豆多糖对肠道菌群的影响。结果表明大豆多糖具有较好的益生元效应,能够促进乳杆菌和双歧杆菌的增殖,尤其对长双歧杆菌具有明显的促进作用。Nakata等[45]发现大豆多糖能够通过调节肠道菌群降低蛋白在体内降解产生的有害腐败物浓度。通过体外酵解实验发现,大豆多糖及大豆低聚糖不仅能够显著降低酵解体系的pH值,还能够有效抑制一些有害物质比如氨、吲哚以及苯酚的生成。在动物饲料中添加质量分数2%的大豆多糖,可增加大鼠肠道菌群多样性以及盲肠SCFAs的含量,在门水平上拟杆菌的相对丰度增加了23.4%(12.6%到36.0%),厚壁菌相对丰度降低了12.6%(58.9%到47.3%),除此之外,对照组主要以放线菌(11%)、蓝藻菌(5%)以及TM7(7%)为主,而大豆多糖组则以柔壁菌为主(12.6%);在科水平上,大豆多糖组含有相对较多的普雷沃氏菌、丹毒丝菌、疣微菌、毛螺菌以及乳酸杆菌。肠道菌群发酵多糖产生SCFAs能够抑制腐败物质的产生,同时肠道菌群能够利用氨进行生物合成从而达到调节肠道微生态的目的[46]。
黄豌豆粉具有调节金色叙利亚仓鼠盲肠菌群、能量代谢和体内胰岛素的功能。黄豌豆粉摄入降低高胆固醇饮食仓鼠盲肠厚壁菌的丰度以及增加梭菌及杆菌(尤其是乳酸杆菌)的丰度,同时胰岛素循环以及葡萄糖循环水平也出现显著降低[47]。Monk等[48]发现蔓豆能够通过增加正常小鼠盲肠质量以及粪便SCFAs含量从而提高结肠微生物的活性,其中黑色蔓豆和非黑色蔓豆在肠道菌群的组成、α-多样性、β-多样性及操作分类单元丰度上没有显著差别。而相比于对照组,蔓豆的摄入对小鼠肠道菌群的多样性表现出明显的变化。尽管在门水平上没有显著差别,但是蔓豆粉显著降低了厚壁菌门中乳酸杆菌科、消化球菌科、消化链球菌科以及梭菌科的丰度,尤其是能够降低宿主肠道内有害菌产气荚膜梭菌属(Clostridium perfringens)和瘤胃球菌属(Ruminococcus gnavus)的丰度;在拟杆菌门中降低了理研菌科和Pophyromonadaceae科的丰度、增加了S24-7菌科和普雷沃氏菌科的丰度,这可能是因为蔓豆中含有丰富的酚类物质和可发酵物质。菜豆提取物能够改善饲喂高脂膳食小鼠肠道内双歧杆菌属、乳酸杆菌属和嗜黏蛋白阿克曼氏菌属(Akkermansia)的丰度,同时高脂诱导产生的肥胖、胰岛素抵抗和肝脏脂肪病变也得到一定程度改善[49]。这些结果表明含豆类丰富的膳食可能具有调节肠道菌群活性及组成的功能。
豆类中的抗性淀粉、多糖和低聚糖被人体摄入后不被消化道所消化吸收,到达大肠后被微生物利用进行厌氧发酵,释放维生素以及SCFAs等代谢产物,这些微生物的代谢产物又能通过能量和炎症状态的调节、基因表达、细胞周期阻滞和细胞凋亡等改善宿主生理状态[50-52]。尤其是豆类中的低聚糖(棉籽糖和水苏糖)能够特异性地被双歧杆菌和拟杆菌等肠道菌酵解,从而降低肠道pH值以及减少肠道腐败物的产生[53]。同时在这些物质的酵解过程中,微生物的组成和活性发生相应的变化,部分有益菌的丰度和活性升高、有害菌的丰度下降,从而调节肠道微生态发挥健康效应[54]。
1.3 果蔬类
水果和蔬菜是人类膳食中的重要组成部分。果蔬能量密度较低,并含有丰富的膳食纤维和多酚类抗氧化物质。这些有效成分可调节肠道微生态的平衡从而达到保持身体健康的目的。大量研究表明果蔬及果蔬制品能有效地促进肠道内有益菌如乳酸杆菌和双歧杆菌的生长[55-56]。
1.3.1 蔬菜类
罗格斯红色生菜(Rutgers Scarlet Lettuce)含有丰富的膳食纤维(质量分数7.8%)和酚类物质(78 mg/g,普通绿色生菜为11 mg/g)能够改善高脂饮食动物肠道内菌群结构,具体表现在降低肠道内厚壁菌/拟杆菌的比例,同时显著增加与糖类降解相关的细菌如瘤胃球菌属(Ruminococcus spp.,降解抗性淀粉)与罗斯氏菌属(Roseburia spp.,降解植物多糖)以及氧化丁酸盐细菌消化球菌科的丰度[57]。动物饲料中添加富含葡甘露聚糖的魔芋粉能够增加拟杆菌、厚壁菌、螺旋体菌和疣微菌门的丰度,降低放线菌和变形菌门的丰度,降低血清活性氧和8-羟基脱氧鸟苷以及增加谷胱甘肽过氧化酶的水平,改善胰岛素抵抗和胰岛素敏感性,而且嗜黏蛋白阿克曼氏菌属(Akkerermansia)以及罗斯氏菌属(Roseburia)丰度的增加与胰岛素敏感性呈正相关,表明魔芋可能通过调节肠道菌群改善胰岛素敏感性从而调节血糖状态[58]。苦瓜粉能够显著降低2型糖尿病大鼠禁食血糖及血清胰岛素水平,降低厚壁菌/拟杆菌门的比例,同时显著降低疣微菌科、拟杆菌属和瘤胃球菌属(Ruminococcus)的丰度,但未影响它们的菌群多样性。这种效果可能是通过苦瓜粉抑制丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的活化来实现的,MAPK信号通路能够被胆汁酸激活,而胆汁酸代谢又与肠道菌群密切相关[59]。紫山药具有良好的益生元效应,能够促进乳酸杆菌与双歧杆菌的增殖且2种菌之间存在共生效应[60]。Kellingray等[61]发现芸苔属(西兰花等)能够降低人体肠道内硫酸盐还原细菌、疣微菌科、理研菌科、艰难杆菌科(Mogibacteriaceae)以及梭菌属(Clostridium)的丰度,这种结果可能是因为甘蓝中含有相对较多的含硫化合物,从而抑制肠道内某些微生物的增殖。
1.3.2 水果类
水果或水果中的多酚类物质能改善由高脂饮食引起的菌群失调,进而改善宿主的脂代谢状况。厚壁菌门/拟杆菌门比例的增加是高脂饮食诱导肠道菌群失调的最主要现象,同时高脂饮食降低肠道菌群的多样性、增加有害菌的丰度,损害肠道屏障功能进而导致内毒素血症和损伤体内的能量代谢途径[62-63]。
1.3.2.1 葡萄
葡萄中含有丰富的多酚类物质,主要有花青素、黄酮醇、羟苯酸盐以及酚酸等。葡萄粉能够一定程度上改善高脂膳食导致的肠道菌群失调,主要体现在增加肠道菌群多样性、促进软壁菌门、毛螺菌科和粪球菌属(Coprococcus)以及抑制Mogibacteriaceae科的增殖,并增加盲肠中SCFAs的含量,而粪球菌属的丰度与短链脂肪酸的产生又有着极其密切的联系。葡萄粉缓解高脂饮食导致的体质量与体脂增加,降低血清甘油三酯、脂多糖结合蛋白和单核细胞趋化蛋白的水平可能与肠道菌群有关[64]。Baldwin等[65]发现每天摄入占体质量3%~5%的葡萄,不仅能有效缓解高脂饮食所诱导的肠道上皮细胞紧密连接蛋白ZO-1的损伤以及抑制肝脏中过氧化物酶体增殖物激活受体γ2、硬脂酰CoA去饱和酶-1、细胞甘油-3-磷酸酰基转移酶和脂肪酸结合蛋白4的表达;同时摄入3%葡萄降低了脱硫杆菌和沃氏嗜胆菌相关异化型亚硫酸盐还原酶基因dsrA-Bw的表达量、增加了有益菌嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)的丰度,且双歧杆菌属(Bifidobacterium)、乳酸杆菌属(Lactobacillus)和Allobaculum属的丰度与肥胖呈负相关。这些结果表明葡萄中的一些活性物质能够通过调节肠道菌群的结构和功能从而缓解高脂饮食导致的生理状态紊乱。此外,葡萄籽提取物中的多酚物质能促进双歧杆菌与乳酸杆菌的生长,而其中含有的一些单体物质如儿茶素和表儿茶素则对一些有害菌如铜绿假单胞菌、肺炎杆菌、大肠杆菌、粪肠球菌、酿脓链球菌和流感嗜血杆菌等具有良好的抑制作用[66]。
1.3.2.2 越橘类
越橘中含有丰富的白藜芦醇、花青素和鞣花单宁等抗氧化物质。越橘(Lingonberries)摄入增加了与肠道黏膜健康及抗炎相关的嗜黏蛋白阿克曼氏菌(Akkermansia)和普拉梭菌(Faecalibacterium)两个属的丰度,显著降低了厚壁菌门/拟杆菌门的比例,从而有效改善高脂饮食诱导的炎症和内毒素血症以及肠道菌群的组成和功能,同时富集能量、脂质、氨基酸和核酸代谢相关基因,降低与细菌转动和活力有关的基因水平[67]。采用蔓越橘提取物干预8 周显著增加饲喂高脂高糖小鼠体内黏蛋白降解细菌嗜黏蛋白阿克曼氏菌属的丰度(增加30%),阿克曼氏菌的富集可能会缓解肠道内炎症及氧化应激,从而减轻小鼠体质量和内脏脂肪质量增加,提高胰岛素敏感性,减轻肝脏质量和甘油三酯浸润[68]。黑加仑的摄入不仅能够增加肠道双歧杆菌和乳酸杆菌的丰度,同时也能够降低拟杆菌属和梭状芽孢杆菌属(Clostridia)的丰度以及降低β-葡萄糖醛酸酶的活性[69]。β-葡萄糖醛酸酶是肠道主要的微生物水解酶,主要存在细胞内溶酶体中,能够水解无毒的糖苷释放出有毒的代谢物,对前致癌物、致癌物、致突变物和毒素物质等具有激活作用,而拟杆菌属、大肠杆菌(Escherichia coli)和产气荚膜梭菌属(Clostridium perfringens)具有相对较高的β-葡萄糖醛酸酶活性[70]。蓝莓提取物能抑制革兰氏阴性菌肠道沙门氏菌的增长;野生云苺和覆盆子也对肠道病原菌葡萄球菌和沙门氏菌表现出极强的抑制作用,这可能是因为其中含有丰富的鞣花单宁(分别为191、146 mg/g)[71-72]。动物灌胃新西兰蓝莓提取物(4 mL/(kg·d))能够显著增加盲肠乳酸杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)的丰度[73]。Vendrame等[74]发现正常人群摄入野生蓝莓汁(Vaccinium angustifolium,25 g/d)6 周后显著增加了双歧杆菌属的丰度,这些结果表明越橘类食物能够促进肠道益生菌如乳酸杆菌和双歧杆菌的增殖以及抑制某些肠道病原菌如葡萄球菌和沙门氏菌等的增殖,从而达到调节肠道微生态、促进宿主健康的目的。
1.3.2.3 其他水果
苹果中含有丰富的果胶以及酚类物质。正常人群摄入苹果2 周(2 个/d)后,粪便中双歧杆菌属、乳酸杆菌属和链球菌属(Streptococcus)的丰度呈上升趋势,肠杆菌科(Enterobacteriaceae)与假单胞菌属(Pseudomonas)丰度呈下降趋势,产气荚膜梭菌属(C. perfringens)丰度和肠道内毒性物质氨和硫化物含量显著降低,表明苹果能调节肠道菌群并有效改善肠道内环境[75]。苹果果胶摄入6 周能够改善高脂饮食引起的肠道菌群(拟杆菌门/厚壁菌门)失调并且能调节至正常水平;而苹果果胶缓解高脂饮食所致肠屏障组分碱性磷酸酶和紧密连接蛋白Claudin 1表达水平低下,降低血清内毒素产量和回肠TLR4的表达水平,以及减缓大鼠体内炎症和代谢内毒素血症状态可能与菌群调节相关[76]。
火龙果花青素可以一定程度改善高脂饮食导致的肠道菌群结构失调并显著增加嗜黏蛋白阿克曼氏菌属(Akkermansia)的丰度,从而调节代谢紊乱与炎症状态,减轻内脏脂肪堆积,改善肝脏脂肪变性和胰岛素抵抗[77]。
石榴汁能有效改善丙烯醛摄入导致的动脉粥样硬化小鼠肠道菌群紊乱,并且能够特异性的增加疣微菌科和毛螺菌科的丰度,同时小鼠体内高脂血症和血清脂质过氧化反应也得到显著改善并减少主动脉脂肪聚集[78]。石榴皮提取物含有丰富的多酚,添加石榴皮提取物虽然不能减轻由高脂饮食引起的体质量增加、糖耐量异常和炎症因子水平升高,但能降低血清总胆固醇和低密度脂蛋白胆固醇,富集肠道中双歧杆菌属的数量。石榴皮提取物对脂代谢的改善作用可能与肠道菌群的改善有关[79]。
Smith-Brown等[80]发现蔬菜类食物的摄入与毛螺菌属(Lachnospira)的丰度呈正相关,而水果(主要是苹果和梨)的摄入与瘤胃球菌属(Ruminococcus gnavus)的丰度呈负相关。患有哮喘的婴儿在出生后的前100 d中出现一定程度的肠道菌群失调,其中主要表现为毛螺菌属(Lachnospira)等肠道菌丰度的下降,因此母亲在怀孕期间摄入足够的蔬菜可能能够降低新生儿哮喘的几率[81]。
果蔬对人体肠道菌群的影响可能是通过其富含的多酚和膳食纤维[82-83](表1)。食物及草本植物中的多酚通常与糖类或者有机酸形成共轭复合体,与肠道菌群相互作用后通过生物转化形成活性代谢物。人体摄入多酚后,少部分非糖基化酚醛化合物如单体黄烷-3-醇、原花青素二聚体(游离酚)等可被小肠被吸收经过氧化、还原和水解,在肠细胞和肝细胞中参加生物转化,形成一系列的水溶性共轭代谢物迅速释放进入体循环进而分配到各器官或以尿液形式排出[84]。大部分多酚(结合酚,90%~95%)躲过小肠的消化吸收、进入结肠,由微生物进行代谢分解,从而增强多酚的生物利用率[85]。多酚的分解代谢主要分为水解(去糖基化和酯键水解)、解离(C环断裂、脱内酯化和脱甲基化)和降解(脱羟基和双键还原)3个部分。比如某些肠道菌如双歧杆菌、乳杆菌、拟杆菌和肠球菌具有降解糖苷键作用从而促进多酚糖类共轭复合体的降解释放多酚苷元,随后被水解的苷元在肠道厌氧条件下被梭菌和红蝽菌科等产生的酶作用打开C环,最终通过刺激还原反应降解多酚[86]。而多酚经过肠道菌群生物转化后产生雌马酚、苯甲酸和苯乙酸等化合物,通过这些化合物对肠道微生态和宿主健康产生影响。体外实验和人体实验也表明多酚能够改变肠道菌群的组成,抑制或促进某类菌群的生长,从而调节肠道微生态促进宿主健康[86-88]。而果蔬膳食纤维除促进肠道蠕动、SCFAs的生成外,为肠道中微生物发酵所提供的能量可进一步刺激植物多酚的分解代谢,使其能够通过肠道屏障从而增加多酚的生物活性功能[89]。
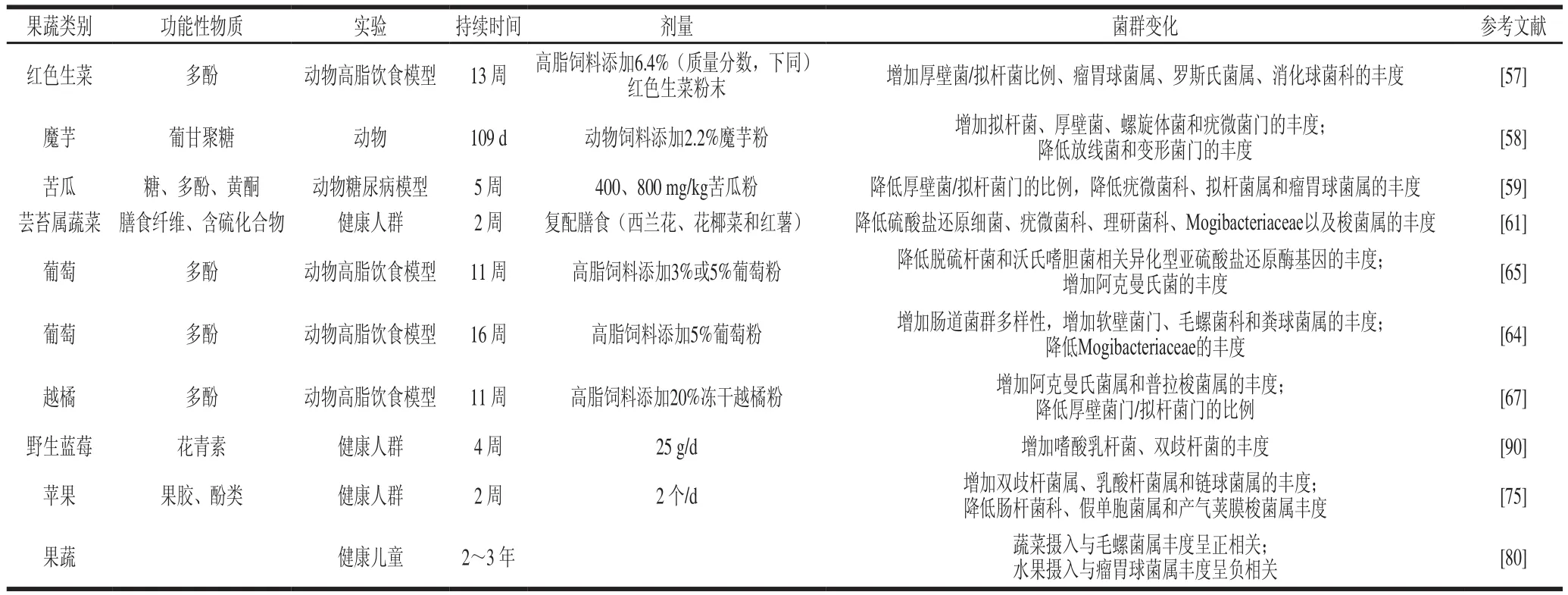
表1 水果蔬菜对肠道菌群的影响Table 1 Influence of fruits and vegetables on gut microbiota
2 结 语
肠道微生物在人体健康中发挥着重要作用。肠道菌群在调节宿主的代谢状况中存在着一些因果关系,人们逐渐认识到维持肠道菌群平衡的重要性。相比于生理状态、宿主遗传、年龄和环境等不可控或难控制因素,通过合理膳食达到调节肠道菌群促进宿主身体健康可能具有一定程度上的优势。因此,了解不同食物组分对肠道菌群的影响,能够为未来通过不同食物组合调节肠道菌群改善宿主健康提供相应理论依据。
不同膳食组成与配比对人体肠道菌群的组成及功能具有不同程度的影响,从而影响宿主代谢及健康。随着生活水平的提高以及生活节奏的加快,高脂高糖饮食等不健康的饮食习惯会引起肠道菌群的失调,增加肠道通透性及腐败物质,形成慢性低水平炎症,最终导致肥胖和糖尿病等代谢综合征。杂粮谷物和豆类含有的膳食纤维和酚类物质对肠道菌群的影响主要在于促进肠道益生菌的增殖以及抑制肠道病原菌的增殖,同时增加SCFAs含量,SCFAs又能作为信号分子参与宿主代谢通路从而调节宿主生理状态,而果蔬富含的多酚类物质通过调节肠道菌群对高脂饮食引起的代谢综合征具有一定的缓解作用。作为日常膳食中来源最广泛的食物资源,杂粮、豆类和果蔬在保证足够的人体营养基础上,又可保证肠道菌群的“营养健康”,通过摄入这些膳食纤维和酚类含量丰富的食物,可以一定程度改善人体菌群失调以及代谢失衡,从而改善身体健康状态。目前,越来越多的研究表明膳食能够通过与肠道菌群的相互作用影响宿主健康,而不同的食物加工方式也可能会在一定程度上影响食物的理化性质,从而影响其菌群调节效应。此外,食物除了为机体提供能量和营养以外,到底在多大程度上通过调节肠道菌群影响宿主代谢状况,以及在食物-肠道菌群-代谢通路中到底存在着怎样的机制,尚需要更多深入的研究。

