热处理过程中大豆11S球蛋白解离缔合行为研究进展
曾剑华,杨 杨,刘琳琳,石彦国*,张 娜,朱秀清*
(哈尔滨商业大学食品工程学院,黑龙江省普通高校食品科学与工程重点实验室,黑龙江省谷物食品与综合加工重点实验室,黑龙江 哈尔滨 150076)
随着现代食品加工技术的发展,大豆蛋白在食品工业中的应用越来越广泛,如大豆蛋白因具有良好的凝胶性、持水性和与肉的结合能力,可将其添加到鱼制品或者肉制品中以改善其物理特性,或添加到面包等烘焙食品改善其质构、提高持水性;然而因其加工过度造成分散性差或存在豆腥味等性能缺陷,大豆蛋白在饮料等行业的开发应用存在一定的局限性[1-5]。
无论是现代还是传统食品加工,热处理都是大豆食品加工过程中必不可少的操作单元,能达到杀菌、钝化抗营养因子、诱导大豆蛋白变性提高消化率、软化大豆组织及获得理想的功能品质等目的[6]。热处理使大豆蛋白发生变性从而展现不同的性质,如凝胶性、起泡性、乳化性等,其加工程度直接影响大豆蛋白的功能特性[7-8],进而影响大豆食品的相关品质。在大豆蛋白变性过程中发生的主要反应就是蛋白亚基之间的解离缔合反应[9];而大豆11S球蛋白(简称11S)是大豆蛋白的重要组成成分,占其总质量的40%~60%[10],其在热处理过程中的解离缔合行为对大豆蛋白反应体系有着极其重要的影响。而大豆蛋白成分复杂,除了11S球蛋白外,还含有大豆7S球蛋白(简称7S)及乳清蛋白等。近年研究显示大豆蛋白在生产加工过程中还会形成脂蛋白(lipophilic protein,LP)[11];大豆蛋白复杂的成分对蛋白热处理过程中的解离缔合反应造成很大影响;因此研究不同组分及外界因素对11S球蛋白在热处理过程中的解离缔合反应对探索大豆蛋白热处理过程中的解离缔合作用有着极其重要的意义,对指导大豆食品研究开发具有重要的理论价值。
本文基于11S球蛋白热改性过程中蛋白质量浓度差异引起的体系性状变化,从离子强度、pH值、大豆7S球蛋白以及LP等方面对11S球蛋白的解离缔合行为的影响进行归纳综述,并分析了相应条件下11S球蛋白溶胶和凝胶解离缔合反应模型,以期从11S球蛋白的热解离缔合行为中探究大豆蛋白体系的热解离缔合反应规律,为大豆食品的研究开发与应用提供科学依据。
1 大豆11S球蛋白的组成和化学结构
大豆干基中蛋白质量约占40%,经过低温脱脂、碱提酸沉得到大豆分离蛋白(soy protein isolate,SPI)[12],其主要成分为大豆球蛋白(11S球蛋白)和伴大豆球蛋白(7S球蛋白),约占SPI质量的60~70%;据报道11S/7S值为0.5~2.4,该比值因品种差异存在较大差异[13],经差示扫描量热法(differential scanning calorimetry,DSC)分析SPI后,得到7S和11S热吸峰分别为72 ℃和90 ℃[6]。
11S球蛋白是六聚体,分子质量在300~380 kDa之间,由6 个分子质量约35 kDa的酸性肽链(acidic polypeptides,A)和6 个分子质量约20 kDa的碱性肽链(basic polypeptides,B)通过二硫键链接组成。Utsumi等[14]根据11S酸性肽链和碱性肽链的N-端氨基酸序列将11S球蛋白分为5 个基因序列:A1aB1b(也有表示A1aB2,G1)、A2B1a(G2)、A1bB2(也有表示A1bB1b,G3)、A5A4B3(G4)和A3B4(G5),根据它们的同源性分为两组:I组(G1、G2和G3)和II组(G4和G5),各组的序列同源性约为80%,组间约为50%,I组富含蛋氨酸且分子质量小于II组。
11S的基因表达显示其组成亚基为单一多肽前体,在内质网中共转录形成蛋白质前体并除去信号序列,得到的前原蛋白在内质网中组装成三聚体,前原蛋白三聚体从内质网转运到蛋白质储存液泡,然后在天冬酰胺和甘氨酸残基之间发生特定的翻译,并被切割形成酸性和碱性多肽,形成的多肽通过二硫键连接,成熟后组装成11S六聚体[15]。
Adachi等[16]使用X射线晶体学测定11S亚基前体A1aB1b的分子结构,发现前蛋白A1aB1b是由3 个前体粒子(9.5 nm×9.5 nm×4.0 nm)围绕三重对称轴形成的三聚体,且前体蛋白核心由两个果冻卷β链和两个延伸螺旋结构域组成(图1)。随后Adachi[16]、Tandang-Silvas[17]等研究了11S球蛋白A3B4和A1aB1b的三维结构,进一步揭示了11S三聚体如何组装成六聚体[16-17]。
Adachi等[16]从A1aB1b晶体结构中观察到11S球蛋白链间和链内存在二硫键,根据链间和链内二硫键的位置,三聚体中垂直于三重轴的两个面称为链间二硫化物(interchain disulfide-containing,IE)面和链内二硫化物(intrachain disulfide-containing,IA)面;而IE面比IA面具有更多的疏水性氨基酸残基,这表明六聚体是由IE面之间的相互作用形成的。在2.1 Å分辨率下测定11S球蛋白的A3B4同源六聚体晶体结构(图1),发现11S是由3 个前体(由A1~A3和B1~B3两两组成)组成的两个三聚体通过三重轴在IE面上堆积成六聚体,且具有32 点群(图1a);A3B4三聚体在IE面上具有74 个氨基酸残基(氨基酸残基252~325),这些氨基酸构成移动障碍区,同时IE面上存在可变的移动区并能抑制六聚体的形成,通过酶在Asn320和Gly321残基之间进行特定切割发生裂解后,无序区从IE面移动到表面,该过程将使IE面充分暴露于溶剂,同时去除空间位阻,使得两个三聚体组装形成六聚体,并最终储存在蛋白液泡中(图1b)[15,18]。也有研究认为AB亚基通过静电作用和氢键形成两个六圆环构成中空圆柱体[9]。
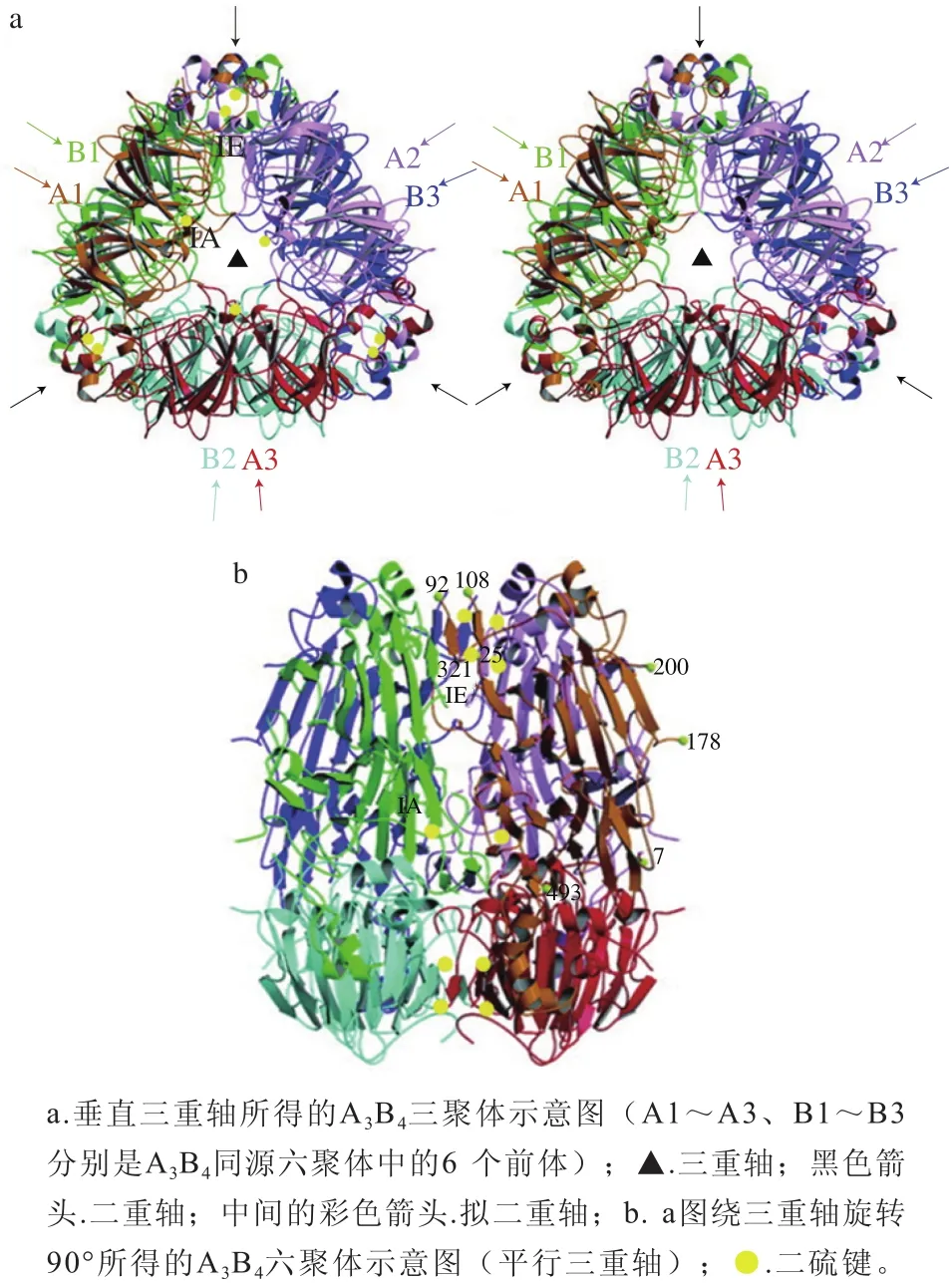
图1 大豆球蛋白AB同源六聚体球蛋白分子结构[16-17]34Fig. 1 Stereoviews of the ribbon diagram of glycinin A3B4 homohexamer[16-17]
2 热处理过程中11S球蛋白解离缔合行为
大豆蛋白的热变性是其加工应用的重要性质,热处理过程中含有游离巯基与二硫键的11S亚基发生共价键转换,同时伴随非共价键相互作用,如静电作用、疏水相互作用等导致蛋白结构重排、聚集变性等[19],从而生产不同品质特性的大豆产品。蛋白浓度对大豆蛋白的许多性质及其在食品的应用有着重要的影响,在处理过程中,不同浓度下的11S球蛋白具有不同的体系性状,蛋白质量分数低于5%时形成大豆蛋白溶胶体系,高于5%时形成大豆蛋白凝胶体系,其解离缔合行为也有所不同[20]。
2.1 11S球蛋白溶胶体系解离缔合行为
2.1.1 离子强度的影响
离子强度对11S溶液热解离缔合行为有很大的影响,在离子强度为0.5的磷酸盐缓冲液(phosphate buffered saline,PBS)中且温度低于70 ℃时,11S显示出良好的稳定性;当温度超过70 ℃时,体系开始变浑浊,且在90 ℃时出现沉淀;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)结果显示,在70~90 ℃时,11S亚基解离占主导,温度进一步升高引起11S球蛋白形成寡聚体(2S)、二聚体和多聚体(15S)[21]。在低离子强度条件下,11S解离温度为70 ℃,80 ℃时基本解离完全;高离子强度条件下,11S解离温度为90 ℃,到100 ℃解离完成。如在pH 7.6、离子强度为0.1和0.5的条件下,11S的DSC结果显示热变性温度分别为78.1 ℃和89.6 ℃[21];Lakemond等[22]利用DSC研究在pH 7.6、离子强度分别为0.03和0.5的条件下,11S热变性温度分别为78 ℃和94 ℃。离子强度从0增加至4时,11S球蛋白变性温提高了20 ℃,热稳定性增强,表明11S的热变性对离子强度很敏感;而在pH 7.0、离子强度分别为0.05与0.5条件下的变性温分别为55 ℃和70 ℃[23],与Lakemond等[22]的结果存在较大差异,可能是因为pH值条件不同。在70 ℃时,11S球蛋白解离为2S,随后解离为A亚基和B亚基,经微碱化处理(0.03 mol/L Tris-HCl、pH 8.6)或者在低离子强度下,11S球蛋白能很快解离成7S和2S组分[23-24]。
在pH 7.6和离子强度为0.5时,大豆球蛋白主要以六聚体形式存在,沉降系数为11S;当离子强度下降至0.01时,大豆球蛋白主要以三聚体形式存在;热处理能使11S转变成可溶性15S组分与4S组分,继续加热,15S组分粒径变大并且开始沉淀,添加0.01~0.50 mol/L的巯基乙醇能加速11S球蛋白产生沉淀。而添加0.01 mol/L N-乙基马来酰亚胺不仅能抑制11S产生沉淀,同时还形成了7S和3S聚集体;继续加热后,7S组分暴露出的游离巯基通过疏水相互作用或转化为巯基二硫键与B亚基作用生成沉淀,这个过程非常快,因而在热处理过程中没有检测到B亚基[25]。Yamagishi等[26]在离子强度为0.5的0.002 6 mol/L PBS(pH 7.6、含0.4 mol/L NaCl)中热处理质量分数0.5%的11S溶液1~60 min,上清液碱性亚基与酸性亚基比值(B/A值)逐渐下降,沉淀中B/A值逐渐增大;通过SDSPAGE可知,沉淀中含有的11S球蛋白亚基之间通过二硫键缔合形成高分子质量的组分,而上清液中含有的11S球蛋白亚基之间解离形成亚基单体、二聚体;超速沉降分析结果显示亚基单体组分为4S(A亚基),即上清液所有组分几乎只含A亚基,沉淀中主要为B亚基、A与B亚基的寡聚体和多聚体;由SDS-PAGE结果可知,寡聚体和多聚体里面含有的B亚基远多于A亚基,可能是在热处理过程中11S解离成A和B亚基时,由于溶液体系pH值(7.6)接近B亚基等电点,同时B亚基之间的距离比较近,更有利于巯基与二硫键发生转化,进而导致B亚基彼此缔合形成沉淀。因此大豆球蛋白溶液热解离缔合反应归纳见图2。

图2 不同离子强度下大豆11S球蛋白的热解离缔合行为Fig. 2 Dissociation and association of glycinin in different ionic strengths
离子强度对大豆11S球蛋白二级结构有重要的影响,Koshiyama等[21]通过傅里叶变换红外光谱与圆二色光谱(circular dichroism,CD)研究发现,在同一pH值条件下,11S无规卷曲含量随离子强度下降而增大,α-螺旋含量则随着离子强度的增大而增大,而β-折叠含量与离子强度无显著关系。在热处理过程中,11S疏水性随着离子强度的增大而增大,表明11S通过疏水键合作用形成稳定结构[27-28]。
2.1.2 pH值的影响
热处理过程中pH值变化对11S球蛋白溶液的解离缔合行为也有显著影响。Kim等[27]研究发现11S溶液体系pH值从4.5降至3,或升至11.5,其变性温度(Tm)和焓值(ΔH)均减小直至消失;当pH值从4.5升到9时,Tm和ΔH分别由99.5 ℃、15.9 J/g降至83.0 ℃、13.0 J/g,表明11S的热稳定性减弱。11S溶液经酸热处理(pH 2.5)或碱热处理(pH 8.5)后,其荧光光谱显示11S吸收峰向高波长移动且荧光强度降低,表明含色氨酸和酪氨酸的侧链基团均发生不同程度的暴露,热处理的最大红移波长为352~356 nm,且酸处理后疏水氨基酸暴露程度更高,致使11S球蛋白三级结构发生显著的变化;而碱热处理后11S的吸收峰强度增加,可能是热处理过程中11S缔合成多聚体导致散射程度增大引起的[29]。CD结果显示,酸处理后生成的β-折叠比碱处理生成的更多[30]。Jiang Jiang等[31]发现11S球蛋白经偏酸处理后,其溶解度显著低于碱处理后的溶解度,可能是酸处理导致11S球蛋白的结合程度高于碱处理;SDS-PAGE结果显示碱处理(pH 12)后的11S上清液中可溶性蛋白比酸处理(pH 1.5)后的含量高,同时随着热处理时间的延长,11S巯基含量升高,说明11S-AB不断解离成A和B亚基,然而凝胶电泳条带中A亚基含量减少,可能是A亚基单体之间S—S/—SH换转致使彼此缔合形成高聚物引起的。
2.1.3 7S球蛋白组分的影响
7S球蛋白与11S球蛋白之间的相互作用对11S溶液热解离缔合反应有重要的影响。在pH 7、100 ℃条件下加热30 min,SPI或11S+7S溶液均不会发生聚集,当温度超过90 ℃时,11S会因B亚基通过疏水相互作用交联在一起形成不溶性聚合物,而在SPI中没有出现不溶性聚合物,可能是11S和7S之间存在相互作用,形成了11S的稳定结构或者促进11S-B亚基溶解[32];Yamagishi等[33]发现一定浓度的7S球蛋白溶液单独加热不会产生沉淀,通过凝胶过滤、离子交换色谱和SDS-PAGE分析上清液和沉淀,结果显示7S和11S通过二硫键发生相互作用,并且在加热过程中B亚基和β亚基通过二硫键作用生成沉淀;而A亚基和α’、α亚基则通过二硫键作用主要分布在上清液。在蛋白质量分数为0.5%的等比例混合的11S和7S溶液中,Utsumi等[34]发现热处理后形成的大分子复合物中含有B亚基和β亚基,而热处理产生沉淀的条件取决于7S和11S的浓度,在低11S浓度条件下,7S能抑制11S产生沉淀。
11S球蛋白和7S球蛋白相互作用机理[35-36]归纳如下(图3):1)热处理初始阶段7S和11S解离成β、α’、α、A和B亚基;2)进一步加热使得解离后的亚基彼此发生相互作用形成可溶性聚合肽链;3)在高浓度蛋白条件下,通过二硫键作用形成的碱性聚合肽链与β聚合肽链在二硫键作用下形成沉淀,而酸性亚基A与α’、α亚基通过二硫键发生相互作用形成寡聚体和单体分布在上清液。

图3 热处理过程中大豆7S球蛋白与11S球蛋白相互作用[35-36]Fig. 3 Interaction between 7S and 11S during heating[35-36]
袁德保[37]、何秀婷[38-39]等研究发现,7S及其亚基对11S的热聚集有抑制作用,其亚基抑制作用能力如下:α’>α>7S>β;热诱导7S和11S混合溶液SDS-PAGE结果显示:A亚基大部分分布在上清液,而B亚基则分布在沉淀中,这与前人的研究[33-34]相符。7S球蛋白抑制能力与其添加量在一定范围内呈正相关,但当质量比达到一定值时,其抑制能力增大不明显,并且离子强度对7S及其亚基抑制11S聚集能力有影响,即离子强度越大抑制效果越差。
7S亚基抑制11S热聚集机理模型见图4。混合后7S亚基与B亚基因带异种电荷互相吸引,热处理过程中,7S亚基暴露的疏水性基团与B基团发生疏水相互作用形成复合物,复合物之间的静电排斥作用阻止聚集体进一步增大。α’、α、β与B亚基作用差别如下:热处理过程,与α’、α+B体系相比,β+B体系形成的疏水键更多,并且位于聚集体内部,使得热处理后β+B体系的表面疏水性比α’、α+B体系的疏水性要低,位于α’、α+B表面上的亲水性和带电基团能更大程度地抑制碱性多肽的聚集。

图4 7S亚基抑制11S热聚集机理模型[37-39]Fig. 4 Mechanism of the inhibitory effect of 7S subunits on the aggregation of 11S basic subunits[37-39]
郭健等[40-41]研究7S与11S聚集体的结构时发现,7S和11S聚合物的粒子大小随着加热温度的升高而增加,11S/7S聚合物的粒子大小随着7S含量的增加而降低;7S形成的聚合物的大小有限,11S形成表面疏松而内部结构致密的不溶性聚合物;SPI不溶性聚集体大小的增长被7S终止,具体过程见图5。

图5 7S-11S在pH 7.0热聚集行为示意图[40-42]Fig. 5 Diagrammatic depiction of 7S and 11S thermal aggregation behavior at pH 7.0[40-42]
7S与11S混合物热聚集行为机理简括如下,根据Andrews等[42]提出的lumry-eyring nucleated polymerization(LENP)模型,11S在热处理过程中经历了构象转变、预成核、成核、聚集和凝聚5 个阶段。聚集体之间疏水作用成为凝聚生长的主要动力,并且使得11S聚集体粒径不断增大,造成内部肽链快速塌陷内卷,增大了聚集体的密度,从而形成沉淀。在7S、11S混合物聚合过程中,7S与11S发生疏水作用形成稳定的复合物,降低了11S的聚集程度,使得11S变得可溶,即终止了SPI不溶性聚集体的增大。
2.1.4 大豆LP的影响
通过正己烷脱脂生产大豆蛋白并不能完全除去油脂,约有质量分数0.5%~1.0%脂质残留在脱脂大豆粉中。目前市售SPI油脂质量分数在0.2%~0.8%之间[12,43]。Samoto等[11]首先通过碱提酸沉分离出大豆LP;Matsumura[44]、Sirison[45]等研究不同蛋白组分溶解度时发现,在25 ℃时,LP溶解度不到20%,7S和11S的溶解度均高于80%,而天然SPI(nature-SPI,N-SPI)的溶解度只有40%左右,在90 ℃时,LP溶解度增大,N-SPI的溶解度也增大。为了探究LP在N-SPI溶解过程的作用,SDS-PAGE分析发现,常温下7S溶液或11S溶液的上清液中几乎没有膜蛋白,而在90 ℃时,则检测到少量膜蛋白,从而推测N-SPI溶解度低与LP的溶解度低有关。尽管N-SPI为非变性蛋白,但是LP不溶性组分较高,所以其N-SPI溶解度比市售SPI低。基于LP的溶解行为,Matsumura等[44]提出了LP的形成过程(图6):LP主要的膜蛋白是油体中的油质蛋白,由于脱脂用的正己烷不能有效地溶解极性脂质如磷脂,因此油质蛋白和磷脂留存在脱脂粉中。有研究认为油质蛋白-磷脂复合物(oleosin-phospholipids,OL-PL)可能通过疏水相互作用聚集在水中形成粗大的胶体颗粒,并且在分馏过程中部分OL-PL可能会与11S和7S形成不溶性大颗粒,从而降低大豆蛋白整体溶解度[45-46]。由此推测,LP在SPI的溶解过程中可能起关键性作用,因而有必要对LP组分的热力学和动力学进行研究,以揭示其在SPI热解离缔合行为过程的作用。
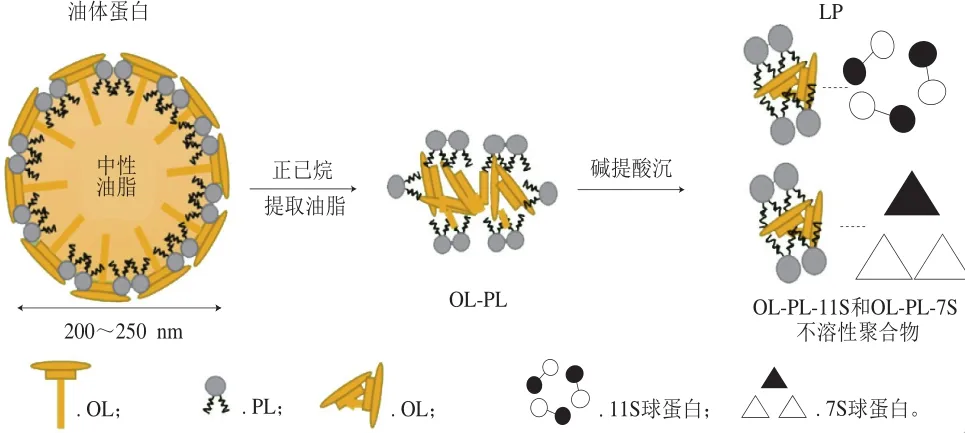
图6 大豆LP形成过程[44]Fig. 6 Formation of soybean lipophilic protein[44]
2.2 11S球蛋白凝胶体系解离缔合行为
一定浓度的11S球蛋白经热处理时会形成凝胶,凝胶性是大豆蛋白在食品工业应用的重要性质之一,利用凝胶特性可加工出不同的大豆产品[47]。
2.2.1 盐和pH值的影响
在100 ℃条件下加热处理离子强度0.5、pH 7.6、蛋白质量分数5%的11S溶液,通过蔗糖密度梯度离心和SDS-PAGE发现在15、30 s和60 s时分别形成了分子质量为1 800、4 000、8 000 kDa的可溶性聚集体[48];在11S质量分数较低(0.5%)时,进一步加热引起可溶性聚集体消失,并导致11S完全解离成A和B亚基;而11S质量分数为5%时,进一步加热形成高度聚合物,经透射电子显微镜确定为凝胶,推测可溶性聚集体是11S凝胶形成过程的主要中间产物[49]。在NaCl浓度为0.2 mol/L、11S质量分数为5%的条件下,随温度升高(40~80 ℃),11S储能模量急剧增大,表明凝胶化速率加快[50];通过动态光散射表征11S球蛋白热处理过程中缔合的聚集体结构,发现聚集体的结构与温度和蛋白质量浓度无关,但聚集体形成的大小与蛋白质量浓度呈正相关。凝胶形成不仅与蛋白浓度有关,还与二硫键有关。Chen Nannan等[51-52]研究发现盐诱导凝胶化是不可逆的过程,且聚集体随着盐浓度增大而增大,然而pH值几乎不影响凝胶化速度。热诱导和钙离子诱导11S形成的豆腐凝胶硬度比7S高,原因是11S凝胶中的二硫键含量比7S豆腐凝胶高[53]。Umeya等[54]研究发现二硫键对豆腐凝胶弹性和硬度有着重要的作用,表明游离巯基含量变化对11S形成凝胶的理化特性有重要的影响。
研究质量分数为0.5%、1%、2%、3%、4%、5%和10%的大豆球蛋白溶液的热变性现象时发现蛋白发生凝胶的最低质量分数为2%~3%;0.5%蛋白溶液经热处理后,SDS-PAGE结果显示其主要含有11S单体和二聚体,随着蛋白质量分数增大,单体和寡聚体含量减少,而聚合肽链含量增大;且沉淀中单体、寡聚体和聚合物的含量与蛋白质量分数没有依赖关系,而可溶性成分含量取决于蛋白质量分数,由此可推测,聚合物在11S凝胶化过程有着重要的作用[55]。
2.2.2 酸性肽链聚合物的影响
Yamagishi等[56]以胰蛋白酶选择性抑制或水解酸性亚基聚合物,研究酸性亚基聚合物对11S凝胶形成的作用时发现,当11S溶液中胰蛋白酶质量分数为10%时,热处理时间3 min,11S仍能形成凝胶,而持续6 min时,11S则不能凝胶化。通过CD等表征酶解后的11S构象,发现胰蛋白酶酶解6~10 min时,11S蛋白构象无显著改变,这表明酶解的11S球蛋白保持着天然构象;SDS-PAGE结果显示胰蛋白酶选择性水解A亚基,从而阻止了酸性亚基聚合物的形成,导致热诱导11S不能形成凝胶。一方面是由于含有游离巯基或二硫键酸性肽链的片段被胰蛋白酶水解,而致使其不能通过巯基-二硫键反应生成聚合物;另一方面是因为水解6 min离心后的沉淀物与低浓度条件下的天然11S性质相似;由此可知,酸性亚基聚合物对11S热凝胶化起着重要的作用[57]。
3 热处理过程中11S球蛋白解离缔合反应机理
热处理过程中11S球蛋白发生解离缔合反应,热处理初期蛋白分子结构展开,暴露出疏水核心,进一步加热,蛋白分子之间通过疏水相互作用发生缔合反应生成的溶胶为可溶性聚合物,当蛋白分子受热的温度达到变性温度时,蛋白分子以及可溶性溶胶通过疏水相互作用彼此聚集沉淀生成变性蛋白,变性蛋白在一定条件下通过二硫键交联形成凝胶网络,而后冷却产生的氢键桥接作用使得凝胶硬度变大,由此形成蛋白凝胶。
3.1 11S球蛋白溶胶体系解离缔合反应机理
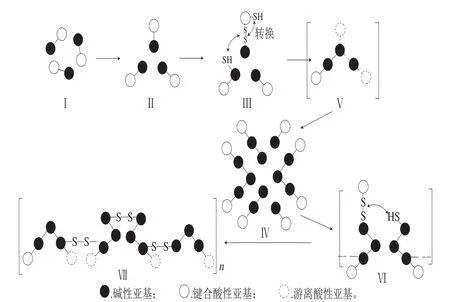
图7 大豆11S球蛋白溶胶体系解离缔合反应机理[58-61]Fig. 7 Dissociation-association mechanism of 11S sol system[58-61]
11S球蛋白分子质量为300~380 kDa,由图7可知,11S球蛋白是由12 条肽链组成的两个六元环[19](I);天然的11S球蛋白保持着刚性的球形构象,热处理后,11S构象展开使得A和B亚基暴露于PBS(pH 7.6)中,由于B亚基的等电点与溶液pH值最接近;因此碱性亚基之间的距离最近(II),使得碱性肽链之间可能发生巯基和二硫键交换(III)。由11S基本结构可知,每条肽链至少含一个游离巯基,B和A亚基通过二硫键键合在一起;在肽链聚合过程中游离巯基与二硫键之间的转换起着重要的作用,许多热改性的产品都基于亚基或者肽链之间游离巯基和二硫键的转换[58-61],主要包括亚基内的巯基与二硫键转换和亚基间的巯基与二硫键转换。亚基内的巯基与二硫键转换:A与B亚基之间的二硫键断裂,并且在酸性肽链或碱性肽链之间形成分子内二硫键;在这种条件下易形成酸性或碱性肽链单体(II→III);亚基间的巯基与二硫键转换:带有游离巯基的碱性肽链与亚基内的巯基与二硫键转换中生成的具有分子内二硫键的碱性亚基反应,在这种条件下热改性生成主要含有碱性亚基的聚合物(III→IV→VI→VII)。
在热处理初始阶段,11S球蛋白释放A亚基,形成可溶性中间产物(II→IV),这一假设是基于在上清液中B/A值与天然11S相似,释放出的A亚基增加了11S的疏水区域,11S球蛋白通过疏水作用进一步形成大分子中间产物(IV)。当构象展开后的II与11S分子反应则生成酸性肽链单体和包含碱性肽链的寡聚体。而当构象展开后的II与溶液中的可溶性大分子中间产物(IV)先反应,则生成主要包含碱性肽链的聚合物(VI),这一过程主要的反应是巯基-二硫键转换,并且热改性形成的分子质量大小与巯基-二硫键转换程度有关。
3.2 11S球蛋白凝胶体系解离缔合反应机理
Clark等[62]首先使用透射电子显微镜观察到丝束状为11S凝胶网络主要结构,从而提出了“串珠模型”,认为在热聚集过程中11S蛋白构象的展开以“珍珠”形状保持球形结构并串联在一起,Hermansson[63]在随后的研究中发现“珠”的大小与天然11S球蛋白粒子大小(11 nm×11 nm×7.5 nm)接近。Mori等[48]报道了11S经热处理后会产生沉淀,可溶性聚合物是这一反应的中间产物,通过蔗糖密度梯度离心和SDS-PAGE发现,在15、30 s和1 min内分别形成了分子质量为1 800、4 000、8 000 kDa的可溶性聚集体。
热处理过程中11S球蛋白构象转变机理如下(图8):1)0~15 s内形成由6 个11S分子构成的“串珠”I类型分子;2)“串珠”类型I分子彼此缔合形成“直链”类型II分子;3)“直链II”分子与相似的分子或与“串珠I”分子缔合形成“直链或直链”类型III分子;类型III分子即是11S凝胶的结构单元[64-66]。
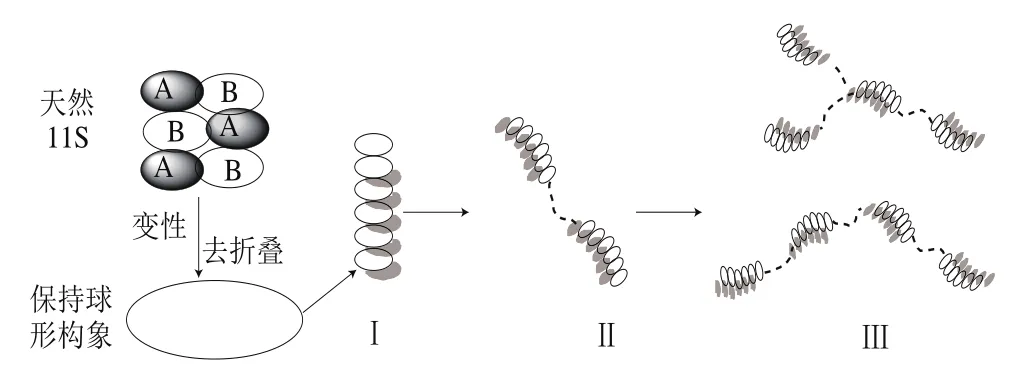
图8 大豆11S球蛋白凝胶化形成可溶性聚合物过程[64-66]Fig. 8 Schematic representation of the formation of soluble aggregates in the course of gelation of glycinin[64-66]
3.3 11S球蛋白亚基解离缔合反应机理
在热处理过程中,分子水平上11S亚基的解离缔合反应的具体机理还不是很明确,基于现有的研究成果、研究模型和相关理论(LENP模型),模拟分子水平提出11S热解离缔合反应机制如图9所示[67-69]。具体如下:1)天然状态11S的六聚体经热处理后释放出一个或多个肽链(分子I),释放肽链后形成分子II和III,导致天然11S疏水区增大导致疏水性增强;2)II和Ⅲ通过疏水相互作用彼此缔合在一起形成分子IV;3)5~6 个分子IV彼此通过二硫键缔合在一起形成分子V,且在II→V过程形成线性分子的作用力主要是疏水相互作用;4)当直链中含有15~20 个分子IV时,就可能发生巯基-二硫键转换,生成主要含有碱性肽链的聚合物,聚合过程还伴随着酸性肽链单体的释放;5)继续加热能导致基于分子V为基本单元的直链和直链聚合物的生成,支链聚合物的产生主要是11S球蛋白的酸性亚基和碱性亚基分子V发生巯基-二硫键反应造成;6)当加热到一定程度时,碱性肽链之间的聚集会加速,由于溶液pH值接近碱性亚基等电点,碱性肽链在一定浓度下会聚集产生沉淀,在高浓度下形成凝胶的基本结构;7)在高浓度和低浓度下A亚基的解离缔合行为差异,热处理后11S的酸性亚基释放主要分布在上清液,通过巯基-二硫键反应形成分子间二硫键使得聚合肽链键合在一起形成凝胶,并且在凝胶结构内保留更多的酸性亚基,而在沉淀中,则不发生巯基-二硫键反应。

图9 大豆11S球蛋白热解离缔合反应机理示意图[67-69]Fig. 9 Schematic representation of the mechanism of the dissociationassociation action of 11S[67-69]
虽然反应机理揭示了热处理过程中11S亚基解离缔合大部分反应行为,但还忽略了许多重要的影响因素,如蛋白质和水的相互作用也是形成凝胶过程的重要作用力,并且聚合酸性肽链在凝胶形成中的重要作用并未体现等。
4 结 语
大豆蛋白热解离-缔合反应是目前的一个研究热点。关于11S的热解离缔合行为的研究在国外已经进行了半个多世纪,而国内则晚了一二十年;然而目前国内外关于11S解离缔合反应机制的研究大多限于理想条件下的模拟研究,基本使用缓冲液体系,很少模拟实际生产过程体系条件,且在混合体系中,不同组分和加热条件对大豆球蛋白的解离缔合行为影响的规律及可逆反应控制范围还不明确,大豆蛋白在热处理解离缔合反应的表征鉴定指标也需要探索。大豆11S球蛋白是大豆蛋白主要成分之一,热处理可以改变大豆蛋白构象从而获得理想功能性质的蛋白,11S的热解离缔合行为一定程度上决定了大豆制品的后期加工特性、品质及其应用范围。因此掌握大豆11S球蛋白在不同组分混合体系和不同热处理条件下解离缔合行为的表征和可逆变化机制,有助于在大豆食品热加工过程中对其体系聚集行为进行适度控制,比如在豆乳粉中加工过程中实行可控热处理,可减少大豆蛋白不可逆聚集体的形成,从而改变不同批次豆粉二次回溶分散性差异的现状;同时大豆蛋白热处理中的解离缔合行为及机制的研究也为实现大豆蛋白相关食品加工的可控热处理技术提供理论依据。

