集束化疗法对PI3K/Akt/GSK3-β介导的心肺复苏兔心肌缺血/再灌注损伤的保护机制
张欣 刘凤艳 梁建庆 杜雪洋 胡蓉 王鑫
(甘肃中医药大学 1附属医院急诊科,甘肃 兰州 730000;2附属医院北院; 3基础医学院;4中医临床学院;5附属医院肿瘤科)
心搏骤停(CA)后综合征(PCAS) 的本质是缺血/再灌注损伤,可导致多数患者死亡或留下严重后遗症。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/糖原合成酶(GSK)-3β信号通路在PCAS中发挥着非常重要的保护作用〔1〕。本实验旨在构建兔心肺复苏(CPR)模型,研究集束化疗法对CPR后模型兔血流动力学指标及PI3K/Akt/GSK-3β蛋白表达的变化,验证PI3K/Akt/GSK-3β信号通路是否是黄芪注射液治疗PCAS的可能作用靶点,阐述该药可能的作用机制。
1 材料与方法
1.1药物和试剂 肝素(天津生化制药有限公司,6.25 kU/ml,批号H18030914);盐酸肾上腺素(上海禾丰制药有限公司,1 mg/ml,批号181108);黄芪注射液(正大青春宝药业有限公司,每支10 ml,相当于原药材20 g,批号1812062);戊巴比妥钠(上海中西药业股份有限公司,批号WS20180920);氨基甲酸乙酯(国药集团化学试剂有限公司,批号20180125)。抗PI3K抗体 (ab151549)、抗Akt抗体 (ab8805)、抗GSK3-β抗体(ab68476),购自ABCAM公司。
1.2仪器设备 DHX-300动物呼吸机、RM6240BD型多道生理信号采集处理系统、YP100型压力传感器、YPJ01型压力换能器(成都仪器厂);聚乙烯医用塑料心脏导管、动脉导管(成都泰盟科技有限公司,外径2.0 mm,内径1.5 mm);T形套管;家兔实验台;常用实验器械一套;肛温表;联想微型计算机;健源注射泵(JZB-1800);Biotek Synergy2多功能酶标仪(美国基因有限公司);高速冷冻离心机:Multifuge IS-R(德国THERMO公司)。
1.3动物模型制备及分组〔1〕日本大耳白兔24只,体质量2.0~2.5 kg,雌雄各半,动物合格证号:SYXK(甘)2015-0003,中国农业科学院兰州兽医研究所提供。实验兔随机分为假手术组、肾上腺素组、亚低温组及集束化治疗组,每组6只。25%乌拉坦溶液4 ml/kg麻醉动物(从兔耳缘静脉直接注射,必要时可追加药量)。无菌技术操作下切开气管,T形套管插入,然后分离暴露左侧颈总动脉、右侧颈静脉与左侧股动脉。经左颈总动脉插入心脏导管至左心室,连接RM6240BD型多道生理信号采集处理系统监测左心室血流动力学指标;左股动脉插入动脉导管,连接生理信号采集处理系统监测平均动脉压(MAP)。采用体外电击诱发心室纤颤(室颤)动物模型,50 V交流电持续放电30 s,以监护仪显示MAP<20 mmHg及出现室颤波,延续3 min表示动物模型制备成功。集束化治疗组术后立即开始CPR、胸外按压(按压频率200次/min,按压深度为兔胸廓前后径的1/3)与机械通气〔吸氧浓度(FiO2)1.00,通气频率45次/min,潮气量15 ml/kg〕同时进行,并经右颈静脉泵入肾上腺素30 μg/kg、黄芪注射液4 g/kg。复苏2 min后若仍为室颤则给予30 J单相波电除颤,之后持续胸外按压2 min,如仍为室颤再以同样能量电除颤,如此反复3次为1个周期。15 min后自主循环仍未恢复视为复苏失败。若出现室上性自主心律、MAP≥60 mmHg并持续5 min则表示自主循环恢复(ROSC),复苏成功。肾上腺素组仅给予肾上腺素注射液复苏。假手术组不进行体外电击致颤,不实施亚低温疗法,不静脉给予药物。亚低温组除不给予黄芪注射液外,其余处理同集束化治疗组。整个操作程序遵循Utstein动物模型复苏指南方案进行〔2〕。
1.4亚低温疗法的实施程序 见文献〔3〕。
1.5检测指标 复苏结束后检测左室舒张期末压(LVEDP)、左室内压上升/下降最大速率(±dp/dt max)、MAP及PI3K、Akt、GSK3-β蛋白。采用RM6240BD型多道生理信号采集处理系统于致颤前15 min和复苏后240 min检测LVEDP、±dp/dt max和MAP的数值。复苏后观察4 h,处死白兔,立即采集心肌组织,采用Western印迹法检测PI3K、Akt、GSK3-β蛋白表达,最终结果表示为目的条带与内参β-actin的比值。
1.6统计学处理 采用SPSS15.0统计软件进行t检验和方差分析。
2 结 果
2.1CPR前后4组血流动力学指标比较 致颤前4组血流动力学指标均无显著差异(均P>0.05)。复苏后,肾上腺素组、亚低温组及集束化治疗组LVEDP均比假手术组显著上升;集束化治疗组LVEDP显著低于肾上腺素组和亚低温组(均P<0.01);肾上腺素组、亚低温组和集束化治疗组±dp/dt max及MAP明显低于假手术组;集束化治疗组±dp/dt max及MAP显著高于肾上腺素组及亚低温组(均P<0.01)。见表1。
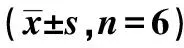
表1 CPR前后各组LVEDP、±dp/dt max、MAP比较
与假手术组相比:1)P<0.01;与肾上腺素组相比:2)P<0.01;与亚低温组相比:3)P<0.01;表2同
2.2各组CPR后PI3K、Akt、GSK3-β水平比较 复苏后,肾上腺素组、亚低温组和集束化治疗组PI3K、Akt、GSK3-β水平显著低于假手术组;集束化治疗组PI3K、Akt、GSK3-β水平明显高于肾上腺素组和亚低温组(均P<0.01)。见表2和图1。
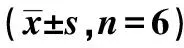
表2 CPR后240 min各组PI3K、Akt、GSK3-β表达比较
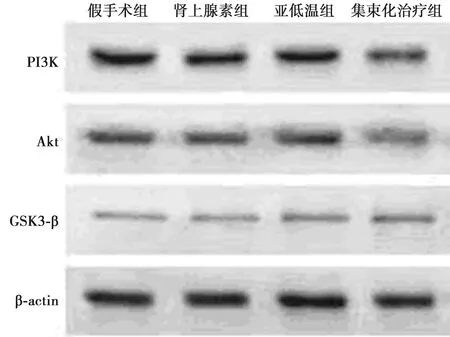
图1 Western 印迹检测各组心肌细胞PI3K、Akt、GSK3-β表达
3 讨 论
PCAS是指CA后经过有效抢救,虽然达到ROSC,但由于患者CA,发生了心肌缺血,心脏恢复自主循环,进行了心肌缺血再灌注,发生了缺血/再灌注损伤,这就是PCAS 的病理生理学本质,可导致多数患者留下严重后遗症或死亡〔4〕。
肾上腺素是目前临床公认的治疗PCAS的“金标准”药物,使用肾上腺素来挽救CA患者,已有50余年历史。肾上腺素可以提高ROSC率,但无法改善患者出院存活率。肾上腺素用于CA患者,不仅没有改善PCAS的病理及生理过程,而且与ROSC呈负相关关系,降低了PCAS患者短期存活率或远期存活率〔5〕。临床医生以物理方法将病人体温降低到预期水平来治疗疾病的方法称之为亚低温疗法,或者叫目标性体温管理。目前医学界将轻中度低温(28~35℃)称为亚低温。研究指出,亚低温治疗可有效抑制机体炎性反应、减慢机体新陈代谢及增强机体对缺氧的耐受能力,患者ROSC后及早采取亚低温治疗可改善CA患者脑功能及提高出院存活率〔6〕。亚低温疗法治疗PCAS具有巨大的潜力。单纯的黄芪注射液或黄芪的有效成分黄芪多糖、黄芪皂苷等均具有一定的改善心血管作用。黄芪注射液对心肌缺血有显著疗效,其机制与降低冠状血管阻力,增加冠状血流量,改善心肌供血,降低心肌耗氧量有关〔7〕。
心力衰竭大鼠腹腔注射黄芪注射液,然后测定大鼠的血流动力学指标,发现大鼠的血流动力学指标(LVEDP、±dp/dt max、MAP)明显改善〔8〕。临床报道,PI3K/Akt/GSK-3β 信号通路对鼠大脑缺血/再灌注损伤有修复作用〔4,5〕,可起到神经保护作用,抑制脑损伤面积扩大〔6〕。当心肌缺血/再灌注损伤时,机体内部分激酶被活化而发挥保护作用,称之为再灌注损伤挽救激酶(RISK),其中PI3K是最重要的一种。PI3K蛋白是一种可催化磷脂酰肌醇D-3位磷酸化的脂类激酶,最早作为一种病毒癌基因产物被发现,由起催化作用的p110 亚基和起调节作用的亚基p85构成Akt作为PI3K信号通路上的重要激酶,其激活抑制了下游GSK-3β活性,而磷酸化GSK-3β又能直接与线粒体通透性转换孔(mPTP)亚单位ANT结合,提高mPTP开放阈值,阻止mPTP开放而发挥抑制凋亡效果〔7〕。GSK-3β目前属于保守丝氨酸/苏氨酸激酶家族。多种药物可以激活PI3K/Akt通路发挥抗缺血/再灌注损伤的作用,而GSK-3β是PI3K/Akt通路的作用底物,属于Akt下游因子,激活的PI3K/Akt可促进GSK-3β磷酸化〔8,9〕。
集束化治疗方法对PCAS兔心肌有一定的保护作用,其药理作用机制与改善兔血流动力学指标的表达有关〔10〕。杨述亮等〔11〕报道,PI3K/Akt信号通路可通过调控下游的多种效应分子,从而对器官的缺血/再灌注损伤发挥保护作用,其中GSK-3β是主要效应分子。该通路在心肌细胞缺血/缺氧培养、心肌缺血/再灌注损伤及离体心脏心肌缺血/再灌注损伤中的保护作用已经得到验证。集束化治疗方案可明显改善兔心功能,优化血流动力学,调节PI3K/Akt/GSK-3β信号通路的活性发挥抑制心肌缺血/再灌注损伤的作用,PI3K/Akt/GSK-3β信号通路可能会成为治疗PCAS的新靶点。

