灯盏乙素调节ATP敏感性钾通道对抗β-淀粉样蛋白的毒性作用
王宁慧 伍棋 于燕妮 郭莉莉
(1贵州医科大学,贵州 贵阳 550004;2贵阳市第一人民医院)
阿尔茨海默病(AD)的病理机制与β-淀粉样蛋白(Aβ)的多个神经毒性机制密切相关,这些毒性机制之间相互影响,互为调节,形成一个复杂的多因素循环作用,贯穿在整个疾病进程中。Aβ作为疾病致病分子的认识多年来得到公认,虽然针对Aβ设计的靶向临床药物并未取得治疗上的突破,然而研究者们却得到了在治疗上应针对Aβ毒性而非单纯针对Aβ本身的重大提示〔1,2〕。致力于多个靶点的毒性对抗,降低Aβ神经毒性以期延缓AD进程,仍然是AD的主要治疗策略之一。课题组利用同位素标记相对和绝对定量(iTRAQ)技术获取了AD双转基因动物脑组织中Aβ毒性相关的差异蛋白点,同时观察到灯盏乙素(Scu)主要调节了其中12个差异靶蛋白点的疗效,包括ATP敏感性钾通道(KATP)蛋白〔3〕。分化成熟的人源性神经母细胞瘤(SH-SY5Y)细胞具有神经元的形态和特性,并表达神经元特异性标志物,往往被用来制作神经系统疾病的细胞模型〔4〕,本实验利用该细胞株制作Aβ毒性诱导的反映AD病程的细胞模型,进一步验证并探讨Scu介导KATP路径对抗Aβ神经毒性的疗效及作用机制。
1 材料与方法
1.1实验药物及细胞 实验Scu为浅棕色粉末(批号:ZL20161012037,纯度98%),由南京泽朗生物医药科技公司提供;Aβ1~42寡聚体购自Sigma公司(编号:A9810);二氮嗪(DZ)购自Sigma公司(编号:D9035);SH-SY5Y细胞购自中国科学院昆明细胞生物研究所(编号:KCB2006107YJ)。
1.2主要试剂与仪器 CCK8试剂购自同仁公司(日本);多克隆兔抗Kir6.1购自GenTex公司(美国);多克隆兔抗Kir6.2、SUR1、SUR2购自Abcam公司(美国);β-actin抗体购自CST公司(美国);Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;DiBAC4(3)荧光探针购自北京索莱宝科技有限公司;线粒体膜电位检测试剂盒(JC-1)和ATP检测试剂盒购自碧云天生物技术公司。多功能酶标仪(美国Thermo Fisher公司);流式细胞仪(美国Beckman Couler公司);蛋白质凝胶成像系统(美国Bio-Rad公司)。
1.3方法
1.3.1药物制备 Aβ1~42用六氟异丙醇(HFIP)进行充分溶解并分装,通风橱过夜风干,-80℃保存待用,使用前加二甲基亚砜(DMSO)溶解, 用不含酚红的DMEM/F12细胞培养液稀释成每管10 μmol/L,4 ℃冰箱放置24 h,离心后取上清使用〔5〕;Scu和DZ 在使用前精确称量分装,再用DMEM细胞培养液充分稀释,0.22 μm微孔注射滤器过滤后使用。
1.3.2细胞培养及分组处理 SH-SY5Y细胞培养,培养液为DMEM高糖培养基,添加12%胎牛血清,1%双抗,培养箱条件为37℃、5% CO2,将细胞转入细胞培养板中,分为对照组、Scu处理组、Aβ处理组、Scu+Aβ处理组、DZ+Aβ处理组。对照组不加药物处理;Scu处理组加入Scu(10 μmol/L)培养48 h;Aβ处理组加入Aβ1~42(1 μmol/L)培养24 h;Scu+Aβ处理组、DZ+Aβ处理组分别加入Scu(10 μmol/L)、DZ培养24 h,再加入Aβ1~42(1 μmol/L)培养24 h。
1.3.3CCK-8法筛选药物浓度 将细胞以1×105个/ml的密度接种于96孔板,每孔100 μl,单加磷酸盐缓冲液(PBS)作为阴性对照,细胞贴壁后进行不同浓度DZ(0、100、200、250、500、1 000、2 000 μmol/L)的加药处理,继续培养48 h后加入CCK-8试剂,CCK-8试剂用DMEM细胞培养液以1∶10 的比例稀释后,每孔100 μl均匀加入,放置培养箱孵3 h后用多功能酶标仪测定450 nm处OD值,根据公式存活率=(实验组-空白组)/(对照组-空白组)计算各组细胞存活率。Aβ及Scu的浓度同之前的检测方法和结果〔6〕。
1.3.4生物化学方法检测各组ATP含量 将细胞接种于6孔板中,24 h贴壁后进行分组处理。各组细胞分别加入200 μl/孔的裂解液裂解细胞,4℃ 12 000 r/min离心5 min,取上清待用。将100 μl/孔 ATP检测工作液加入96孔板中,室温放置3~5 min,再加入上述上清或标准品,多功能酶标仪(化学发光)检测,根据标准曲线计算样品中ATP含量。
1.3.5Western印迹检测各组细胞KATP通道亚基内向整流钾通道(Kir)6.1、Kir6.2、磺酰脲受体(SUR)1、SUR2的蛋白表达水平 收集各组细胞,加入蛋白裂解液,4℃裂解1 h,4 ℃ 12 000 r/min离心20 min,取上清并进行BCA蛋白定量,聚丙烯酰胺凝胶电泳后转于PVDF膜上,各指标一抗和二抗孵育后曝光显影。以β-actin蛋白作为内参照,用ImageJ 软件对图像进行灰度分析,结果以各指标条带与β-actin条带灰度的比值作为各指标蛋白的相对表达量。
1.3.6DiBAC4(3)荧光探针法检测各组细胞细胞膜电位 将细胞以1×105个/ml的密度接种于96孔板中,24 h细胞贴壁后进行分组处理后分别加入180 μl的5 μmol/L DiBAC4(3)的检测用缓冲液,在5%CO2,37℃培养箱中孵育30 min,孵育结束后再加入20 μl的5 μmol/L DiBAC4(3)的检测用缓冲液,用多功能酶标仪(激发光488 nm,发射光517 nm,孵育温度37℃)观察各组细胞的荧光强度变化。
1.3.7JC-1荧光探针法检测各组细胞线粒体膜电位 将细胞以1×105个/ml的密度接种于96孔板中,24 h细胞贴壁后进行分组处理。各组细胞分别加入50 μl/孔细胞培养液和50 μl/孔JC-1染色工作液,充分混匀,细胞培养箱37℃孵育20 min,孵育结束后吸除上清,用JC-1染色缓冲液洗涤2次,最后加入100 μl/孔细胞培养液,多功能酶标仪检测JC-1聚合体(激发光525 nm,发射光590 nm)和JC-1单体(激发光490 nm,发射光530 nm)荧光值,线粒体膜电位用JC-1单体荧光值/JC-1聚合体荧光值作为相对比值进行计算统计。
1.3.8流式细胞仪检测各组细胞凋亡率 将细胞接种于6孔板中,24 h贴壁后进行分组处理。用不含EDTA的胰酶(200 μl/孔)消化收集细胞,PBS洗涤细胞两次后,用500 μl上样缓冲液悬浮细胞,再依次加入5 μl Annexin V-FITC和5 μl碘化丙啶混匀,室温避光放置15 min,在1 h内采用流式细胞仪进行凋亡检测,利用Flow-Jo流式分析软件,计算细胞总凋亡率。
1.4统计学方法 采用SPSS21.0 软件进行单因素方差分析和秩和检验。
2 结 果
2.1不同浓度DZ对SH-SY5Y细胞增殖活性的影响 浓度为0、100、200、500、1 000、2 000 μmol/L的DZ作用于SH-SY5Y细胞48 h后的细胞存活率分别为(100.00±0.00)%、(103.47±8.16)%、(92.36±3.38)%、(65.32±3.75)%、(48.81±4.26)%、(30.31±5.54)%。0~200 μmol/L DZ作用于细胞48 h后细胞增殖活性无明显变化,500~2 000 μmol/L作用后细胞的增殖活性呈不同程度的下降,毒性作用呈剂量-效应关系,差异有统计学意义(P<0.01),选择200 μmol/L作为DZ实验用浓度。
2.2各组细胞ATP含量 与对照组〔(9.57±0.62)nmol/mg〕和Scu处理组〔(9.86±1.18)nmol/mg〕相比,Aβ处理组〔(6.84±0.68)nmol/mg〕ATP含量明显降低,差异有统计学意义(P<0.01);Scu干预后〔Scu+Aβ处理组(8.78±0.73)nmol/mg〕,ATP含量有所升高,差异有统计学意义(P<0.05);DZ干预后〔DZ+Aβ处理组(7.22±0.30)nmol/mg〕,ATP含量也有所升高,但差异无统计学意义(P>0.05)。
2.3Kir6.1、Kir6.2、SUR1、SUR2的蛋白表达 与对照组和Scu处理组相比,Aβ处理组Kir6.1、SUR2的蛋白表达上调,差异有统计学意义(P<0.01),Kir6.2、SUR1的表达无明显变化;Scu干预后,Kir6.1、SUR2的蛋白表达下调,差异有统计学意义(P<0.01),未见Kir6.2、SUR1的表达变化。DZ+Aβ处理组的表现与Scu+Aβ处理组基本一致。见表1,图1。
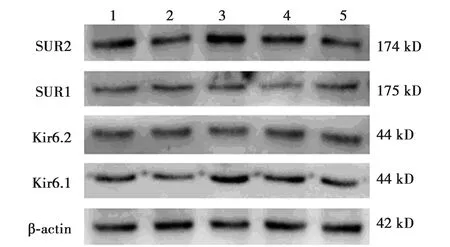
1~5:对照组;Scu处理组;Aβ处理组;Scu+Aβ处理组;DZ+Aβ处理组图1 各组细胞中Kir6.1、Kir6.2、SUR1、SUR2蛋白表达水平

组别Kir6.1Kir6.2SUR1SUR2对照组0.65±0.060.86±0.060.53±0.060.68±0.05Scu 处理组0.64±0.140.86±0.160.54±0.090.66±0.12Aβ处理组1.09±0.231)0.84±0.060.55±0.031.02±0.081)Scu+Aβ处理组0.74±0.122)0.88±0.140.56±0.050.76±0.072)DZ+Aβ处理组0.67±0.162)0.85±0.120.57±0.050.77±0.102)
与对照组比较:1)P<0.01;与Aβ处理组比较:2)P<0.01
2.4各组细胞细胞膜电位变化 与对照组(6.86±0.05)和Scu处理组(6.79±0.05)相比,Aβ处理组(7.38±0.14)的荧光值有所升高,差异有统计学意义(P<0.05),表示细胞膜膜电位升高,呈现去极化现象;而与Aβ处理相比,Scu+Aβ处理组(6.86±0.20)的荧光值趋向于正常,但差异有统计学意义(P<0.05),表示膜电位的去极化现象有所改善。DZ+Aβ处理组(6.90±0.33)的表现与Scu+Aβ处理组基本一致。
2.5各组细胞线粒体膜电位变化 与对照组(1.03±0.07)和Scu处理组(1.03±0.04)相比,Aβ处理组(1.43±0.02)的荧光值有所升高,但差异仍有统计学意义(P<0.01),表示细胞膜膜电位升高,呈现去极化现象;而与Aβ处理相比,Scu+Aβ处理组(1.23±0.05)的荧光值趋向于正常,但差异仍有统计学意义(P<0.01),表示膜电位的去极化现象有所改善。DZ+Aβ处理组(1.22±0.04)的表现与Scu+Aβ处理组基本一致。
2.6各组细胞总凋亡率 与对照组(4.18%±0.63%)和Scu处理组(4.25%±0.42%)相比,Aβ处理组(17.58%±0.48%)细胞总凋亡率明显增加,差异有统计学意义(P<0.01);Scu干预后,细胞总凋亡率(11.23%±0.84%)明显下降,差异有统计学意义(P<0.01)。DZ+Aβ处理组(9.67%±1.03%)的表现与Scu+Aβ处理组基本一致。
3 讨 论
KATP是一种与细胞能量代谢密切相关的配体门控钾通道,受腺苷酸的调节直接将细胞的代谢状态与电活动相耦联,在神经系统中起神经元保护作用〔7〕。细胞内ATP是KATP通道的主要调节剂,通道的开闭直接受其调控,正常细胞胞质内ATP浓度约为10 nmol/mg蛋白,此时KATP处于稳定状态,当细胞受到内外环境刺激时,胞质内ATP浓度发生适应性下降,触发KATP开放。细胞膜上的KATP开放时,K+外流,细胞膜超极化,抑制细胞膜上电压依赖性离子通道的开放,比如抑制电压依赖性钙离子通道,可减少钙内流,减少细胞内钙超载诱发的凋亡,同时也能减少动作电位的发生,减少能量消耗;线粒体膜上的KATP开放时,线粒体膜超极化,可维持线粒体膜电位,稳定线粒体体功能,抑制线粒体通透性转换孔(MPTP)的开放,减少氧自由基和凋亡启动因子释放,进而减少氧化应激损伤和凋亡发生〔8〕。我们在实验中发现,Aβ的毒性刺激使细胞内ATP的浓度明显下降,细胞膜和线粒体膜电位呈现去极化改变,表明Aβ刺激了ATP调节下的KATP开放,神经元细胞发生保护性自主调节的生物学行为,然而,细胞凋亡率的增加,代表这种适应性反应远不足以抵消Aβ造成的细胞损伤。
KATP主要分布在神经元、胰腺β细胞、骨骼肌细胞及平滑肌细胞的细胞膜和线粒体膜表面,由4种Kir和4种SUR组成,Kir家族形成通道孔,Kir6为ATP敏感,目前确定的有Kir6.1和Kir6.2两种亚基,SUR为ATP结合蛋白的“超家族”,构成通道调控元件,包括SUR1和SUR2两种亚基。研究发现,KATP通道亚基在脑内广泛表达(包括在与认知能力密切相关的海马区域,海马区主要以Kir6亚基表达为主)〔9〕,我们同样观察到实验用神经元细胞中均呈现出Kir6.1、Kir6.2、SUR1和SUR2的蛋白表达,且Aβ的处理引起了Kir6.1和SUR2的蛋白表达上调,对Kir6.2和SUR1的蛋白表达并无影响,代表Aβ触发的KATP通道开放选择性作用于Kir6.1/SUR2亚基。与此同时,我们观察到在Scu干预后,Aβ刺激下细胞内ATP的浓度水平与细胞膜和线粒体膜电位的变化趋向于正常,Kir6.1和SUR2的蛋白表达下调,细胞总凋亡率明显下降,显示出Scu可能通过调节KATP通道蛋白Kir6.1/SUR2亚基的表达,或者是降低KATP通道对细胞内ATP的敏感性而激活了通道开放,在Aβ的毒性影响下发挥神经元保护作用。
KATP通道现已成为包括神经变性性疾病在内的多种疾病的治疗靶点,多种KATP通道开放剂(KCOs)被应用于临床并取得较好疗效,不同类型的KCOs通过不同方式选择性作用于KATP通道蛋白〔10〕。二氮嗪(DZ)作为KCOs的一种类型被证实可以用来延缓Aβ毒性导致的细胞损伤〔11〕,有研究显示其可激活心肌细胞膜上的Kir6.1/SUR2亚型KATP通道来介导对心肌缺血再灌注损伤的保护,实验中DZ对ATP浓度的影响无统计学意义,可能与其主要是增加细胞内二磷酸腺苷(ADP)的浓度有关。我们观察到Scu发挥了与DZ基本相一致的作用,提示Scu存在作为KCOs应用来降低Aβ毒性的可能。
课题组在同期实验中观察到,Scu能够通过干预APP代谢的β分泌酶途径来抑制Aβ的生成〔12〕;能够通过对IP3R-Ca2+途径的调控和介导MPTP的开放来抑制Aβ毒性所致的细胞凋亡〔13〕;能够调节Aβ毒性所致神经元中组蛋白H2A、H2B、H3的表达,通过改变AD表观遗传的信息异常来发挥预防和治疗作用〔14〕等。综上所述,我们推测其还可能通过调控ATP介导的KATP通道开放来抑制Aβ毒性所致的细胞凋亡,从而发挥神经元保护作用,本实验为药物针对Aβ毒性在AD治疗中产生积极影响提供了新的实验依据。

