连续缝合端侧吻合技术建立大鼠腹腔异位心脏移植模型的研究*
肖宗宇,汪 继
(1.青海大学附属医院神经外科,西宁 810001;2.南方医科大学研究生院,广州 510000; 3.解放军总医院第七医学中心,北京 100700)
随着显微外科技术的不断成熟,显微镜下血管、神经等吻合技术变得越来越成熟。早在1969年,Ono建立了经典的大鼠腹腔异位心脏移植模型,该模型是将供心作为一个会搏动的器官,以观察其冠状动脉循环途径及免疫排斥反应而建立的显微外科手术模型[1-2]。本研究对经典Ono术式进行改良,在SD大鼠左锁骨下动脉以远5 mm处切断胸主动脉,并分离左肺动脉,将SD大鼠的胸主动脉、左肺动脉分别与Wistar大鼠的腹主动脉、下腔静脉进行连续缝合端侧吻合,成功建立了SD-Wistar大鼠异位腹腔心脏移植模型,现报道如下。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级SD及Wistar雄性大鼠各50只,体质量200~250 g,购自北京华阜康生物科技股份有限公司。
1.1.2手术器械 Zeiss手术显微镜一台(型号为OPMI Pico),无损伤钝头冲洗针头一个(4#),无损伤血管夹4个,显微外科手术器械1套,常规手术器械若干,10-0无损伤缝合线若干(上海医疗器械厂)。
1.2方法 实验动物术前12 h禁食,但不禁水。采用1%戊巴比妥钠,按50 mg/kg进行腹腔注射麻醉,麻醉起效后,胸腹部皮肤备皮,取仰卧位,用2.5%的碘伏和75%的乙醇消毒,取腹部正中切口。
1.2.1供心的摘取 取供体SD大鼠,以湿的生理盐水纱布包裹肠管,并将其推向右侧,用1 mL注射器经下腔静脉缓慢注射125 U/mL肝素钠盐水1 mL,进行全身肝素化后打开胸腔,并迅速向胸腔内放置大量冰屑促使心脏停跳,结扎并切断上下腔静脉、双侧肺静脉及主动脉弓的3个分支(头臂干、左颈总动脉及左锁骨下动脉),在左锁骨下动脉以远5 mm处切断胸主动脉;结扎右肺动脉,保留左肺动脉作为供心静脉系统。游离并取下供心,以4 ℃肝素生理盐水对供心进行灌洗,直至供心质地变软,颜色变为灰白色,置4 ℃冰盐水中保存备用。
1.2.2受体手术 取受体Wistar大鼠,充分游离腹主动脉及下腔静脉,选择左肾动脉远心端约5 mm附近的腹主动脉及下腔静脉作为吻合口部位。首先进行供体主动脉与受体腹主动脉之间的端侧吻合,进行临时阻断后,用显微镊轻轻提起腹主动脉壁,用弯显微剪在受体腹主动脉前壁形成一与供心胸主动脉大小一致的椭圆形切口,采用10-0无损伤缝线先进行对角缝合、打结后并预留缝线,然后采用连续缝合的方式对前壁进行缝合,前壁缝合完毕后与尾侧预留缝线进行打结,随后将供心翻转,显露血管后壁,以同样的连续缝合方式进行缝合。然后再阻断受体下腔静脉,选择平齐于腹主动脉吻合口的稍远心端做端侧吻合部位,按上述方法进行供心左肺动脉与受体下腔静脉的吻合。腹主动脉与供心主动脉吻合的边距为血管壁厚度的1~2倍,针距为边距的2倍,下腔静脉吻合时,边距可为血管壁的3~4倍,而针距仍为边距的2倍,平均1 mm缝合3~5针。在缝合最后一针打结前,向管腔内冲洗肝素生理盐水以排气。吻合完毕后,首先开放下腔静脉远心端血管夹,再开放近心端,然后开放受体远心端腹主动脉,最后开放腹主动脉近心端。随着供心的血流恢复,供心色泽变得红润,开始出现心肌颤动,恢复血流后1~2 min内供心可恢复规律心跳(图1)。术毕,常规予以静脉及腹腔补液,通过鼠尾静脉注射的方式补充0.9%生理盐水2~3 mL,补液量一般不超过2 mL/100 g,腹腔补液5 mL[3]。术后均连续3 d肌内注射青霉素4 000 U/d。术后未予以抗免疫排斥药物,每日进行腹部触诊以观察供心搏动情况,并于术后1周开腹观察供心情况。
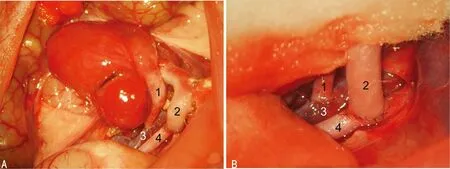
A:大鼠异位心脏移植,供体胸主动脉与受体腹主动脉吻合,供体肺动脉与受体下腔静脉吻合;B:局部吻合口放大观。1为供体肺动脉,2为供体主动脉,3为受体下腔静脉,4为受体腹主动脉
图1 SD大鼠腹腔异位心脏移植
2 结 果
在本实验中,每例SD-Wistar心脏移植模型总手术时间(60±10)min,其中供心切取时间(10±3)min,受体腹主动脉及下腔静脉游离时间(4±2)min,血管吻合(12±5)min,供心主动脉与受体腹主动脉端侧吻合时间(5±2)min,供心肺动脉与受体下腔静脉吻合时间(7±4)min,供心的总缺血时间(30±5)min。腹主动脉平均缝合(15±4)针,下腔静脉平均缝合(12±3)针。在吻合口血流开放时,大部分大鼠均存在不同程度的吻合口渗血,下腔静脉渗血较少,多以腹主动脉吻合口失血为主,失血量约0.2~0.5 mL,其中有6只大鼠发生出血较多,量约1 mL,均经局部采用明胶海绵压迫后彻底止血。
本组共进行SD-Wistar腹腔异位心脏移植模型50例,术中及术后无大鼠死亡,大鼠术后1~2 h可苏醒,术后可恢复正常饮食,精神可,行走自如,无截瘫、肢体活动障碍、尿潴留等并发症。所有供心术中吻合血管通畅情况良好,均于术后即刻复跳,每日腹部触诊,移植心收缩有力,每日心率无显著变化,平均心率约每分钟(240±30)次。48例供心均于术后1周仍存在规律心跳,心搏有力,冠状动脉清晰可见,吻合口通畅,局部无血栓及出血表现,供心与周围组织无明显粘连(图2A)。另有2例供心在术后第3天出现搏动减弱,心率逐渐减慢,于第5天出现供心停跳,术后1周开腹观察,发现供心血管无扭转,但供心肿大明显,质地略硬,与周围组织粘连严重,供心表面未见明确冠状动脉(图2B),剖开供心后发现内含大量血栓。本组共进行50例SD-Wistar大鼠心脏移植模型,术中血管吻合成功率达100%,但术中2例发生心跳停止,本组模型成功率达96.00%。

A:供心存活良好,表面光滑,与周围组织无明显粘连,冠状动脉清晰可见;B:供心停搏,体积明显增加,供心表面未见明确冠状动脉,与周围组织粘连严重
图2腹部异位心脏移植术后1周
3 讨 论
大鼠心脏移植模型是将移植心作为一个可搏动的异体组织,以观察其冠状动脉循环途径及免疫排斥反应而进行的,供心循环途径为:受体供血动脉-供心升主动脉-冠状动脉-心肌-冠状静脉-右心房-右心室-供心肺动脉-受体静脉,左心不参与循环,无射血功能[1,2,4]。最早由ABBOTT进行大鼠腹腔心脏移植模型的建立,他分别将供心的主动脉、肺动脉与受体的腹主动脉、下腔静脉进行端端吻合,成功建立了大鼠腹腔异位心脏移植模型,但由于该模型完全阻断了腹主动脉及下腔静脉,导致下半身血供障碍,容易发生下肢瘫痪和尿潴留等并发症,死亡率亦较高[5]。1969年,Ono等对该术式进行改良,分别将供心主动脉、肺动脉与受体腹主动脉、下腔静脉进行端侧吻合,显著提高了心脏移植模型的成功率[1,6]。
目前,颈部和腹部是应用较多的大鼠异位心脏移植部位[7-8]。颈部异位心脏移植技术时,分别将供心主动脉、肺动脉与受体颈总动脉及颈外静脉进行吻合[9]。但由于颈部抗感染能力差,局部容易形成积液;且颈部空间较狭小,可能对供心造成压迫,血管扭转、血栓形成概率均显著增加,从而导致供心血流障碍,模型失败[10]。而腹腔异位心脏模型具备较多优点:(1)腹主动脉、下腔静脉管径较粗,显微吻合技术要求略低,且腹主动脉血流量较大,血栓形成概率相对较低,模型成功率高。(2)腹腔空间大,对供心不易造成压迫。(3)腹腔存在大网膜等组织,吸收能力及抗感染能力均较强。但腹腔模型仍存在一些缺点:(1)开腹手术,创伤较大,术中暴露肠管等腹腔脏器,体液丢失较颈部手术明显。(2)腹腔手术对胃肠功能有一定的影响。(3)术中需要充分游离腹主动脉及下腔静脉,可能发生血管意外损伤[10-11]。但基于熟练的显微技巧及适量补液,可将上述风险降至最低,因此,本研究选用腹腔作为异位心脏移植模型部位。
在本模型中,笔者增加了供心的血管长度,采用左锁骨下动脉以远5 mm的胸主动脉及左肺动脉作为供心动静脉系统,降低了血管吻合时的血管张力,增加了手术操作空间,降低了手术操作难度。在进行血管吻合口部位的设计时,若将两个腹主动脉与下腔静脉的端侧吻合口处于同一平面,那么在完成腹主动脉的吻合后,下腔静脉吻合口可能正好被供心升主动脉阻断,使得静脉吻合口难度增大,且可能对供心造成不必要的牵拉,使吻合口损伤的风险也相应增加。因此,笔者将两个端侧吻合口置于不同平面,下腔静脉的吻合口略低于腹主动脉的吻合口,从而可以在不牵拉供心的情况下,清楚观察到吻合口情况,并可进行相应操作。
在缝合方式上,采用10-0尼龙丝线连续缝合的方式进行,首先进行对角缝合以固定吻合口的上下两端,然后再分别对血管前后壁进行连续缝合,然后再根据需要,局部采用间断缝合进行补针。由于下腔静脉管壁较薄,且前后壁易贴在一起,使得肺动脉与下腔静脉的吻合成为本模型成功的难点之一,在术中可使用亚甲蓝染色以增强血管壁的显示,同时,通过肝素生理盐水反复冲洗亦增加血管壁的辨认,避免误将前后壁缝合在一起。值得注意的是,在血管吻合时,应将血管口周围血管外膜、脂肪组织等清除干净,避免将其带入血管腔成为异物,从而启动凝血机制,导致血栓形成[4]。
本实验中,2例供心在心脏移植后第3天出现心跳减弱,于第5天出现心跳停止,术后1周经解剖发现,供心血管无扭转,但心脏肿大明显,心腔内充填大量血栓,考虑停跳原因多系免疫排斥反应所致,但并不能完全排除因吻合口血栓形成所导致心脏停跳。而余下48例大鼠,供心均可长时间规律跳动,证明移植心脏存活良好,模型成功率高。
综上所述,与经典Ono术式相比较,本研究增加了实验大鼠供心的血管吻合长度,并将腹主动脉与下腔静脉的吻合口部位置不同平面,这样增大了血管吻合空间,降低了血管吻合的难度。同时,采用连续缝合的方式可以缩短手术时间,缩短受体腹主动脉、下腔静脉阻断时间及供心缺血时间,提高了手术成功率。因此,通过改良,本研究成功建立了SD-Wistar大鼠异位心脏移植模型。

