地塞米松影响大鼠成骨细胞脂质分化相关基因表达的实验观察*
宋丽君,刘 军,魏 波,郭伟雄,胡资兵,向 昊,孙 欣,彭智恒,孙杰聪,文琳钊
(广东医科大学附属医院:1.生殖医学中心;2.骨科,广东湛江 524001)
糖皮质激素(glucocorticoids,GC)被广泛应用于自身免疫性疾病、炎症性疾病的治疗,遗憾的是伴随激素的应用产生了各种各样的不良反应。骨坏死是其中一种严重的并发症[1-2]。长期应用GC可能导致高脂血症,血清三酰甘油、胆固醇升高,同时它也可诱发骨髓脂肪细胞肥大、增生。大量临床与实验研究表明GC诱发的脂质代谢紊乱存在于骨坏死的病理过程中[3-5]。成骨细胞是GC作用的靶组织之一,是维持骨质平衡与代谢稳定的主要结构。适宜的GC水平在骨的发育与维持中起着相当重要的作用。靶组织中细胞内GC的浓度不仅依赖细胞外激素水平,同时也依赖于激素的局部代谢。GC的生物学活性受到11β-羟脱氢酶(11β-HSD)的调节,能够催化无活性皮质酮与活性皮质醇相互转换[6]。成骨细胞能够活化非活性形式的GC,通过11β-HSD1 来调节激素的水平维持良好的内环境。甘珀酸能够抑制11β-HSD1的转换活性。
本文观察在应用活性抑制剂甘珀酸前后,地塞米松(Dex)作用于成骨细胞后,对成骨细胞的成脂与成骨分化的标志性基因及成骨细胞标志基因PPARγ、C/EBPα、runx2、Col.1、OPG的表达,初步分析地塞米松对诱发细胞内脂质积聚与基因表达异常之间的关系。
1 材料与方法
1.1实验动物与试剂 4月龄SD大鼠由广东医学院动物研究中心提供。胰蛋白酶、aMEM、胶原酶(GIBCO)、小牛血清(Biological industries)、碱性磷酸酶试染色剂盒、碱性磷酸酶活性试剂盒(Sigma), RT-PCR kit,RNA-Plus,PCR 荧光试剂(Gibco),甘珀酸(CBX,Sigma)。
1.2成骨细胞培养鉴定 拉颈脱臼处死SD大鼠,取出颅骨,去掉附着的软组织,PBS液洗净后,在aMEM培养基中剪成约1 mm3大小骨块,以1 cm2密度种植于培养瓶内,反转培养瓶,加入3 mL含有20%胎牛血清的aMEM培养液,培养瓶置于细胞培养箱中2 h,待骨植块稍干涸粘于瓶底,然后翻转培养瓶,使组织块浸没于培养基中,待细胞长满后传代(约12 d),用相差贴壁法纯化成骨细胞。碱性磷酸酶染色鉴定:在成骨细胞长满盖玻片后,用4 ℃ 10%甲醛固定,蒸馏水冲洗,将ALP孵育液直接滴加到盖玻片上,室温下孵育30 min,在相差显微镜下观察。
1.3实验分组 成骨细胞接种于6孔培养板中,按照所用地塞米松浓度分为7个实验组:空白对照组(加生理盐水),A组(Dex 1×10-8mol/L),B组(Dex 1×10-7mol/L),C组(Dex 1×10-6mol/L),D组(Dex 1×10-8mol/L+CBX),E组(Dex 1×10-7mol/L+CBX),F组(Dex 1×10-6mol/L+CBX),CBX剂量为8×10-7mol/L,所有组作用6 h。
1.4总RNA 提取及Real-time PCR分析 总mRNA提取:按照RNA-Plus试剂盒(Gibco)说明从成骨细胞提取总RNA。所得沉淀溶解于DEPC溶液,取2 μL稀释至100 μL,紫外分光光度计测定RNA含量及OD值。剩余部分存放于-80 ℃以备逆转录。
逆转录:取细胞RNA样本,根据上述mRNA的含量计算1 μg mRNA所需的适量RNA体积,加入:5×g DNA Eraser Buffer 2 μL+gDNA Eraser 1 μL+适量DEPC水构成10 μL体系,室温下放置5 min,将上述反应液10 μL加入:5×PrimeScript Buffer 4 μL+ PrimeScript®Enzyme 1 μL+RT Primer Mix 1 μL+DEPC水4 μL直至20 μL,反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃下保存。最终得到的cDNA放置于-20 ℃冰箱中保存以备下一步PCR反应过程。
Real-time PCR:应用LightCycler®480PCR反应系统检测11β-HSD1,PPAR,C/EBPα,RUX2,C/EBP)α mRNA表达。β-actin作为内参引物。反应体系包含10 μL TaqMan通用PCR反应液,2 μL引物,2 μL TaqMan探针及2 μL cDNA。 反应条件为:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸32 s,共40个循环。按照试剂盒说明根据测得Ct值计算出≥Ct值,△Ct目的基因Ct-内参Ct;△△Ct待测样品中目的基因△Ct-参照样品中目的基因△Ct;相对表达量=-△△Ct。引物:11-HSD1,正向:5′-CTCAGCTATGTGGTCCTGAGC-3′,反向: 5′-AATGGTGGAAAAGAACCCATC-3′;C/EBPα,正向:5′-GTCGGTGGATAAGAACAGCAAC-3′,反向:5′-CTGGTCAA CTCCAACACCTTCT-3′;PPARr,正向:5′-GT GGCTGCTATAATTTGCTGTG-3′,反向:5′-GGAGTT TTGGGAAGAGAAAGGT-3′;runx2,正向:5′-CCATAACGG TCTTCACAAATCC-3′,反向:5′-GCGGGACACCTACTCTCATACT-3′;β-Actin,正向:5′-CACCCGCGAGTACAACCTTC -3′,反向:5′-CCCATACCCACCATCACACC -3′。

2 结 果
2.1成骨细胞分离培养鉴定 见图1。

A:第二代成骨细胞(×40);B:细胞碱性磷酸酶染色阳性
图1成骨细胞分离鉴定
2.2成骨细胞内脂质沉积 油红O染色显示,地塞米松(1×10-7mol/L)作用后成骨细胞细胞质内出现散在红染的均匀颗粒,细胞质内有脂质形成与积聚。见图2。

A:(×40);B:(×200)
图2激素作用后成骨细胞油红染色

表1 分离RNAs浓度及OD值
2.3mRNAs分析 所分离获得的RNAOD值为1.7~2.0,表明RNA含量稳定,可以用于下一步RNA分析(表1)。RT-PCR分析,当地塞米松由低浓度向高浓度作用时,PPARγ,C/EBPα RNA表达上升, runx2表达下降,成骨细胞的标志物OPG与Ⅰ型胶原表达无明显改变;应用11β-HSD1酶活性抑制剂CBX不能改变这种趋势(图3)。
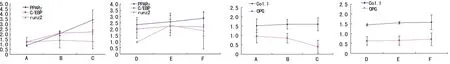

PPARγ,C/EBPα RNA表达在应用地塞米松后上升,A、B、C组间差异有统计学意义(P<0.05);应用甘珀酸后表达仍呈上升趋势,高低深度间仍存在统计学差异(P<0.05),runx2表达下降。成骨性标志基因表达变化各组间不显著,OPG在激素组呈略下降趋势,组间差异无统计学意义(P>0.05)。
3 讨 论
骨坏死是伴随糖皮质激素应用的一种严重并发症。迄今为止对于它们之间的关系与机制研究已开展了大量研究工作。JONES等[7]研究认为过量的糖皮质激素可能诱发脂肪肝,引起脂肪栓塞阻塞骨的血管,并最终导致骨坏死。大量的临床与基础研究表明脂质代谢紊乱存在于股骨头坏死的病理过程中[8]。KAWAI等[4]认为发生于股骨头缺坏死的缺血性改变可能是非直接或者是继发的改变,而不是一种原发的原因。接受激素治疗的动物表现出软骨下骨区域骨细胞的脂肪坏死,以及与骨细胞脂肪沉积相平行的渐进性的骨细胞变性。骨细胞脂肪变是骨坏死病理过程中脂质代谢紊乱的一项重要机制。脂质沉积可能发生在激素治疗后的股骨头的各系细胞。随激素应用时间延长,脂质沉积逐渐增加,并且融合成脂滴。细胞核受压、边集,细胞器功能受到干扰,最终导致细胞坏死[4,9]。这提示骨细胞的脂肪变性是股骨头坏死的一项重要病理改变,是否这一改变的原因是由于成骨细胞发生了转分化(表型改变)?目前报道较少。成骨细胞表达碱性磷酸酶,OPG,Ⅰ型胶原是成熟成骨细胞的标志。本研究中作者发现当应用大剂量的糖皮质激素时,成骨细胞出现脂质积聚改变,成脂肪标志基因PPARγ、C/EBPα表达显著升高,而成骨性标志基因runx2表现下降,这提示在皮质激素诱发的成骨细胞脂质变可能是由于细胞本身发生了表型异常所致。
11β-HSD1是一种NADPH依赖性酶主要起还原酶活性,在人转换非活性皮质酮为有活性的皮质醇,在啮齿类动物则转换11去氢皮质酮为皮质酮,从而扩大了激素的作用。有研究认为地塞米松不能被11β-HSD1转换,仅仅上调其表达[10-11]。本文发现成骨细胞受地塞米松作用后,出现明显细胞内脂质小滴形成。说明糖皮质激素能够明显诱导成骨细胞内的脂质积聚过程。而地塞米松能够诱导成骨细胞表达成脂分化基因,表现为PPARγ,C/EBPα随激素浓度递增上升,应用皮质激素活性抑制剂甘珀酸后这种表达增高的趋势未被抑制,而影响成骨分化基因runx2则有下降趋势。两种情况下成骨细胞Ⅰ型胶原与OPG表达未见显著变化。由此提示地塞米松可能如文献所述不需经过11β-HSD1酶的活性转换,而直接进入细胞起作用。再者地塞米松抑制了该酶的表达,导致内源性皮质激素转换下降,不能有效促进成骨,表现为胶原与OPG表达无上升改变。PPARγ是维持脂质稳定的重要核受体家族成员。体外研究提示泼尼松能够打破SD大鼠runx2与PPARγ之间的平衡,破坏成骨与成脂的内在稳定,从而削弱成骨能力[9-10]。因此作者认为糖皮质激素作用下成骨细胞内的脂质积聚可能是由于诱导了成脂分化性基因表达的结果,但这种脂质调节异常的结果是否直接影响到了成骨细胞的功能与机制,还有待于更深入的研究以获取充分证据。
当SD大鼠颅骨成骨细胞在体外受到人工合成的糖皮质激素作用时,表现为细胞内脂滴形成,成脂分化性基因表达增加,成骨相关基因表达下降,酶活性抑制剂不能有效影响这一趋势,提示过量的人工合成皮质激素可能通过改变了成脂分化性基因的表达而使细胞表型发生了改变,抑制了成骨性能,从而成为激素诱发的骨坏死的原因之一,但仍需更深入的研究来阐明详细机制。

