NMHC-ⅡA蛋白的重组表达、多克隆抗体制备及其功能的初步探讨
熊 丹,杜 勇,张 华,武 薇,莫红梅,张秀明△
(1.深圳大学第三附属医院医学检验科,广东深圳 518001;2.上海市(复旦大学附属)公共卫生临床中心医学检验科,上海 200433;3.中山大学附属肿瘤医院实验研究部,广东广州 510060)
鼻咽癌是来源于人类鼻咽上皮细胞恶性程度较高的头颈部肿瘤,北美和其他西方国家的白种人每年的发病率低于1/100 000;然而,在中国南方其年发病率可高达25/100 000~30/100 000,其中又以广东最为常见[1]。由于具有显著的地方性,鼻咽癌又被称为“广东癌”[2]。在中国的华南等高发区,鼻咽癌的组织类型97%以上为未分化癌(WHO Ⅲ型)[3]。EB病毒感染、环境致癌因素以及抑癌基因和原癌基因的突变等多因素、多步骤共同参与了鼻咽癌的发生、发展过程[1]。EB病毒属人类γ-疱疹病毒亚科淋巴潜隐病毒属,1997年世界卫生组织国际癌症研究机构(LARC)的报告中已将EB病毒列为Ⅰ类致癌原[4]。EB病毒在体内主要感染B淋巴细胞和上皮细胞,与伯基特淋巴瘤、霍奇金病、胃癌和鼻咽癌等肿瘤密切相关[5]。
非肌肉肌浆球蛋白重链ⅡA(NMHC-ⅡA)由位于22q11.2染色体上的全长1 960个氨基酸的MYH9基因编码[6],这是一种广泛表达在细胞质的肌球蛋白,参与多种过程,包括细胞内化学机械力的产生和肌动蛋白细胞骨架的移位[7]。笔者前期研究发现NMHC-ⅡA与病毒糖蛋白gH/gL相互作用介导EB病毒感染鼻咽上皮细胞[8],NMHC-ⅡA是EB病毒进入鼻咽上皮细胞的重要细胞分子。因此制备针对NMHC-ⅡA为靶点的抗EB病毒感染的中和抗体,对于鼻咽癌的靶向治疗具有重要意义。本文应用兔多克隆抗体制备技术,制备抗NMHC-ⅡA的特异性抗体,为进一步进行鼻咽癌的分子靶向治疗和研究NMHC-ⅡA在鼻咽癌中扮演的角色奠定基础。
1 材料与方法
1.1材料 收集3例鼻咽炎增生组织(NPN-1、NPN-2、NPN-3,病理诊断为炎症增生组织)和4例鼻咽癌组织(NPC-1、NPC-1、NPC-3、NPC-4,病理诊断为肿瘤组织)。4株原代鼻咽上皮细胞(N01、N02、N03、N04)、永生化的NP69细胞和BMI1/NPECs在无血清的培养基(KSFM)中培养(InvitroGen,17005~075);鼻咽癌细胞株(C666-1、HK1、SUNE1、SUNE2、CNE1、CNE2)、CNE2-EBV、HNE1-EBV、HK1-EBV和Akata(EBV-eGFP)培养在5%胎牛血清的RPMI 1640培养基中,培养条件为37 ℃、5% CO2。EBV-eGFP的制备如文献[9]报道,用0.8%羊抗人IgG交联Akata (EBV-eGFP)细胞表面IgG蛋白,促使EB病毒从潜伏期进入裂解期,从而使病毒颗粒释放。重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C (amino acids 1665-1960;UniProt entry P35579)由本室构建并保存。实验动物日本大耳白兔,购买于具有“实验动物生产许可证”资质的武汉市万千佳兴生物科技有限公司。
1.2仪器与试剂 7900HT Fast Real-time PCR 系统 (Applied Biosystems,USA),电泳仪,水平电泳槽,凝胶成像系统(SynGene),台式冷冻离心机(Centrifuge 5810,Centrifuge 5417R,Eppendorf),超纯水系统(Millipore),磁力搅拌器,分析天平和 pH 计(Mettler Toledo),漩涡振荡仪(Scientific Industries),超净工作台(苏净),培养箱(Thermo Forma),普通光学显微镜(COIC,XSZ-H),倒置相差显微镜(COIC XDS-1B),流式细胞仪(FACS Diva Option,Becton Dickinson,Mountain View,CA)。Trizol试剂(Invitrogen,Grand Island,NY),逆转录酶cDNA合成试剂盒(Fermentas,St Leon-Rot,德国),卡那霉素,谷胱甘肽琼脂糖凝胶珠(Glutathione-Sepharose beads,GE公司),兔IgG(R&D Systems公司),anti-NMHC-ⅡA兔多克隆抗体 (英国Abcam公司),GAPDH 抗体和β-actin 抗体(中国上海康成公司)。
1.3方法
1.3.1重组蛋白的表达、鉴定和纯化 将重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C (amino acids 1665-1960;UniProt entry P35579)进行Bam HI和EcoRI双酶切鉴定,得到的小片段,进行测序和比对。将重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C和对照质粒pGEX-4T-1/GST转化入E.coli BL21感受态细胞中,涂布于含有卡那霉素(50 μg/mL)抗性的LB平板,37 ℃过夜培养,得到重组蛋白表达菌株,然后加入500 μM IPTG诱导表达5 h后,离心收集沉淀。在沉淀中加入细菌裂解液,超声破碎后,离心,收集上清,用SDS-PAGE的方法检测目的蛋白。用谷胱甘肽琼脂糖凝胶珠(Glutathione-Sepharose beads,GE公司)纯化NMHC-ⅡA重组蛋白,参照产品说明书操作。
1.3.2多克隆抗体的制备、纯化和效价测定 以日本大耳白兔为免疫动物,免疫前取1 mL兔血清为对照组。将浓缩后的NMHC-ⅡA蛋白作为免疫原以1.0毫克/只的剂量通过背部及皮下多点注射到2只日本大耳白兔。首次免疫与加强免疫总共4次,末次免疫7 d后对日本大耳白兔进行颈动脉取血,分别收集2只日本大耳白兔免疫后的血清各30 mL和12 mL,然后进行纯化。期间,采用间接ELISA的方法检测从日本大耳白兔耳缘静脉取血中该抗体的效价。采用SDS-PAGE检测纯化后的兔抗NMHC-ⅡA抗体浓度。
1.3.3Real-time PCR和Western-Blot检测 用Trizol试剂(Invitrogen,Grand Island,NY)从4株原代鼻咽上皮细胞、3株永生化鼻咽上皮细胞株、6株鼻咽癌细胞株、3例鼻咽炎增生组织和4例鼻咽癌组织中提取总RNA,然后用逆转录酶cDNA合成试剂盒(Fermentas,St Leon-Rot,德国)进行逆转录成cDNA,用Real-time PCR方法检测鼻咽细胞株和组织中NMHC-ⅡA的mRNA水平的表达情况。NMHC-ⅡA、GAPDH的引物序列及Real-time PCR反应条件同文献报道一致[10]。Western-Blot检测方法参照文献[11]采用的抗体包括anti-NMHC-ⅡA兔多克隆抗体(英国Abcam公司)、制备的anti-NMHC-ⅡA兔多克隆抗体、GAPDH抗体和β-actin抗体(中国上海康成公司),以GAPDH和β-actin抗体为内参照。
1.3.4抗体阻断试验 用制备的不同浓度的多克隆NMHC-ⅡA抗体(100、50和25 μg/mL)和100 μg/mL的对照IgG(购买于R&D Systems公司)在4 ℃预处理细胞1 h,不除去抗体,然后在37 ℃条件,EB病毒感染细胞3 h,接着用1×SA洗2次,加1 mL的KSFM培养基培养24 h,用流式细胞仪检测24 h内EB病毒感染细胞的平均荧光强度。
1.3.5流式细胞仪分析 为检测EB病毒感染细胞的百分率和平均荧光强度,细胞在感染后24 h内被胰蛋白酶消化成单个细胞悬液,然后采用流式细胞仪(FACS Diva Option;Becton Dickinson)进行检测。

2 结 果
2.1NMHC-ⅡA mRNA在鼻咽细胞和组织中广泛表达 实时荧光定量PCR结果显示,原代培养的鼻咽上皮细胞、永生化鼻咽上皮细胞株、鼻咽癌细胞株、鼻咽炎增生组织和鼻咽癌组织在转录水平上都表达NMHC-ⅡA。4株原代培养的鼻咽上皮细胞NMHC-ⅡA的mRNA表达比鼻咽癌细胞株中的表达都高,除了C666-1外。永生化鼻咽上皮细胞株中,NP69的表达较低,另外2株永生化细胞株比较高。在鼻咽癌细胞株中,C666-1的NMHC-ⅡA的mRNA表达最高,其次是CNE2。与3例鼻咽炎增生组织相比,4例鼻咽癌组织中,2例鼻咽癌组织中NMHC-ⅡA的mRNA表达水平较高,另外2例相差不大(图1)。
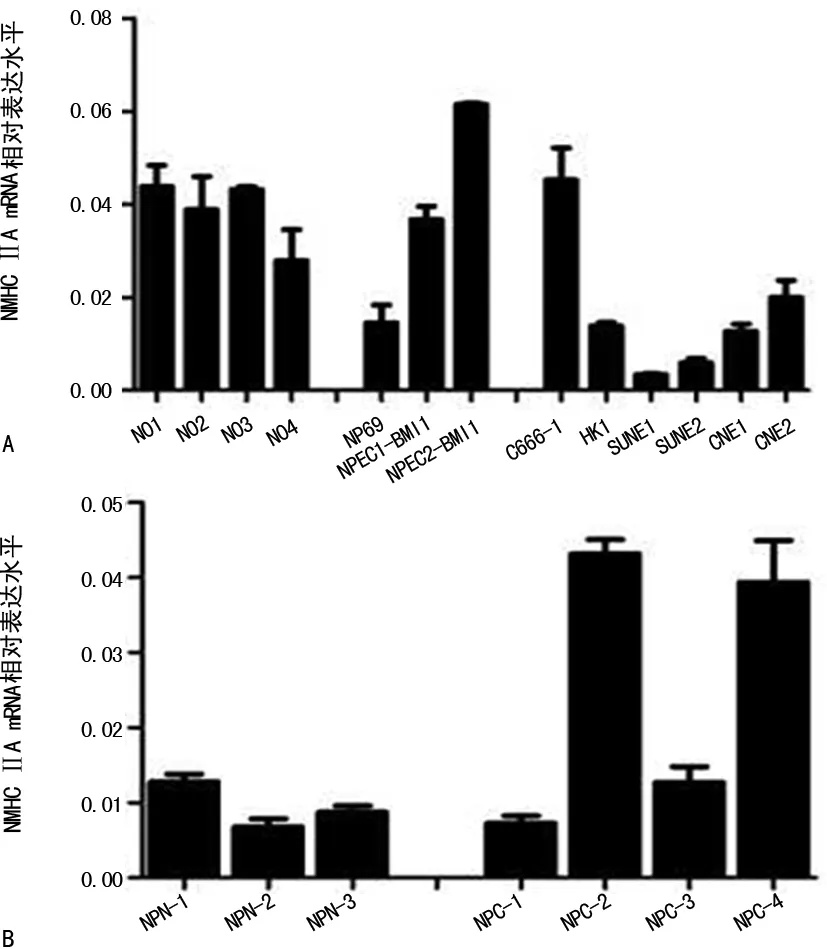
注:A表示NMHC-ⅡA mRNA在原代培养鼻咽上皮细胞、永生化鼻咽上皮细胞和鼻咽癌细胞中广泛表达;B表示NMHC-ⅡA mRNA在鼻咽炎增生组织和鼻咽癌组织中广泛表达
图1NMHC-ⅡAmRNA在鼻咽细胞和组织中广泛表达
2.2NMHC-ⅡA-pGEX-4T-1原核表达载体的鉴定及NMHC-ⅡA重组蛋白的诱导表达、纯化 重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C 进行双酶切后得到小片段的大小为1 000 bp左右,经过测序和比对,确定其序列与NCBI数据库中MYH9基因序列一致(图2A)。含有pGEX-4T-1/GST-NMHC-ⅡA-C和pGEX-4T-1/GST重组质粒的E.coli BL21经IPTG诱导表达后,经SDS-PAGE电泳,结果显示在相对分子质量为60×103左右处有明显的蛋白诱导条带,为GST-NMHC-ⅡA的重组蛋白;相对分子质量为25×103左右处有明显的蛋白诱导条带,为GST蛋白(图2B)。将原核表达产物裂解后用谷胱甘肽琼脂糖凝胶珠进行NMHC-ⅡA重组蛋白纯化,通过SDS-PAGE实验进行鉴定,初步纯化了GST-NMHC-ⅡA的融合蛋白(图2C),进一步大批量的培养细菌并纯化蛋白,得到了大于2 mg,浓度为1.0 mg/mL的纯化蛋白,经免疫印迹鉴定,为GST-NMHC-ⅡA的融合蛋白(图2D)。
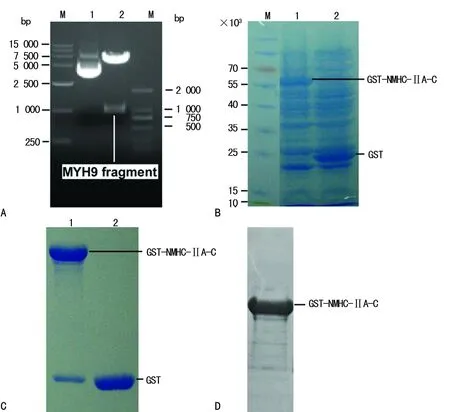
注:图A为用Bam HI和EcoRI 对重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C 进行双酶切的鉴定,M为DNA DL15000 marker和DNA DL2000 marker,1为重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C,2为用Bam HI和EcoRI 对重组质粒pGEX-4T-1/GST-NMHC-ⅡA-C 进行酶切的结果;图B为GST-NMHC-ⅡA和GST蛋白的表达,M为Marker,1为GST-NMHC-ⅡA的重组蛋白,2为GST蛋白;图C为GST-NMHC-ⅡA和GST蛋白的纯化,M为Marker,1为GST-NMHC-ⅡA的重组蛋白,2为GST蛋白;图D为大批量制备GST-NMHC-ⅡA重组蛋白的鉴定
图2NMHC-ⅡA-pGEX-4T-1原核表达载体的鉴定及NMHC-ⅡA重组蛋白的诱导表达、纯化
2.3兔抗NMHC-ⅡA多克隆抗体的制备及效价测定 将NMHC-ⅡA蛋白作为免疫原免疫日本大耳白兔,将免疫后的血清通过间接ELISA方法测得抗NMHC-ⅡA血清的效价均为1 000 000(图3A)。采用间接ELISA方法检测来源于1号日本大耳白兔的血清、洗脱液和纯化抗体的效价分别是1∶100 000、1∶500和1∶100 000。来源于2号日本大耳白兔的血清、洗脱液和纯化抗体的效价分别是1∶1 000 000、1∶500和1∶1 000 000(图3B)。SDS-PAGE检测纯化后的兔抗NMHC-ⅡA抗体浓度分别是600 μg/mL和1.35 mg/mL(图3C)。
2.4采用制备的兔抗NMHC-ⅡA抗体检测鼻咽癌细胞株和永生化鼻咽上皮细胞株中NMHC-ⅡA蛋白的表达 采用制备得到的1号抗体(编号为S3633-1)和2号抗体(编号为S3633-2)检测鼻咽癌细胞株中NMHC-ⅡA的蛋白表达情况,发现2株抗体能检测到鼻咽癌细胞株中NMHC-ⅡA的表达(图4A)。与商业化NMHC-ⅡA抗体相比,制备的抗体也能检测到永生化鼻咽上皮细胞株中NMHC-ⅡA蛋白的表达;商业化的抗体和制备的抗体的使用浓度均为1∶1 000,表明制备的抗体有良好的特异度和灵敏度(图4B)。采用Western-blot方法检测鼻咽癌细胞株和稳定表达EB病毒的鼻咽癌细胞株中NMHC-ⅡA的表达情况,发现EB病毒的感染并不影响NMHC-ⅡA蛋白的表达(图4C)。

注:图A为采用ELISA方法检测来源于2只日本大耳白兔的抗血清抗体的效价,1为1号日本大耳白兔,2为2号日本大耳白兔;图B为采用ELISA方法检测2株纯化抗体的效价,1为1号日本大耳白兔,2为2号日本大耳白兔,a为血清;b为洗脱液;c为纯化抗体;图C为SDS-PAGE检测纯化后的NMHC-ⅡA抗体浓度,1为来源于1号日本大耳白兔的纯化抗体,2为来源于2号日本大耳白兔的纯化抗体
图3兔抗NMHC-ⅡA多克隆抗体的效价及特异性检测
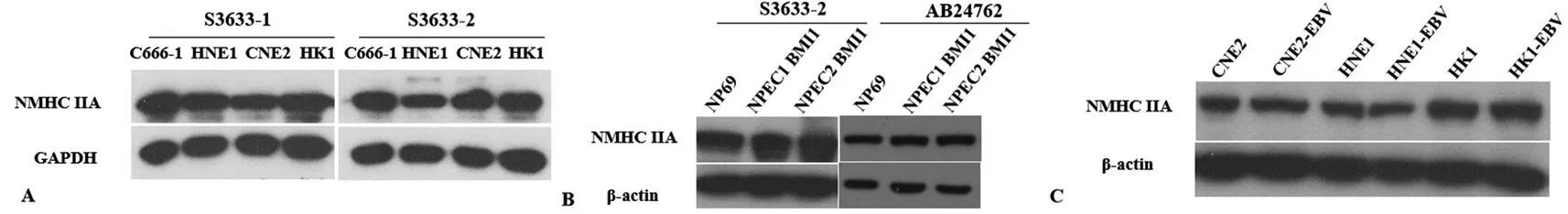
注:图A为采用1号抗体(编号为S3633-1)和2号抗体(编号为S3633-2)检测鼻咽癌细胞株中NMHC-ⅡA的蛋白表达情况;图B为采用2号抗体(编号为S3633-2)和商业化抗体(编号为AB24762)检测永生化鼻咽上皮细胞中NMHC-ⅡA的蛋白表达情况;图C为采用2号抗体(编号为S3633-2)检测鼻咽癌细胞株和用EB病毒感染鼻咽癌细胞株建立的稳定表达EB病毒的鼻咽癌细胞株中NMHC-ⅡA的蛋白表达情况
图4制备的兔抗NMHC-ⅡA抗体检测鼻咽癌细胞株和永生化鼻咽上皮细胞株中NMHC-ⅡA蛋白的表达

注:A为荧光显微镜观察EB病毒或者腺病毒感染预先与不同浓度的中和抗体NMHC-ⅡA孵育后永生化鼻咽上皮细胞的代表性图片;B、C为EB病毒或者腺病毒感染预先与不同浓度的中和抗体NMHC-ⅡA孵育后永生化鼻咽上皮细胞的感染效率及柱状图;数据显示平均值±标准差(n=2),以对照组IgG感染效率为100%,其余的与其比较所得到的值;*P<0.05,**P<0.01
图5NMHC-ⅡA中和抗体抑制EB病毒感染的效率图
2.5NMHC-ⅡA抗体可以有效地抑制EB病毒的感染 研究NMHC-ⅡA在EB病毒感染鼻咽癌上皮细胞中是否发挥作用。分别将25、50、100 μg/mL制备的多克隆抗体NMHC-ⅡA预先与永生化鼻咽细胞株NPEC2-BMI1孵育后,然后通过荧光显微镜观察和流式细胞仪检测,发现兔抗NMHC-ⅡA多克隆抗体可以降低EB病毒的感染效率,并呈剂量依赖性。100 μg/mL剂量的多克隆抗体减少EB病毒的感染效率达54.84%。相反,该抗体对腺病毒的感染并没有影响。无论是显微镜观察GFP的表达分布和流式检测EB病毒的感染效率,结果均一致(图5)。
3 讨 论
NMHC-ⅡA在卡波氏肉瘤病毒(KSHV)[11]和人类单纯疱疹病毒(HSV-1)[12]进入宿主细胞发挥着非常重要的作用。NMHC-ⅡA是HSV-1感染上皮细胞的受体,并且发现NMHC-ⅡA有利于HSV-1与上皮细胞的融合[12]。文献报道NMHC-ⅡA是猪繁殖和呼吸综合征(PRRS)病毒感染的重要细胞因子,重组NMHC-ⅡA蛋白C末端结构域(命名为PRA)通过与病毒糖蛋白5直接相互作用阻断猪繁殖和呼吸综合征病毒(PRRSV)的内化,进一步发现PRRSV与可溶性PRA蛋白的预孵育对病毒有抑制作用,并呈剂量依赖性。PRA还具有抑制PRRSV基因型1和2的不同菌株感染的广谱能力[13]。笔者前期研究表明EB病毒gH/gL与NMHC-ⅡA相互作用促进EB病毒有效进入上皮细胞,并且抑制内源性NMHC-ⅡA的表达可减少EB病毒的结合[8],说明内源性NMHC-ⅡA在EB病毒感染永生化鼻咽上皮细胞中发挥着重要的作用。笔者前期通过抗体阻断实验发现制备的多克隆抗体NMHC-ⅡA可以降低EB病毒的感染效率,并呈剂量依赖性,但对腺病毒的感染没有影响[8]。本研究采用不同的剂量也得到了相同的结果,同样采用的是重组蛋白C末端区域,进一步表明内源性NMHC-ⅡA在EB病毒感染永生化的鼻咽上皮细胞中发挥着重要的作用。能阻断NMHC-ⅡA与EB病毒gH/gL相互作用的抑制剂可能阻止EB病毒进入或阻止永生化的鼻咽上皮细胞向鼻咽癌转化。因此制备针对NMHC-ⅡA为靶点的抗EB病毒感染的中和抗体,对于鼻咽癌的靶向及其抗病毒治疗具有重要意义。
采用Akata EBV(+)细胞制备的EB病毒携带绿色荧光蛋白,从而为检测病毒感染细胞提供方便。笔者前期研究发现EB病毒感染永生化鼻咽上皮细胞形成球形细胞后,与没感染前,NMHC-ⅡA表达无明显变化[8]。笔者采用高滴度的EB病毒感染鼻咽癌细胞株,然后用G418筛选,获得了稳定表达EB病毒的鼻咽癌细胞株。采用Western-blot方法检测稳定表达EB病毒的鼻咽癌细胞株中NMHC-ⅡA蛋白的表达情况,发现与对照组相比,NMHC-ⅡA蛋白的表达没有增加,表明EB病毒的感染并不能影响NMHC-ⅡA蛋白的表达,与笔者前期研究一致。
最近,NMHC-ⅡA在肿瘤细胞中的作用越来越受关注。研究发现MicroRNA-647通过靶向调控SRF-MYH9轴,从而抑制胃癌细胞的侵袭和转移[14]。一项研究表明长链非编码RNA PTCSC2与MYH9蛋白结合,更易发生甲状腺癌[15]。另一项研究发现S100A4-Myh9轴通过诱导转化生长因子β介导的上皮间充质转移促进胃癌细胞的迁移和侵袭[16]。笔者研究发现高表达的NMHC-ⅡA可以作为预示膀胱癌病人不良预后的分子标志物,沉默内源性NMHC-ⅡA的表达后能降低膀胱癌细胞侵袭及转移能力[10]。然而,在头颈部鳞癌中,NMHC-ⅡA被确认为肿瘤抑制因子[17]。文献报道NMHC-ⅡA S1943位点的磷酸化有助于调节细胞外基质降解从而促进肿瘤细胞的侵袭和转移[18]。
本研究发现NMHC-ⅡA mRNA在原代培养、永生化鼻咽上皮细胞株、鼻咽癌细胞株及鼻咽组织、鼻咽癌组织中都有表达,并且NMHC-ⅡA蛋白在原代培养、永生化鼻咽上皮细胞株和鼻咽癌细胞株中都有表达,表明这种蛋白广泛存在于鼻咽上皮细胞,该蛋白及其磷酸化水平在鼻咽癌中发挥的作用又是如何,值得进一步研究。
4 结 论
笔者成功实现了人源NMHC-ⅡA蛋白的重组表达、纯化及高效价多克隆抗体的制备。该多克隆抗体能识别细胞中内源表达的NMHC-ⅡA蛋白。同时,发现NMHC-ⅡA多克隆抗体可以有效地抑制EB病毒在永生化鼻咽上皮细胞中的感染,为进一步研究NMHC-ⅡA相关功能奠定了重要基础。

