自身抗体检测现状及展望
武永康,张乃丹 综述,翟建昭 审校
(1.四川大学华西医院实验医学科,四川成都 610041;2.德阳市人民医院检验科,四川德阳 618000)
自身抗体是指针对自身组织、器官、细胞、细胞亚结构、体内蛋白分子、体内核酸等所有自身抗原的抗体总称,其本质为机体B细胞分泌的免疫球蛋白[1]。自身抗体分为生理性自身抗体(或称天然自身抗体)(NAbs)和病理性自身抗体(PABs)。有研究显示,生理性自身抗体是维持机体处于健康状态的重要物质,多为IgM型,参与机体正常新陈代谢,减少体内细胞凋亡物质的堆积[2]。当机体免疫调节功能受损时,体内自身抗体大量产生,多为IgG型,与自身抗原亲和力高,形成的免疫复合物通过FcγR激活炎性介质(细胞因子)或补体系统,导致自身免疫性疾病的发生,这种具有致病损伤作用的自身抗体即为病理性自身抗体,即通常所称的自身抗体[3]。
1 自身抗体的种类
自身抗体种类很多,通常采用两种分类方法,一种为以疾病为中心,即相关自身抗体与该疾病有关,该分类法对于临床医生自身抗体项目申请具有重要意义,同时也有助于对该疾病与自身抗体的全面认识;另一种为以靶抗原为中心,即其命名为抗靶抗原抗体,这有助于对自身抗体性质的认识,也有助于对自身抗体对靶向组织攻击造成机体损伤的理解。从理论上讲,机体内存在多少种抗原,就能产生多少种自身抗体,因此,自身抗体错综复杂,种类可达成千上万种,自身抗体的命名应尽量根据抗体所针对的抗原进行,便于名称的统一。以靶抗原为中心的自身抗体分类见图1。
1.1常规自身抗体 随着自身免疫学科的发展及检验技术的逐渐普及,自身抗体已成为大多数医疗机构的常规检测项目,包括抗核抗体(ANA),抗核抗体谱[包括抗DNA、抗组蛋白及抗可提取性核抗原(ENA)抗体谱等],抗中性粒细胞胞浆抗体[包括抗蛋白酶3抗体(抗PR3)、抗髓过氧化酶抗体(抗MPO)等],抗磷脂抗体(包括抗心磷脂抗体、抗β2糖蛋白I抗体、抗磷脂酰丝氨酸抗体等),类风湿关节炎抗体(包括抗CCP抗体、类风湿因子、抗角蛋白抗体等),自身免疫肝病抗体(包括抗平滑肌抗体、抗线粒体抗体、抗肝肾微粒体-1抗体等),肌炎相关抗体(包括抗Mi-2、抗信号识别颗粒抗体、抗PM-Scl100等),糖尿病抗体(包括谷氨酸脱羧酶抗体、胰岛素抗体和胰岛细胞抗体等)。其中ANA与抗核抗体谱是临床开展最为普遍的两类项目。ANA泛指抗各种核及胞浆抗原成分的一大类抗体,推荐采用以HEp-2细胞为底物的间接免疫荧光法进行检测。而抗核抗体谱是指针对明确纯化抗原抗体的集合,其与传统的ENA抗体谱有所不同,传统ENA抗体谱检测通常采用磷酸盐缓冲液提取动物胸腺细胞核蛋白作为抗原底物[4]。但由于核成分中的DNA和组蛋白等碱性成分无法被磷酸盐缓冲液(pH=7.2)提取,因此,传统ENA抗体谱并未包括抗DNA抗体和组蛋白抗体等碱性靶抗原的抗体。
随着蛋白重组技术的进步,几乎所有蛋白分子均可重组合成,目前临床上很少采用传统Western-blot法进行ENA抗体谱的检测,从理论上讲,合成纯化抗原检测结果准确可信,且抗核抗体谱的检测范围远大于ENA抗体谱的范围。ENA抗体谱概念不再被使用,因此,采用大量重组蛋白的抗核抗体谱检测试剂盒在临床上已趋普及,并被广大学者所接受。ANA荧光图型与抗核抗体谱靶抗原对应关系见图2。

图1 以靶抗原为中心的自身抗体命名分类图
1.2新型自身抗体 随着蛋白重组及自身抗体筛选技术的发展,大量新型自身抗体集中涌现,其中主要包括传统自身免疫疾病发现的一些自身抗体,另外在其他领域如神经系统疾病、肿瘤、生殖、消化系统疾病等也出现了一些新型自身抗体,为其应用拓展了范围。肿瘤患者自身抗体反应通常与肿瘤组织或血清中的肿瘤相关抗原(TAA)的异常或过度表达相关,大部分的肿瘤自身抗体都是由TAA诱导产生的,为肿瘤的诊断和鉴别诊断提供了新的实验依据。近年来出现的新型自身抗体见表1。
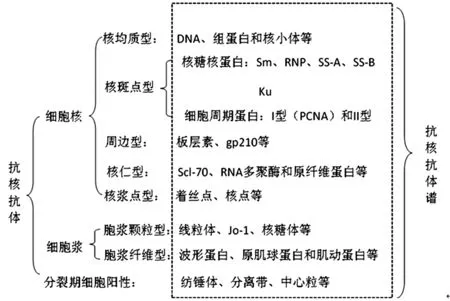
图2 ANA荧光图型与抗核抗体谱靶抗原对应关系

表1 近年来出现的新型自身抗体
2 自身抗体筛选和发现
新型自身抗体的发现对于疾病诊断和认识具有重要意义。目前以HEp-2细胞为基质的ANA检测及以肝、肾组织为基质的ANCA和GBM检测已经在临床广泛开展[21-22],而临床实践过程中,相当数量的医师和技师只关注熟悉已知的荧光抗体模型,对于特殊少见荧光模型很多情况下都主观认为是非特异性染色或杂质而忽略。实际上,临床工作中遇到未知荧光抗体模型时应做详细记录,并结合患者疾病或临床症状进行分析,从而可能发现新的荧光模型与疾病之间的关系,有利于新型自身抗体发现。
此外,传统的Western-blot法也是发现新型自身抗体的检测方法。由于ENA抗原蛋白分离带非常多,临床上会发现一些所谓的“杂带”,这些杂带可能就是与疾病相关的新型自身抗体,但临床实践中也常被忽略。目前,由于该法检测ENA抗体谱的局限性,以及检测结果的不确定性,Western-blot法检测ENA抗体谱已很少使用,取而代之采用纯化抗原的线性免疫印迹法、化学发光法或液相芯片技术进行检测。
虽说上述两种方法具有发现新型自身抗体的可能性,但荧光抗体检测基质及ENA提取物抗原种类有限,基质并未包括人体所有的抗原物质,这是发现新型自身抗体的内在缺陷。目前已发展出一些高效筛选自身抗体的方法。
2.1重组cDNA 表达文库的血清学分析(SEREX) SEREX技术是自身抗体筛选的重要手段,通过提取患者组织mRNA反转录成cDNA后导入噬菌体,并溶原性感染大肠杆菌构建cDNA表达文库,将表达产物转印在硝酸纤维膜上,之后与患者血清反应,然后对阳性克隆进行PCR测序鉴定即可得知抗原种类,同时也选出相应的自身抗体。
2.2噬菌体展示技术 噬菌体展示技术是将外源基因插入噬菌体衣壳蛋白基因,使外源蛋白表达在噬菌体表面,大量表达外源蛋白的单个噬菌体构成噬菌体文库,展示的蛋白和血清中IgG自身抗体反应后,筛选阳性噬菌体并扩增鉴定,并采用测序方式确定自身抗原。
2.3蛋白芯片技术 首先,纳入一定数量的研究患者及匹配的对照,从而寻找患者与对照最为显著差异表达的信号,之后将选定的差异自身抗体在大范围患者确认,以确定选定自身抗体诊断疾病的有效性。目前,众多学者已尝试采用约20 000个重组人蛋白的芯片,系统性地发现免疫相关疾病及肿瘤的自身抗体[23]。
3 自身抗体检测新技术
二十世纪50年代中期至80年代后期的30余年间,自身抗体的检测方法主要有间接免疫荧光法、放射免疫法、被动血凝法、颗粒凝集法、对流免疫电泳法、免疫双扩散法、放射免疫沉淀法、免疫印迹法等,主要从细胞及蛋白多肽水平认识自身抗体。对于上述检测方法而言,鉴于间接免疫荧光法检测结果的直观性、自身抗体检测的广泛性,在今后一段时间内,该方法仍将是不可替代的筛选检测方法。
上述自身抗体检测方法多为半定量的方法,难以标准化,使疾病诊断的特异度、灵敏度受到限制。上世纪90年代后,随着纯化靶抗原技术的进步,试剂厂商采用纯化抗原制作试剂,提高了自身抗体的检测速度和准确性。自身抗体的检测主要朝2个方向发展,即多个自身抗体同时检测的高精度、高通量检测方法的液相芯片技术(又称多元流式点阵仪)和单项自身抗体精确检测的化学发光法。两种检测方法均为高精度、全自动化大型检测仪器,但其各有特点,前者一次检测项目最多达100多项,但其必须组合项目同时检测,对于初诊患者而言,确实可以通过多个疾病的自身抗体组合,很快检测出相关疾病的自身抗体,但其医疗成本较高,对于确诊患者,只需要检测单个或数个曾检测出的阳性自身抗体即可,这对于液相芯片而言,多项检测将造成资源浪费。随着医疗改革的推进,居民医疗将按疾病种类进行保险支付,可促使医院及医生进行精确检测节约医疗成本。若液相芯片单个检测无法降低成本的情况下,化学发光法将显示出其独特优势,可单个项目检测,且成本可控,因此,试剂仪器生产商将会对检测技术及检测成本进行竞争,让临床能够得到更多、更好的选择。
4 自身抗体检测标准及共识
标准或共识是专家对现状讨论分析后的操作建议。自身抗体检测共识的建立恰恰是因为自身抗体检测不规范、不统一、结果可比性差的现实背景下达成的一致意见。行业协会为提高检测质量及结果可比性做出了不懈努力。到目前为止,主要有两类常规自身抗体(ANA及ANCA)制定了部分规范。
4.1ANA检测规范 2014年欧洲自身免疫标准化促进会和自身抗体标准化委员会共同发表了《抗核抗体检测的国际建议》。2014年8月在第12届自身抗体和自身免疫国际研讨会议上,形成ANA荧光模型国际共识,提出关于ANA荧光模型标准化分类命名的国际共识。中国医师协会风湿免疫科医师分会自身抗体检测专业委员会于2018年在中华检验医学杂志上发表了中国ANA检测共识[24],主要建议包括:(1)推荐以HEp-2细胞为实验基质的IIF法是进行ANA检测的参考方法和首选方法;(2)建议ANA检测时,HEp-2细胞在实验基质中每显微镜视野(放大倍数为200倍)应可见3~5个有丝分裂细胞;(3)二抗应使用荧光素标记的抗人IgG抗体;(4)IIF法检测ANA的稀释方法可根据不同的检测试剂而采用倍比稀释系统或根号10稀释系统;(5)当临床高度疑诊时,不论ANA总抗体的检测结果如何,都需要对针对靶抗原的特异性自身抗体进行检测;(6)对ANA荧光模型做了相应要求,必报荧光模型包括:均质型、斑点型,细胞核致密斑点型、着丝点型、核点型、核仁型、胞浆颗粒型、线粒体型、高尔基体型、棒环状型、核膜型,肌动蛋白型。
4.2ANCA检测规范 近年来发表了ANCA检测共识[25-26],其主要意见如下:(1)当患者表现为肾小球肾炎(特别是快速进展的肾小球肾炎)、有系统特征的皮肤型血管炎,多个肺结节、上呼吸道慢性破坏性疾病、长期鼻窦炎或耳炎、声门下气管狭窄、多发性单神经炎或其他周围神经病变、眶后肿块、巩膜炎等需检测ANCA;(2)检测抗MPO抗体、抗PR3抗体的高质量方法应作为ANCA的筛查实验;(3)若抗MPO抗体、抗PR3抗体阴性,但临床高度怀疑小血管炎时,应推荐到有经验的实验室进行检测;(4)抗MPO抗体、抗PR3抗体阴性时,不能排除腺相关病毒(AAV);(5)抗MPO抗体、抗PR3抗体阳性有助于诊断AAV,但不能仅凭此诊断。
5 自身抗体检测的问题及发展方向
自身抗体检测结果在同质化和结果互认方面存在很大障碍,原因主要有以下两个方面,第一为试剂溯源问题,目前关于抗原试剂性能评价并无可以溯源参比的国际组织,因此,检测结果通常会出现抗体滴度强弱不等。当厂商试剂对比检测结果出现差异时,无法确定哪家试剂检测准确度较高,临床通常采用检测结果与临床疾病诊断符合率进行分析,这虽说是一种比较好的评价方法,但大多数自身免疫病的诊断标准多为多项指标综合判断,患者疾病异质性大,特别是要评价的自身抗体检测指标往往是辅助指标,自身抗体在疾病预示价值方面存在缺陷,该指标在增加灵敏度的同时必然会损失特异度,因此给临床和实验室造成巨大困难,这将是今后自身抗体检测面临的最大问题。第二为实验操作问题,目前多数自身抗体检测仍以手工操作或半自动仪器检测为主,检测结果仍受检测方法、检验试剂、检验仪器及实验人员的经验性等诸多因素影响,特别是荧光抗体检测受人为因素影响更大,包括荧光显微镜的质量、技术人员对图像的认识、荧光强度的感知、视力的好坏等。目前已有医院开始采用电脑图像采集,然后通过观察显示器上图像进行结果判读,这也带来新的问题,如各公司图像采集卡的质量和参数不同,显示器分辨率及显卡质量等存在很大差异,同一图像在不同条件下可以得出完全不同的结果,这一点值得实验室工作人员注意。
不久的将来,自身抗体检测将迎来短期粗犷的发展和长期规范的调整。随着自身抗体筛选新技术的广泛应用,将筛选出与各系统疾病有关的新型自身抗体,对于疾病诊断、鉴别诊断及发病机制的研究将提供重要的实验依据。此外,为了更好地将自身抗体检测结果应用于临床,并达到结果互认,建议国际国内行业协会等部门牵头制订试剂溯源及标准化操作规范,从顶层设计或行业强制标准的高度规范自身抗体检验的试剂生产商、检测实验室及临床医生应用行为。从发展的角度而言,自身抗体检测最终将实现全自动化、高通量、标准化和人工智能,从而显著提高自身抗体检测质量,实现不同实验室结果互认,提高实验室临床服务能力。

