PRODIGE 24-ACCORD研究解读
【简评】
PRODIGE 24-ACCORD研究应该说是2018年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上胰腺癌领域最吸引眼球的口头报告。该研究旨在比较改良的FOLFIRINOX三药方案对照单药吉西他滨在胰腺癌辅助治疗中的效果,令人振奋的不仅在于主要终点无疾病生存期(disease-free survival,DFS)接近1倍的提高(21.6个月vs12.8个月),也在于所有研究者更为看重的次要终点之一总生存期(overall survival,OS)的大幅度提高(54.4个月vs35.0个月)。
该研究是胰腺癌领域首项OS超过50个月的研究,也是胰腺癌研究领域OS最长的研究。它夯实了改良的FOLFIRINOX三药方案在胰腺癌治疗中的坚实地位,也无愧于N Engl J Med点评之“胰腺癌的一线希望”。然而兴奋之余,仍有以下问题需要我们冷静思考:
⑴横向比较CON-001、ESPAC04、JASPAC01和PRODIGE 24-ACCORD等多项胰腺癌辅助治疗的研究,可以看出无论对照组和治疗组如何设置,各研究中吉西他滨单药组的DFS或无复发生存期(recurrence-free survival,RFS)稳定在11~13个月,由此间接证实了PRODIGE 24-ACCORD研究具有相当的代表性;而不同的是,PRODIGE 24-ACCORD研究中,两组的OS均较以往研究有了明显的延长,特别是吉西他滨单药组的OS达到了空前新高,可想而知,OS的延长主要得益于进展后一线治疗方案的进步。如吉西他滨组75.8%的患者复发或转移后应用了FOLFIRINOX方案,而三药组复发或转移后也有白蛋白结合型紫杉醇联合吉西他滨的方案选择;那么,改良的三药方案的优势究竟是在于辅助治疗还是晚期的一线治疗,三药组OS的延长是得益于晚期一线治疗还是辅助治疗,都是值得思考和进一步探究的问题。
⑵在本项研究报道之前,日本的JASPAC01是最为瞩目的胰腺癌辅助治疗的研究,术后仅应用S-1(替吉奥)单药就获得了不劣于甚至优于吉西他滨单药的OS数据,且两组的不良反应相似;而本项研究中,尽管三药方案较吉西他滨无论DFS还是OS都有了大幅的提高,但相应的骨髓抑制、周围神经毒性、恶心呕吐、腹泻及黏膜炎等多项不良反应的发生率均显著增加。那么在临床实践中,一个是单药口服不良反应较轻、依从性较好的辅助治疗方案,另一个是三药静脉输注且不良反应的发生率较高,DFS或RFS相似,但OS有一定优势的方案,又该如何选择?试想,在亚洲人群中,S-1单药对照改良的FOLFIRNOX辅助治疗胰腺癌术后患者的临床研究又会是怎样的结果?
⑶胰腺癌的治疗尽管有了一线曙光,但与其他瘤谱的靶向及免疫治疗时代仍有很遥远的距离,毕竟我们还停留在化疗时代。正如Kindler教授对该研究的点评中所说,是否术后给予6个月的辅助化疗就是适合的治疗顺序?是否术前给予改良的三药方案能够进一步提高生存率?三药方案是否可降低切缘阳性者的局部复发率?放疗在这类患者围手术期治疗中的地位又是如何?胰腺癌的化疗时代仍有很多临床问题需要进一步的前瞻性临床研究来回答,期待中国学者能为胰腺癌的治疗提供更多的证据。
本期分享的是2018年12月在N Engl J Med上发表的PRODIGE 24-ACCORD研究,旨在比较改良FOLFIRINOX方案(mFOLFIRINOX,即伊立替康+奥沙利铂+亚叶酸钙+氟尿嘧啶)和吉西他滨单药方案在胰腺癌辅助治疗中的疗效和安全性[1]。
1 研究背景
胰腺癌被称为“癌中之王”。虽然胰腺癌并不是最常见的恶性肿瘤,全球每年发病人数约46万,发病率为4.8/10万,发病率在各类恶性肿瘤中排第15位。但是每年死亡人数约43万,死亡率为4.4/10万,几乎和发病率相当,在各类肿瘤死亡率排名中上升至第9位[2]。全球大部分国家的胰腺癌5年生存率不足10%[3],出诊时能够手术切除的患者只占20%。术后无辅助化疗的患者中位复发时间为6个月,即使接受辅助治疗后大部分患者的总生存期(overall survival,OS)仍短于3年。
对于胰腺癌的治疗,手术切除是潜在根治胰腺癌的唯一手段。根据是否手术切除可以将胰腺癌大致分为可切除、临界可切除和不可切除几类。对于临界可切除和不可切除的胰腺癌患者以化疗为主,尽可能争取手术切除的机会。可切除的胰腺癌患者首选手术治疗,而辅助化疗或辅助放化疗是术后治疗必不可少的一部分(图1)。
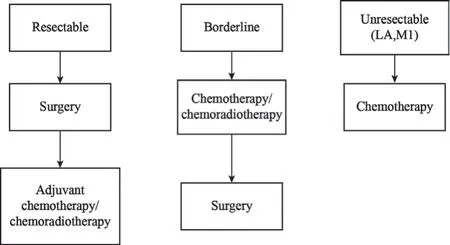
图1 胰腺癌治疗框架Fig.1 Treatment framework of pancreatic cancer
回顾胰腺癌辅助治疗研究的变迁:2001年ESPAC-1是胰腺癌辅助治疗的研究,采用氟尿嘧啶单药辅助化疗对比单纯手术治疗,结果显示,OS和5年生存率有明显获益[4];2007年CONKO-001研究结果显示,吉西他滨单药辅助化疗对比单纯手术OS和无病生存期(disease-free survival,DFS)也有明显的延长[5]。之后的研究对比氟尿嘧啶单药和吉西他滨单药的效果差异。RTOG 9704和ESPAC3结果显示,提示氟尿嘧啶单药和吉西他滨单药的效果不分伯仲[6-7]。2016年日本发表的JASPAC1研究,在胰腺癌辅助治疗中对比吉西他滨与替吉奥(氟尿嘧啶类口服衍生物)的疗效,结论是替吉奥明显优于吉西他滨,中位OS分别为46.5和25.5个月,存在明显获益[8]。但是该研究结果争议很大,且替吉奥在西方并未被广泛推广,因此替吉奥并不被美国国立综合癌症网络 (National Comprehensive Cancer Network,NCCN)等指南推荐(图2)。
因此,目前的指南推荐基本仍以吉西他滨单药和氟尿嘧啶单药作为辅助化疗的基石。随着其他研究的推进,研究者也在寻找有效率更高的辅助治疗方案,包括免疫治疗、联合化疗和靶向治疗。免疫治疗基本在晚期胰腺癌一、二线的研究中均宣告失败,靶向治疗厄洛替尼联合吉西他滨单药化疗的方案在不可切除胰腺癌的临床研究中,获得了0.3个月的生存期获益(P=0.038)[9],这是很典型的差异有统计学意义而并没有实际临床意义的研究。厄洛替尼在CONKO 005研究中也被推至辅助治疗中,不出意外,这是个阴性的结果[10]。
在联合化疗当中,ESPAC4研究结果显示,吉西他滨联合卡培他滨对比吉西他滨单药,取得了3个月的临床OS获益[11]。虽然这个结果作为Ⅰ类证据写入了NCCN胰腺癌指南的辅助治疗方案选择,但并没有撼动吉西他滨单药和氟尿嘧啶单药在胰腺癌辅助治疗中的地位[12]。
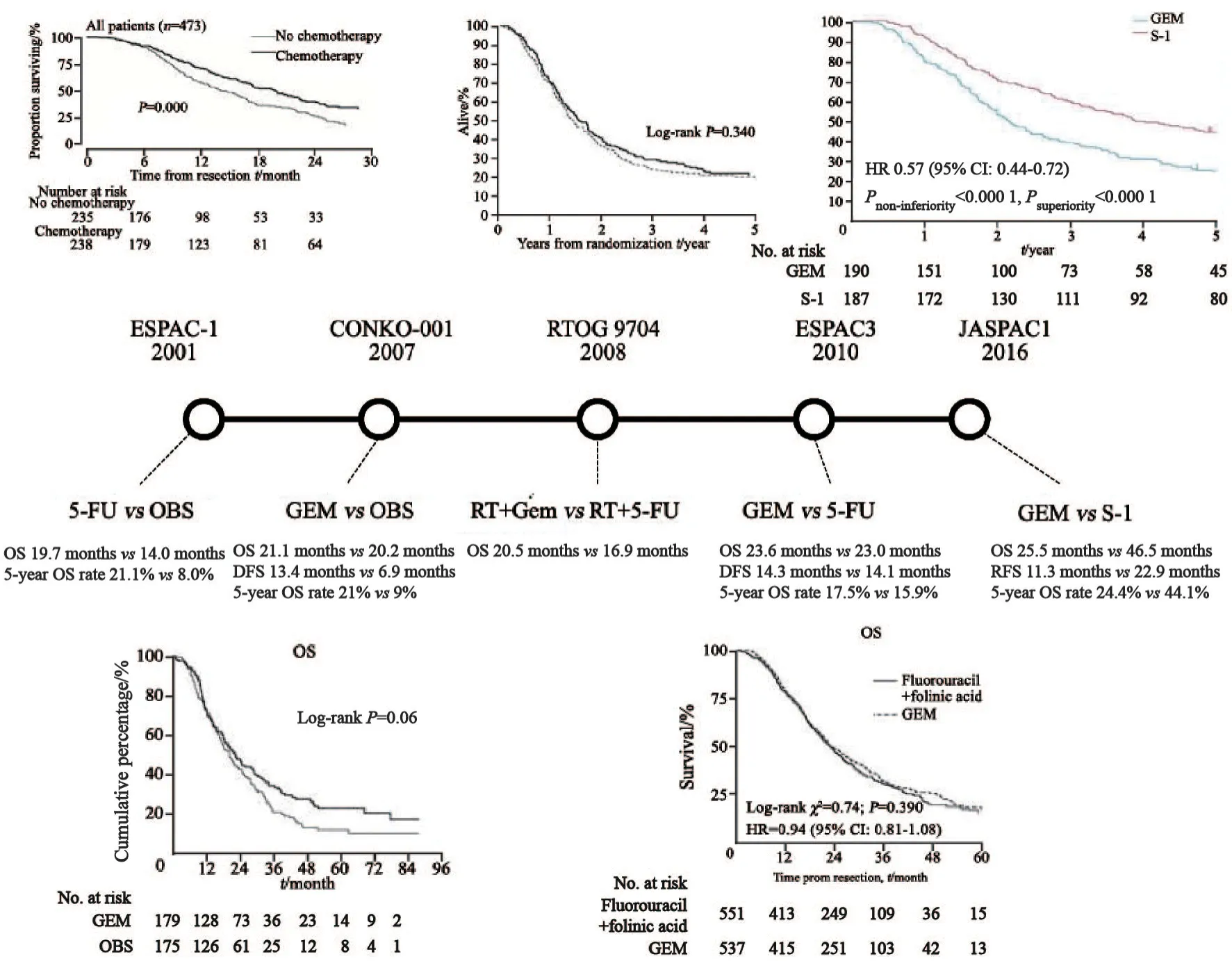
图2 胰腺癌辅助治疗研究变迁Fig.2 Transition of pancreatic cancer adjuvant treatment
能否借鉴晚期胰腺癌的化疗方案呢?晚期胰腺癌中非常有名的PRODIGE研究和MPACT研究,分别关于FOLFIRINOX方案对比吉西他滨单药[13]和吉西他滨联合白蛋白结合型紫杉醇对比吉西他滨单药[14],这两项研究都获得了显著性差异的结果。FOLFIRINOX方案及吉西他滨联合白蛋白结合型紫杉醇方案都成为晚期胰腺癌的一线治疗。既然在晚期胰腺癌当中有显著效果,这样的联合化疗方案是否能推至辅助治疗中?该研究探讨的是改良和FOLFIRINOX方案对比吉西他滨单药在胰腺癌辅助治疗中的疗效和安全性。
2 研究设计
该研究是研究者发起的多中心、随机对照、开放标签的Ⅲ期临床试验,优效性设计涉及到法国和加拿大的77个中心。随机化是采用独立的基于网络的中央随机化系统,采用1∶1设计;分层因素包括了不同中心、切除状态(R0或R1)、是否有淋巴结转移(pN0或pN1),对无淋巴结转移的患者还进一步区分淋巴结检查数是否≥12。主要研究终点为DFS;次要研究终点包括OS、肿瘤特异生存、无转移生存率和不良反应。不良反应的标准参照美国国家癌症研究所(National Cancer Institute,NCI)发布的常见不良反应术语评定标准(common Terminology Criteria for Adverse Events,CTCAE)4.0版本。
该研究如果按照方案中的标准入组3年、观察3年总共6年的参数计算,预计3年DFS从17%提高至27%,危险比(hazard ratio,HR)估计为0.74,需要事件数346例,样本量是390例。而方案中计算的事件数相仿,为342例,但是考虑到失访等因素,样本量最终被设定为490例。
该研究的入排标准中,只纳入胰腺导管癌患者,排除了R2切除的患者,本研究将入组的患者年龄放宽到了79岁,纳入年龄是18~79岁。入组标准里还包括了术前未接受过放化疗、需要在术后3~12周接受放化疗的患者,排除了CA19-9>180 U/mL的、有转移的或有既往癌症史的患者。考虑到新方案在血液学、周围神经和消化系统上的毒性强,血液学、肝肾功能要求患者达标,排除存在神经病变、结直肠闭塞、严重腹泻及果糖不耐受的患者。
该研究是一种毒性更大的联合治疗方案对比常规治疗在胰腺癌辅助治疗中的尝试,因此对于药物不良反应的监测非常关键。研究过程中是否需要调整剂量?万一出现了严重的不良反应是否该继续试验?该研究对30例患者先进行2个周期的治疗(伊立替康初始剂量采用180 mg/m2),如果3~4级腹泻发生率不超过5%,可以维持180 mg/m2,否则需要降低剂量至150 mg/m2。而对于严重不良反应的监测,虽然多阶段设计和成组序贯设计已被广泛用于各类试验确定终止原则,但是都依赖于入组固定数量患者之后进行的期中分析。由于严重不良反应可能发生在早期阶段,在入组固定数量患者后再进行期中分析在伦理上实际是存在问题的[15]。因此需要进行连续监测,包括了α消耗法、Pocock法和O’Brien-Fleming法二项式概率界值法[16]。本研究在终止规则参数取α=10%,r=4。如果出现了2例因不良反应导致的死亡,并且出现在前9例入组的患者中,那么应立即终止试验,以此类推(表1)。

表1 PRODIGE 24-ACCORD研究因严重不良反应终止规则Tab.1 PRODIGE 24-ACCORD research termination rules based on toxic deaths(n)
治疗方案中,吉西他滨单药组采用吉西他滨1 000 mg/m²;联合化疗组采用奥沙利铂85 mg/m²、亚叶酸400 mg/m²、伊立替康150 mg/m²、氟尿嘧啶2.4 g/m²的方案。两组均治疗24周,之后的随访为2年内每3个月进行肿瘤和CA19-9的评估,2年之后每6个月进行肿瘤和CA19-9的评估(图3)。

图3 治疗和随访流程Fig.3 Treatment and follow-up procedures
本研究中设置了1次期中分析:当发生1/3事件数(即113个事件时)进行期中分析。根据O’Brien-Fleming法设计的规则,终止试验条件被设为有效终止(P≤0.000)、无效终止(P≥0.970)。预计开始入组后约2年时(300例入组时)进行。本研究的分析数据集当中,疗效相关结局评价使用意向性治疗(intention-totreatment,ITT)集。ITT集是基于想要接受治疗的受试者(即计划好的治疗进程),而不是基于实际给与的治疗措施为基础进行评价,在优效性设计的研究中结果通常比较保守。而符合方案(per protocol,PP)集仅对完成执行研究方案的受试者进行分析,剔除了中途退出者,通常会夸大两组间的差异,因此本研究未使用。本研究对于安全性相关结果使用安全集的患者人群,安全集指至少接受1次治疗,且有安全性指标记录的实际数据,不良反应发生率以安全集病例为分母。
3 研究结果
该研究最终纳入分析ITT集的两组分别为247和246例患者,安全集分别为238和243例(图4)[1]。在ITT人群中,两组的基线情况基本均衡。主要研究终点DFS为21.6个月vs12.8个月(HR=0.58,95% CI:0.46~0.73)。次要研究终点OS为54.4个月vs35.0个月(HR=0.64,95%CI:0.48~0.86),无转移生存时间和肿瘤特异性生存时间差异均有统计学意义(图5)[1]。因此主要研究终点和次要研究终点都达到了统计学上的显著性要求。
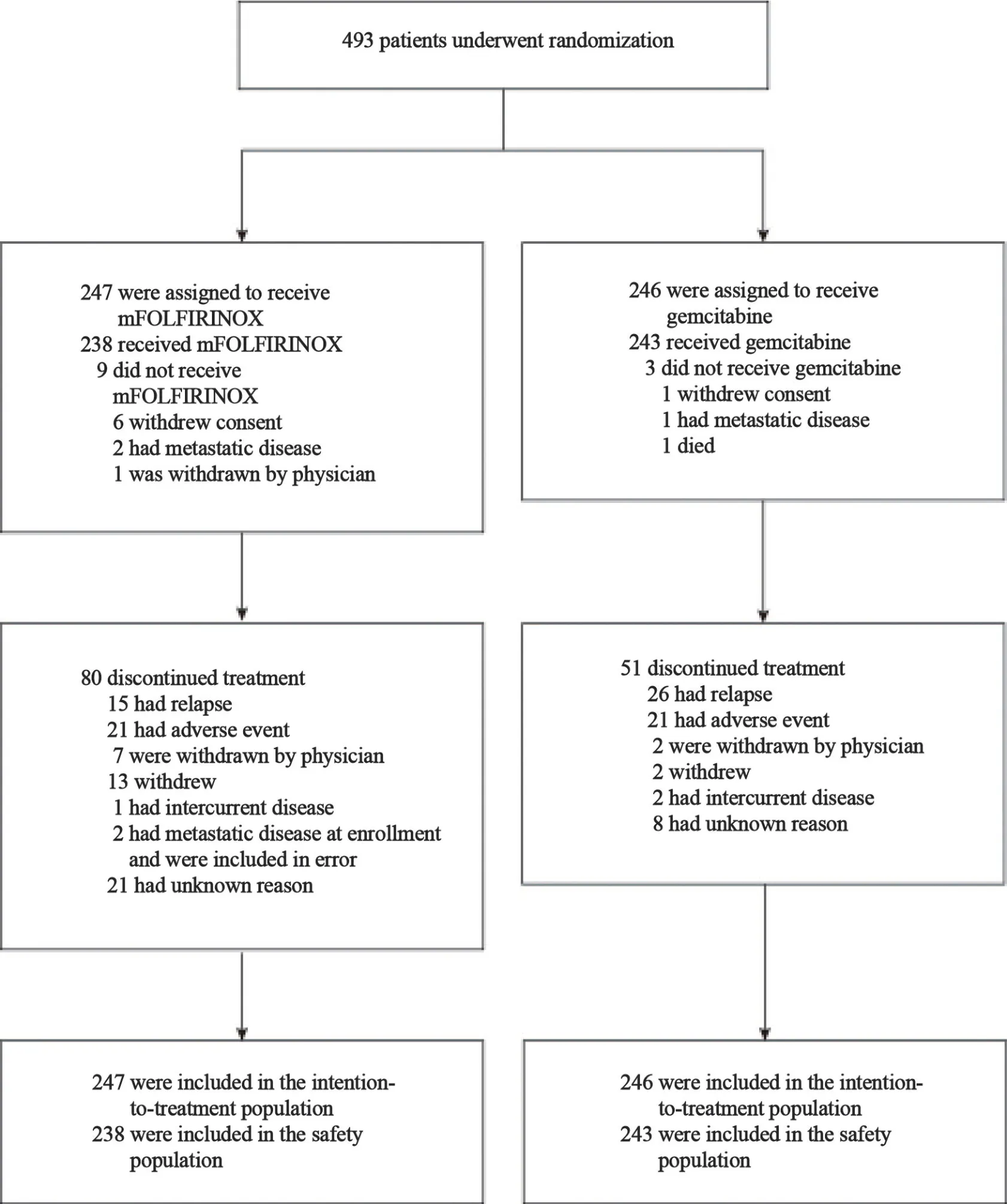
图4 患者的随机化和治疗情况Fig.4 Randomization and treatment of the patients
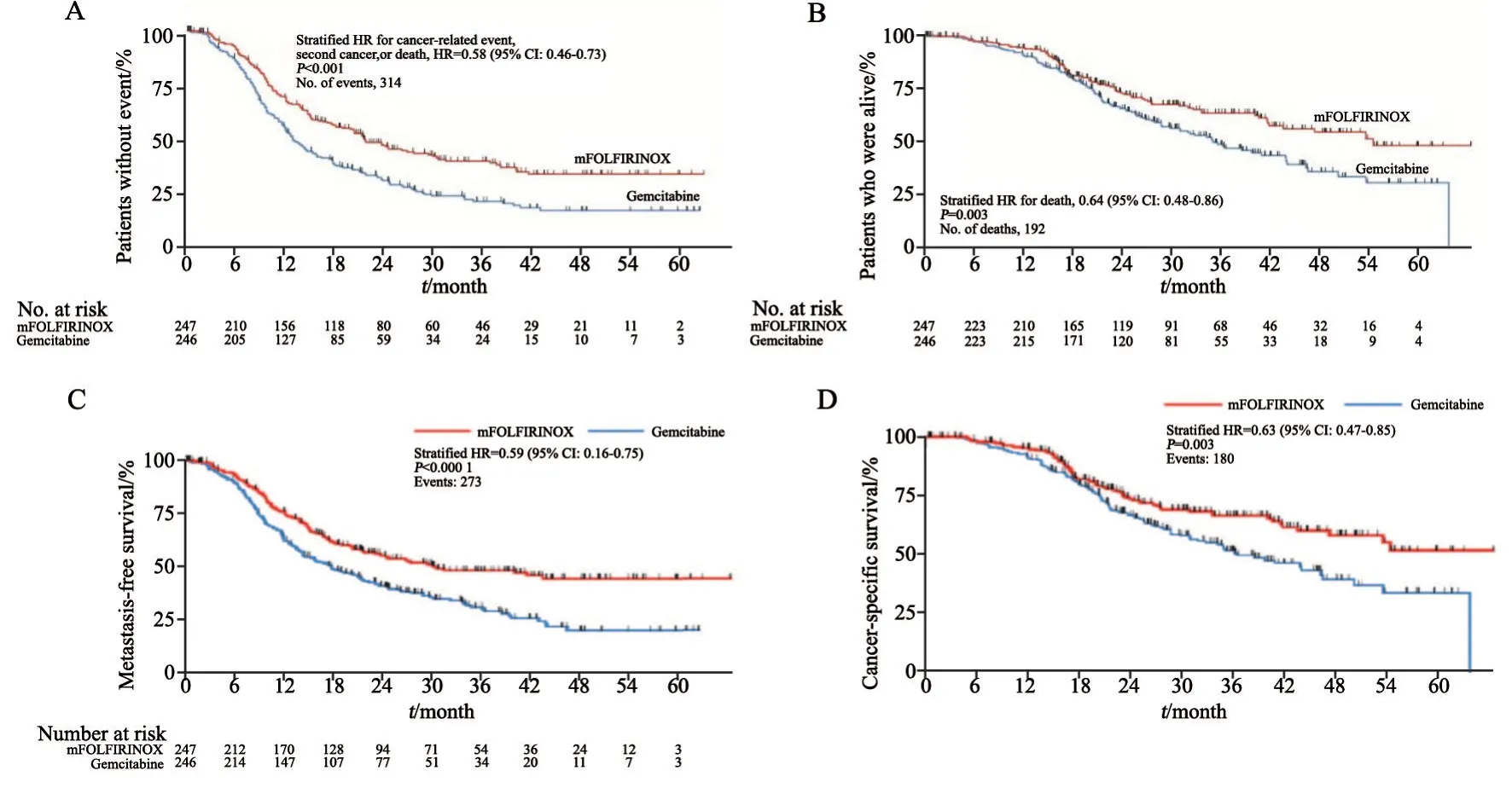
图5 mFOLFIRINOX与吉西他滨组DFS率、OS率、无转移生存率及肿瘤特异性生存率Fig.5 Comparison of DFS,OS,metastasis-free survival and cancer-specific survival between mFOLFIRINOX and gemcitabine groups
分层分析研究结果显示,mFOLFIRINOX方案在T3或T4,N+或R1切缘等不良预后因素亚组中仍有获益。但是在分化程度差、上静脉切除及CA19-9>90 U/mL这3个不良预后的亚组中,差异无统计学意义,可能是由于这3个亚组的患者数比较少导致可信限过宽进而未显示出统计学意义(图6)[1]。
较好的疗效是以较重的不良反应为代价的。对比吉西他滨单药方案3/4级不良反应的发生率为54.9%,mFOLFIRINOX方案的发生率为75.9%,显著高于吉西他滨单药方案。主要的不良反应除了血液学相关的不良反应外,非血液学相关的不良反应有腹泻、肝功能异常、乏力、周围神经毒性、恶心呕吐、腹痛及黏膜炎;在血液学毒性中,除了血小板减低这一不良反应发生率是吉西他滨组比mFOLFIRINOX组有所升高,其他的不良反应发生率都是mFOLFIRINOX组明显升高;两组3/4级中性粒细胞减少事件发生率相似(28.4%vs26.0%),但是mFOLFIRINOX组的预防性使用粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)的患者比例明显升高(62.2%vs3.7%)。伊立替康特异性的腹泻也存在明显差异,即使mFOLFIRINOX组已经将伊立替康的剂量降至150 mg/m2,3/4级腹泻发生率也有18.6%,而吉西他滨组只有3.7%(表2)[1]。
该研究也对预后的影响因素进行了单因素和多因素的分析。单因素分析结果显示,治疗方案、肿瘤分级、淋巴结状态、分期、切缘是否阳性及门静脉的切除是对预后有影响的。研究者采用逐步回归的方法得出,治疗、肿瘤的分级及门静脉切除是3个独立的预后因素(表3)。
4 讨论与思考
该研究结果显示,mFOLFIRINOX组有明显的生存获益。那本研究中吉西他滨组的疗效和既往研究中吉西他滨的疗效是否存在差异?该研究中,吉西他滨组中位DFS(12.8个月)与其他既往研究结果(11.0~13.0个月)类似,但中位OS在吉西他滨组(35个月)明显长于既往研究(20~26个月,表4)。可能是因为吉西他滨组75.8%的患者在复发后使用了FOLFIRINOX方案,由于FOLFIRINOX方案在晚期胰腺癌中的获益优势明显,这一批患者的OS相比既往研究有了很大提升(表5)。
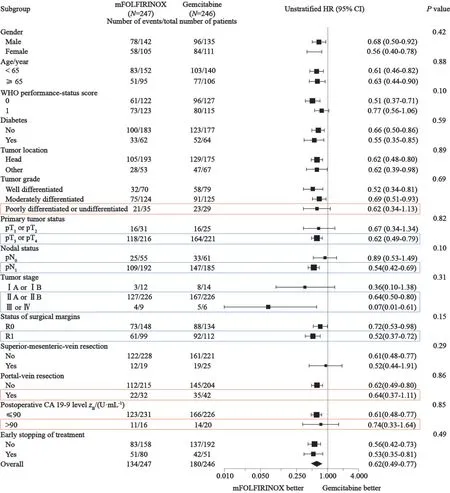
图6 治疗获益的影响因素Fig.6 Factors influencing treatment benefit
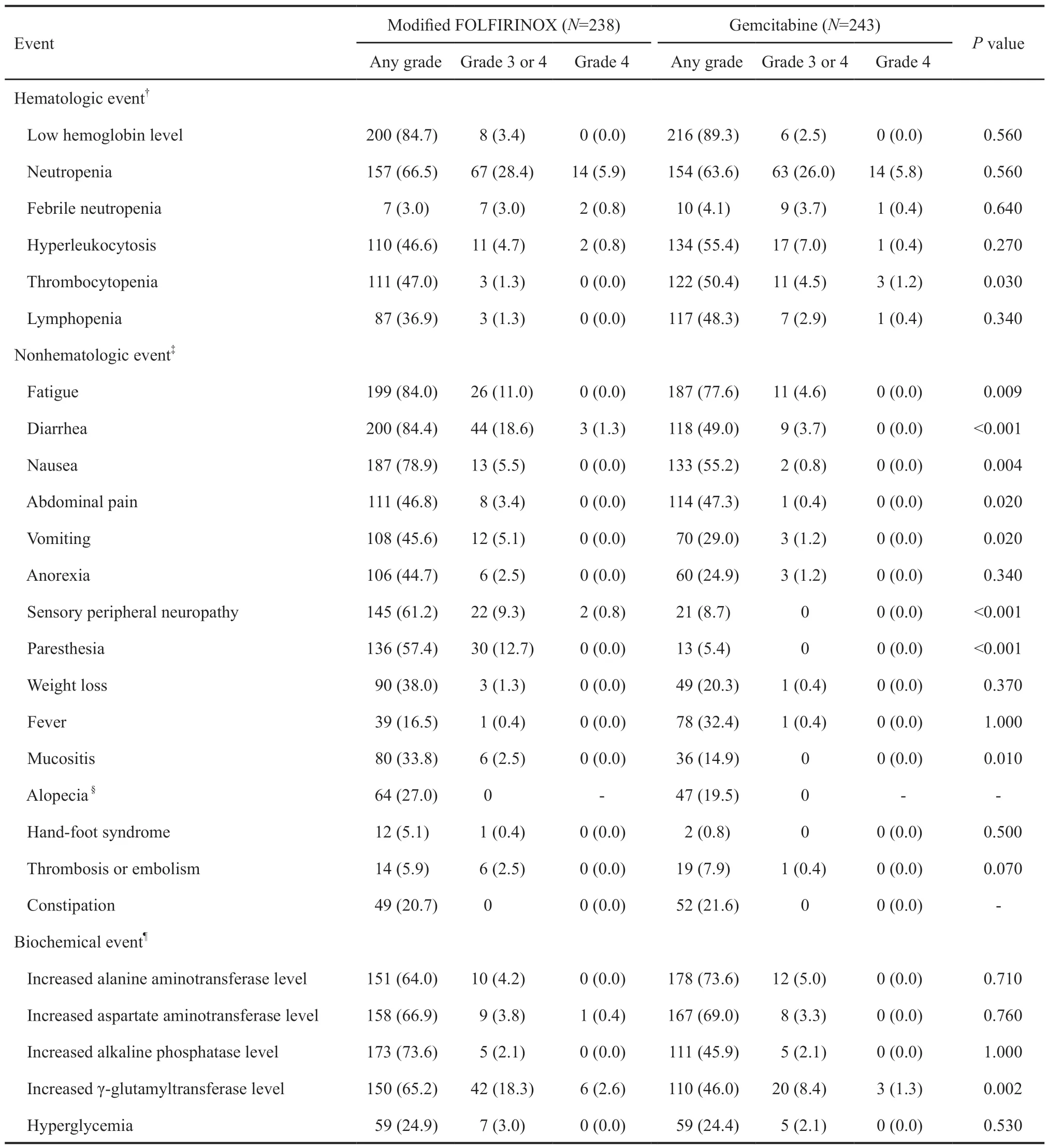
表2 治疗期间的不良反应Tab.2 Adverse events during treatment*[n (%)]
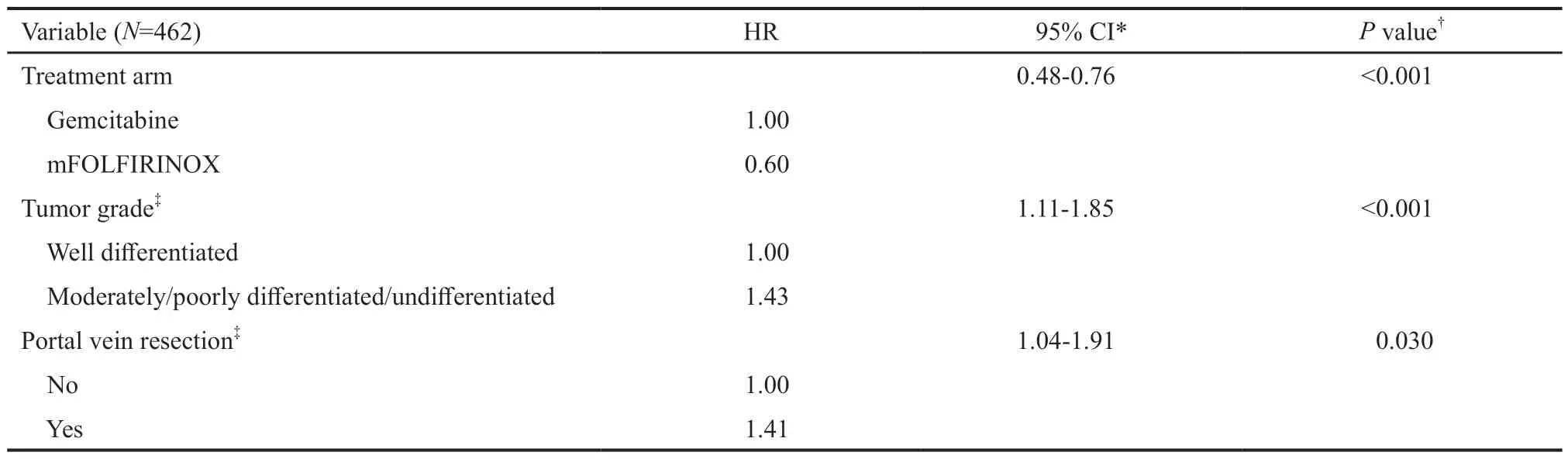
表3 DFS影响因素多因素分析结果Tab.3 Multivariate analysis of prognostic factors for DFS

表4 吉西他滨组用药在不同研究中的DFS与OSTab.4 DFS and OS of gemcitabine group in different studies

表5 PRODIGE 24-ACCORD研究胰腺癌患者复发后治疗方案Tab.5 Treatments after relapse of pancreatic cancer in PRODIGE 24-ACCORD research*[n (%)]
改良方案的不良反应分析:mFOLFIRINOX方案的不良反应发生率较吉西他滨单药组明显增加,但研究者认为在可控范围内。有趣的是,该研究将受试者的年龄上限提高到79岁,结果显示,不良反应发生率在<70岁组和≥70岁组之间差异无统计学意义。mFOLFIRINOX方案的应用主要应该基于患者的体力状况评分及合并症,而不应该仅基于年龄分组[17]。因此即使对老年患者,如果体力状况较好并且合并症较少,也可以尝试使用mFOLFIRINOX方案。
另外,mFOLFIRINOX方案和标准的FOLFIRINOX方案之间的对比,背景里提到转移性胰腺癌的PRODIGE研究中应用的是标准剂量,PRODIGE研究和该研究虽是同一个研究中心发起的,但该研究使用的剂量是改良剂量。在亚组分析中也提到,改良方案和标准方案生存获益相似,但不良反应发生率有非常明显的下降,体现在3/4度中性粒细胞减少的病例明显下降(PRODIGE为46%,本研究为28%),并且伊立替康相关腹泻明显减少。伊立替康相关腹泻与剂量、术中清扫淋巴结数量及人种明显相关。
由于不良反应,两组人群中能够完成所有周期的患者,mFOLFIRINOX组为66.4%,低于吉西他滨组的79.0%。另外,在剂量强度方面,大于0.7的mFOLFIRINOX组不到50%的患者,而吉西他滨组可以达到90%以上。提示mFOLFIRINOX较严重的不良反应是患者无法完全依从方案的重要原因(表6)。
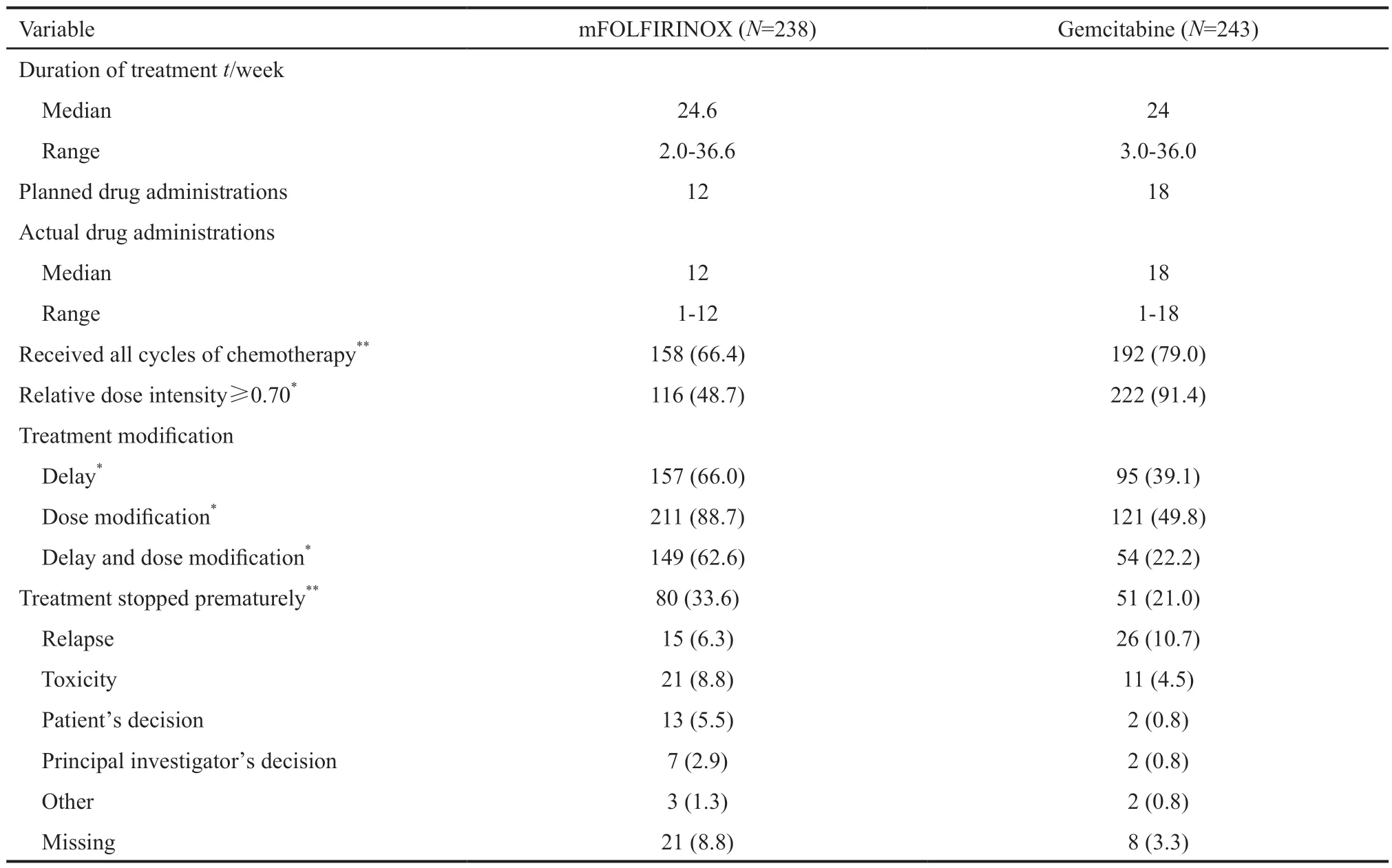
表6 安全集患者治疗暴露情况Tab.6 Treatment exposure in the safety population[n (%)]
该研究并未完成所有的DFS事件数,在DFS成熟度91.8%时应伦理委员会推荐提前报道数据,其OS数据仍不成熟,61%的患者分析时仍存活。中位随访时间为33.6个月,过长时间的随访结果可能不够稳定可靠。有待数据成熟后进一步分析结果。
前面我们也提到过研究终点的选择,DFS是否能更好地代表OS?从本研究来看,OS和DFS的获益方向是一致且稳健的。OS结果与后线治疗效果有关系,通常DFS在效应上比OS显著,但是该研究由于DFS的获益非常显著,预计OS的获益也会较为明显。
本研究有一部分是探索预后影响因素。先列出单因素分析,选出P<0.200的因素,通过逐步回归筛选,可作为探索性结果,但是不应机械采用筛选结果,应结合先验知识综合建模。
5 总结
作为研究者发起的临床试验,试验设计较为完善。mFOLFIRINOX方案对比吉西他滨单药在DFS上有显著获益,中位DFS分别为21.6个月和12.8个月(P<0.001,HR=0.58);尽管OS数据成熟度较低,但是总体来看还是有显著获益的,中位OS分别为54.4和35.0个月(P=0.003,HR=0.64)。由于DFS获益明显,预计OS数据成熟后仍有显著获益。疗效好的代价是不良反应发生率高,3/4级不良反应发生率分别为75.9%和52.9%,尤其在腹泻和周围神经毒性方面,该方案是以不良反应换疗效的方案。mFOLFIRINOX方案的不良反应在<70岁组和≥70岁组差异无统计学意义,提示体力状况较好并且合并症较少的70岁以上患者亦可以尝试使用mFOLFIRINOX方案。180和150 mg/m2的伊立替康剂量对DFS结果无显著影响。多因素分析显示,不同治疗方案、肿瘤分级及门静脉切除是影响DFS的3个独立因素,但是该结果为探索性分析的结果,看待时仍需谨慎。

