VitD/VDR与乳腺癌患者免疫状态、临床特征及预后的相关性研究
殷隽逸,王雅灵,胡海燕
上海交通大学附属第六人民医院肿瘤内科,上海 200233
维生素D(vitamin D,VitD)是一种类固醇激素,其经典功能是调节血清钙磷浓度和骨代谢,同时有助于维持免疫、神经和肌肉的正常功能。VitD可诱导细胞凋亡、刺激细胞分化、抑制肿瘤增殖、侵袭、转移并抗血管生成[1-2]。已有研究表明,循环25-羟基VitD[25-hydroxy VitD,25(OH)D]与VitD受体(VitD receptor,VDR)相互作用发挥抗癌效应[3]。25(OH)D是VitD的活性代谢产物,可反映体内VitD的储备量。乳腺癌是女性常见的恶性肿瘤之一,也是导致女性死亡的主要原因。本研究通过对乳腺癌患者、乳腺良性肿瘤患者及健康体检者的外周血25(OH)D水平进行检测,分析乳腺癌患者外周血25(OH)D水平与乳腺癌患者T细胞免疫功能(CD4+/CD8+)、NK细胞水平、肿瘤大小、临床分期、是否淋巴结转移、是否骨转移、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)是否阳性的相关性。同时通过免疫组织化学方法检测乳腺癌组织中VDR的表达,分析其与乳腺癌临床特征的相关性,以探究VitD/VDR途径在乳腺癌发生、发展中所发挥的作用。
1 资料和方法
1.1 一般资料
随机选取2015年1月—2018年7月上海交通大学附属第六人民医院收治的乳腺癌患者109例为乳腺癌组,年龄为31~79岁。所有患者均经术后病理确诊,患者信息完整,术前未行放疗、化疗及内分泌治疗,也未服用VitD补充剂及钙调节剂。选取同期经病理确诊的乳腺良性肿瘤患者50例为乳腺良性肿瘤组,年龄为26~71岁。在同期来上海交通大学附属第六人民医院体检中心进行体检的人群中随机抽取2 000名健康体检者作为对照组,并确认无肿瘤、高血压、糖尿病及冠心病等慢性疾病史。
1.2 样品制备
乳腺癌组、乳腺良性肿瘤组及对照组受检者抽取空腹静脉血5 mL待检测。乳腺癌组织标本均来源于手术和穿刺活检,标本于4%多聚甲醛溶液中固定后石蜡包埋,每个石蜡标本连续切片5张,切片厚度为4 μm。
1.3 方法
采用电化学发光法检测109例乳腺癌患者、50例乳腺良性肿瘤患者及2 000名健康体检者的外周血25(OH)D的水平。化学发光分析仪、总25(OH)D检测试剂盒及配套校准品均购自瑞士Roche公司。将所采集的受试者空腹静脉血静置30 min,然后以3 000 r/min离心10 min,分离血清后及时上机检测25(OH)D水平,检测原理为竞争原理,检测范围为3.00~70.00 ng/mL。
使用Beckman Coulter Navios流式细胞仪检测乳腺癌患者外周血中T细胞亚群、NK细胞水平,各流式管中加入100 μL抗凝血并将20 μL的荧光单克隆抗体CD3-FITC/CD(16+56)-PE、CD4-FITC/CD8-PE分别加入其中,充分混匀后,室温下避光温育15 min;每管加入500 μL红细胞裂解液OptiLyse C,涡旋混匀,室温避光温育10 min后加入2 mL PBS,涡旋混匀后1 500 r/min离心5 min,弃去上清液;加入500 μL PBS重悬后上机检测。NK细胞水平以NK细胞占淋巴细胞比例表示,检测CD4+/CD8+的比值,当CD4+/CD8+<1.4时为免疫力低下。
采用SABC免疫组织化学法对乳腺癌组织VDR的表达进行检测,步骤参照说明书,以TBS为一抗作为空白对照,以已知VDR阳性表达的乳腺癌组织作为阳性对照。兔抗人VDR单克隆抗体和免疫组织化学试剂盒均购自武汉博士德生物工程有限公司。免疫组织化学结果判定使用组织学评分法,细胞质中若出现粽色颗粒为阳性细胞,采用阳性细胞百分比及阳性细胞染色强度相结合的方法进行评分,每例患者切片均观察10个高倍视野(×400),着色细胞计数比例<5%为0 分,5%~2 5%为1 分,2 6%~5 0%为2 分,51%~75%为3分,76%~100%为4分。染色强度无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者相乘,0~1分为阴性,≥2分为阳性。
1.4 统计学处理
2 结 果
2.1 乳腺癌组、乳腺良性肿瘤组与对照组外周血25(OH)D水平比较
乳腺癌组外周血2 5(O H)D 水平为(1 8.0 0±6.9 3)n g/m L,低于乳腺良性肿瘤组[(2 6.7 6±8.5 6)n g/m L]和对照组[(27.03±8.95)ng/mL],差异有统计学意义(P<0.05),乳腺良性肿瘤组与对照组外周血25(OH)D水平无明显差异(P>0.05,图1)。
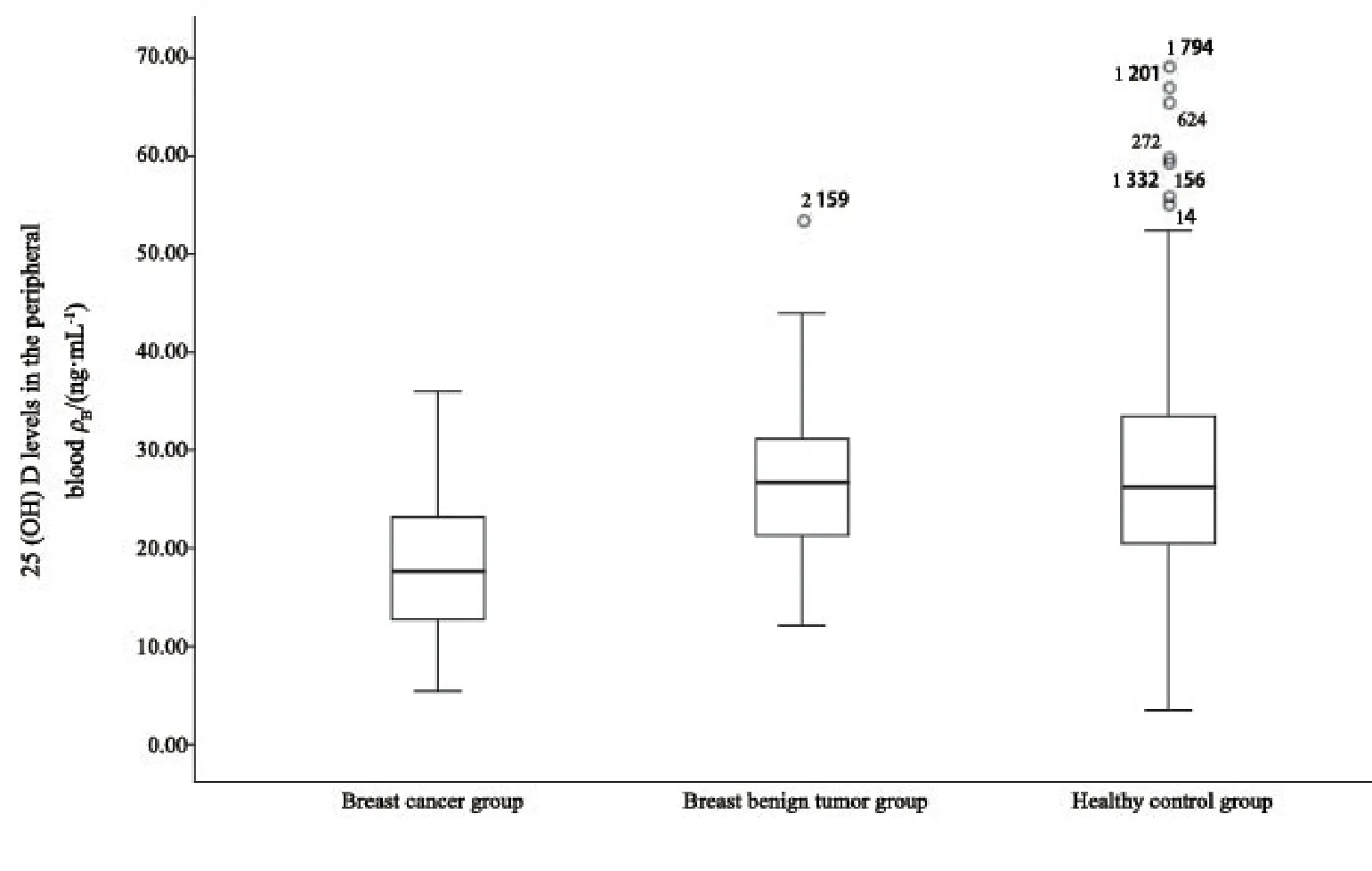
图1 三组研究对象外周血25(OH)D水平比较Fig.1 Comparison of 25 (OH) D levels in peripheral blood of subjects in three groups
2.2 乳腺癌患者外周血25(OH)D与临床特征的关系
乳腺癌患者中,T细胞免疫功能缺陷的患者外周血25(OH)D水平显著低于T细胞免疫功能正常的乳腺癌患者,差异有统计学意义(P<0.05),Ⅰ、Ⅱ期患者与Ⅲ、Ⅳ期患者相比,Ⅰ、Ⅱ期患者外周血25(OH)D水平显著高于Ⅲ、Ⅳ期患者,差异有统计学意义(P<0.05)。淋巴结转移患者外周血25(OH)D水平显著低于淋巴结未转移的患者,差异有统计学意义(P<0.05)。乳腺癌骨转移患者外周血25(OH)D水平显著低于未发生骨转移患者,差异有统计学意义(P<0.05)。PR阳性的乳腺癌患者外周血25(OH)D水平高于PR阴性患者,差异有统计学意义(P<0.05)。但外周血25(OH)D水平与肿瘤大小、ER表达无显著相关性(P>0.05,表1)。
2.3 乳腺癌患者外周血25(OH)D水平与NK细胞水平的关系
乳腺癌患者VitD缺乏组和VitD正常组NK细胞水平比较,差异无统计学意义(P>0.05,表2)。
2.4 乳腺癌VDR的表达与乳腺癌患者的临床特征的关系
乳腺癌组织中VDR的表达与乳腺癌患者T细胞免疫功能、临床分期、肿瘤大小、淋巴结转移、骨转移无显著相关性(P>0.05),而与患者ER、PR是否阳性具有显著相关(P<0.05,表3,图2)

表1 乳腺癌患者外周血25(OH)D水平与患者临床特征的关系Tab.1 Relationship between peripheral blood 25 (OH) D level and clinical features of patients with breast cancer

表2 乳腺癌患者外周血25(OH)D与外周血NK细胞水平Tab.2 25 (OH) D and level of NK cells in peripheral blood of breast cancer patients
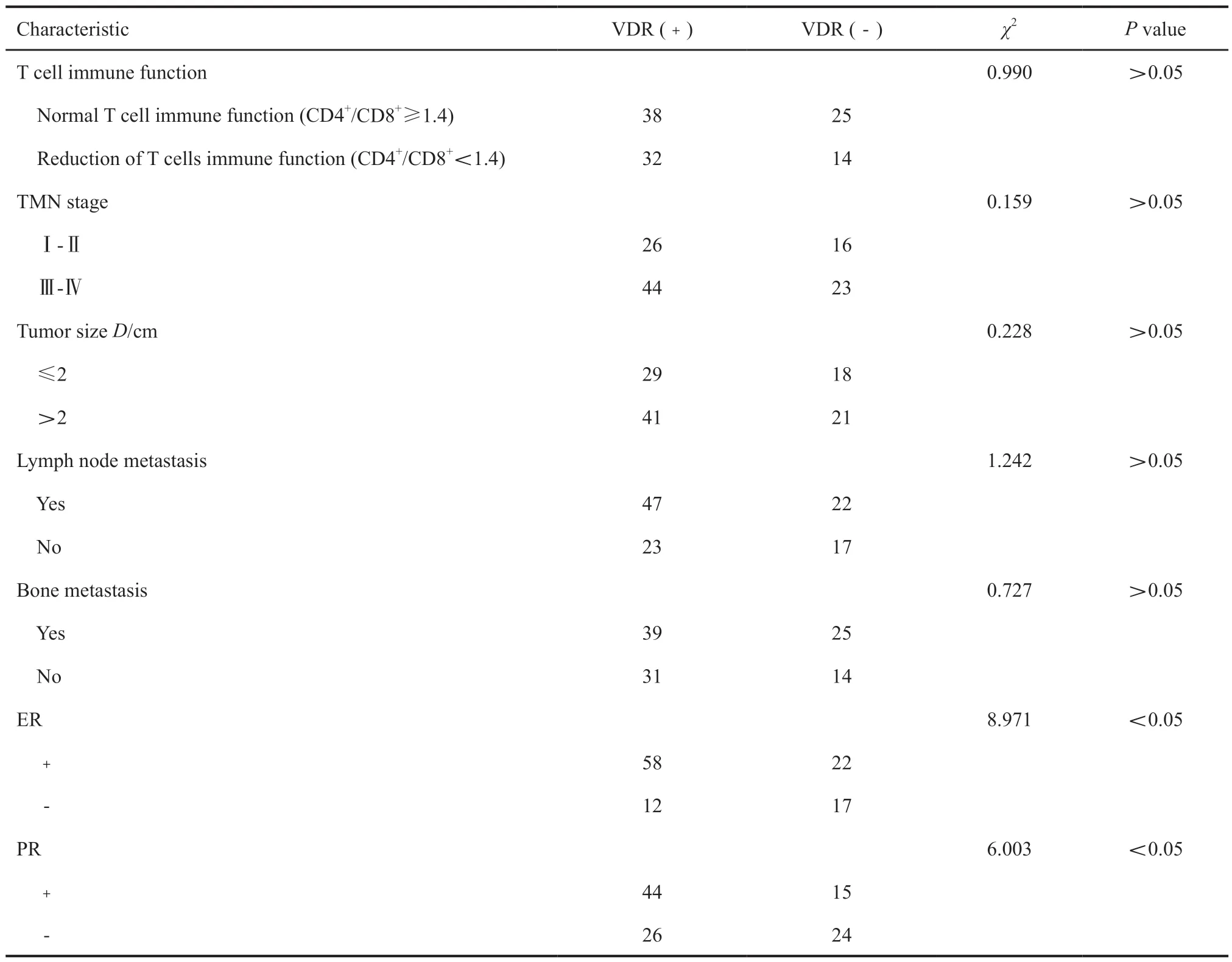
表3 乳腺癌VDR的表达与乳腺癌患者的临床特征的关系Tab.3 Relationship between expression of VDR in breast cancer and clinical features of breast cancer patients (n)
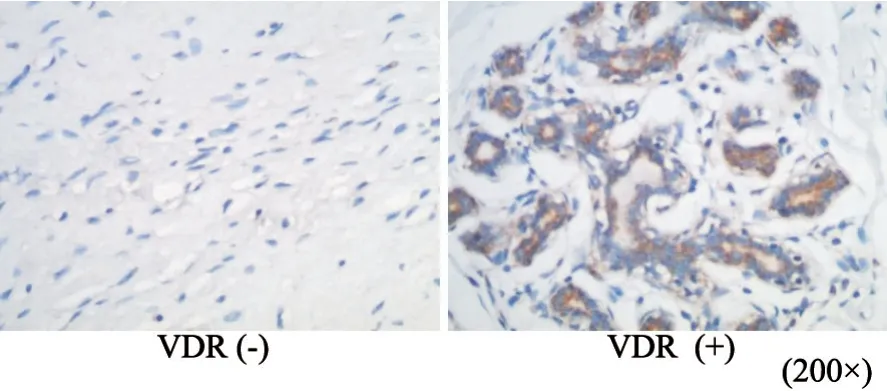
图2 VDR在乳腺癌组织中的表达Fig.2 Expression of VDR in breast cancer tissues
3 讨 论
VitD是一种脂溶性的类固醇衍生物,在骨代谢和钙稳态中发挥重要作用,近年来发现VitD具有潜在的抗癌作用,包括抑制肿瘤细胞增殖、促进细胞分化、诱导细胞凋亡、调节免疫系统、抑制炎症、抑制肿瘤侵袭与转移等多个生物学过程[4]。因而VitD与乳腺癌的关系受到广泛关注,VitD与乳腺癌之间关系的流行病学证据尚无定论,外周血25(OH)D的水平被认为是体内VitD状态的主要生物标志物,本研究通过检测外周血25(OH)D水平,探讨VitD在临床中的意义。本研究显示,乳腺癌患者外周血25(OH)D水平显著低于乳腺良性肿瘤患者和健康体检者,提示VitD在乳腺癌的发生、发展中具有重要作用,罹患乳腺癌的风险可能与体内VitD水平有关,目前有关VitD水平与乳腺癌患病风险的相关流行病学研究结果常常出现矛盾,不完全一致。这可能是由于乳腺癌的异质性及数据的有限性。Chen等[5]在一项基于中国人群病例对照研究和一项观察性研究的荟萃分析中发现,血浆25(OH)D质量浓度每增加1 ng/mL可使乳腺癌发病率降低16%,与外周血25(OH)D水平在最低四分位数的女性相比,外周血25(OH)D水平在最高四分位数的女性罹患乳腺癌的风险显著降低,提示体内VitD水平降低可能会增加中国人群的乳腺癌发病风险。Yao等[6]的研究亦表明,高水平VitD与乳腺癌发病率和死亡率风险较低有关,本研究结果与其相符。VitD除了调节钙代谢外还是一个重要的免疫调节剂,而T淋巴细胞细胞群是其主要的靶细胞之一[7-8]。本研究发现,乳腺癌患者中T细胞功能正常(CD4+/CD8+≥1.4)的患者外周血25(OH)D水平明显高于T细胞免疫功能缺陷(CD4+/CD8+<1.4)的患者,说明VitD的缺乏可能导致T淋巴细胞细胞亚群数目及功能紊乱,使得机体的免疫功能下降,促进肿瘤的发生、发展。
本研究发现,乳腺癌患者中Ⅲ、Ⅳ期乳腺癌患者外周血25(OH)D水平显著低于Ⅰ、Ⅱ期患者,淋巴结转移患者外周血25(OH)D水平显著低于淋巴未结转移患者,骨转移患者外周血25(OH)D水平显著低于未发生骨转移的患者,较低的外周血25(OH)D水平与乳腺癌晚期、淋巴结受累、骨转移、PR阴性等较差的预后相关。Palmieri等[9]发现,与患有早期乳腺癌的女性相比,患有局部晚期或转移性乳腺癌的女性的VitD水平显著降低。有研究发现,外周血25(OH)D水平较低的乳腺癌患者在诊断时罹患晚期肿瘤、淋巴结受累、远处转移的风险更高[10],提示低VitD水平在乳腺癌的发生、发展中具有一定作用。
NK细胞是先天免疫系统的第一道防线,通过细胞毒性和免疫调节能力发挥抗肿瘤作用。我们的前期研究发现,1,25二羟基维生素D3[1,25-dihydroxyvitamin D3,1,25(OH)2D3]通过miR-302c/miR-520c/NKG2D配体途径增强NK细胞对恶性肿瘤细胞的杀伤作用[11]。但本研究发现,乳腺癌患者25(OH)D与外周血NK细胞数量没有显著相关性,这可能是由于VitD能增强NK细胞活性,但不能增加NK细胞数量,同时由于我们统计的是外周血1,25(OH)2D3水平,与25(OH)D浓度仍有差异。
VitD的生物学活性主要是由VitD的活性代谢物与VDR结合所介导的,配体结合导致VDR与类视黄醇X受体形成异二聚体,配体结合的VDR-RXR复合物与多个调节区中的VitD应答元件(VitD response element,VDRE)结合,诱导基因表达的正或负转录调节。这些靶基因参与多种分子途径,从而通过自分泌和旁分泌介导VitD的抗癌作用[12-13]。目前关于乳腺癌组织中VDR表达与乳腺癌的临床特征之间的研究较少,Friedrich等[14]研究发现,乳腺癌组织VDR的表达与肿瘤分期、淋巴结是否受累、肿瘤分级、肿瘤组织学类型、ER表达、PR表达、Ki-67增殖指数等均无显著相关性,认为VDR并不能作为乳腺癌的预后指标。而Ditsch等[15]研究则认为乳腺癌中VDR的表达可能与较好的预后相关。本研究在探讨乳腺癌患者VitD水平与乳腺癌临床表征关系的同时还检测了乳腺癌组织中的VDR的表达水平,并探讨了乳腺癌中VDR的表达与乳腺癌患者临床特征的相关性,结果发现,在ER阳性患者中,VDR的阳性率显著高于ER阴性患者,PR阳性患者中VDR的阳性率也同样高于PR阴性患者,差异有统计学意义,而乳腺癌中VDR的表达与乳腺癌患者T细胞免疫功能、临床分期、肿瘤大小,淋巴结是否受累、是否骨转移无显著相关性。Swami等[16]研究发现,活性VitD可抑制ER的基因转录,进而抑制因雌激素刺激导致的乳腺癌细胞增殖。在ER阳性和对VitD敏感的乳腺癌细胞中,VitD的抗雌激素作用可能部分是由于VDR在其配体激活后所介导的ER表达下调[17]。本研究结果显示,虽然乳腺癌患者ER阴性的风险与外周血25(OH)D的水平无明显相关性,但ER阳性的乳腺癌患者,VDR的阳性率明显较高。因此,ER阳性同时VDR阳性的乳腺癌患者在抗雌激素治疗的同时加用VitD,可为ER阳性乳腺癌患者的治疗提供新方案。
VitD因其具有潜在的抗癌作用、免疫调节作用,且使用较为方便安全、不良反应小而具有广泛的研究前景。本研究初步探讨了外周血25(OH)D、VDR与乳腺癌临床特征的关系,较低的外周血25(OH)D水平与乳腺癌较差的预后特征相关,VDR的表达与ER、PR是否阳性相关,同时本研究结果结合既往文献结论提示ER阳性且VDR阳性患者如果进行抗雌激素治疗时加用VitD,可能起到协同作用,但仍需要进一步扩大样本数及基础的体内外研究予以证实。

