下调基因PTTG1对人胶质瘤细胞SHG44增殖、凋亡、迁移和侵袭能力的影响
崔立山,林 婷,徐岚溪,王冠玲,林建斌,冯三平,曹 洋,曹 颖,宋正茂,金 鑫
1.厦门市第五医院神经外科,福建 厦门 361101;
2.厦门大学医学院基础医学部,福建 厦门 361102
脑胶质瘤是人类中枢神经系统最常见的恶性肿瘤,占成人颅内肿瘤的35%~60%,其中恶性胶质瘤约占60%。其在临床上具有预后差、病死率高等特点[1]。在胶质瘤的发生、发展中存在多种基因的连锁改变,这些改变最终使得胶质瘤细胞获得无限增殖的生长优势,从而促进肿瘤发生。
垂体瘤转化基因1(pituitary tumor-transforming gene 1,PTTG1)首先由Pei等[2]在小鼠垂体肿瘤细胞中发现,是一种致癌基因。PTTG1高表达于几乎所有已经研究过的肿瘤细胞(包括肝癌、肺癌、白血病、乳腺癌及结肠癌等)[3]。其在肿瘤发生中的作用机制主要涉及细胞转化、非整倍体细胞分裂、细胞凋亡和影响肿瘤微环境的形成[4]。研究发现,PTTG1的表达与胶质瘤的病理学分级、肿瘤微血管密度呈正态分布[5]。目前国内外关于PTTG1基因表达与多种临床常见恶性肿瘤的病理学类型、癌细胞的增殖活性及生物学特性等方面的研究已较为完善[6]。但是有关PTTG1是否影响恶性胶质瘤细胞的多种生物学特性,如增殖、凋亡、迁移和侵袭等的研究较少,且作用机制尚不明确。
无限增殖、迁移和侵袭是肿瘤细胞特有的恶性生物学行为。研究发现,恶性胶质瘤细胞在获得无限增殖能力的同时,在转移过程中依靠其极强的侵袭能力,侵入淋巴管、血管,从而侵入其他组织与器官,形成肿瘤的转移病灶,使其恶性程度加深[7]。大量研究表明,PTTG1 mRNA在多种肿瘤细胞中呈现高表达趋势,并且与肿瘤细胞的恶性生物学行为紧密相关[7]。本研究使用PTTG1 siRNA转染SHG44细胞,旨在研究下调PTTG1表达对恶性胶质瘤细胞增殖、凋亡、迁移和侵袭能力的影响,从而探索治疗胶质瘤的新途径。
1 材料和方法
1.1 材料
SHG44细胞株购自中国科学院典型培养物保藏委员会细胞库;胰蛋白酶、胎牛血清(fetal bovine serum,FBS)及DMEM高糖培养基均购自美国Gibco公司;PTTG1 siRNA、阴性对照siRNA及转染试剂均购自广州市锐博生物科技有限公司;聚合酶链反应(polymerase chain reaction,PCR)相关试剂均购自宝日医生物技术(北京)有限公司;蛋白质印迹法(Western blot)相关试剂均购自德国Millipore公司;PTTG1抗体购自美国Sigma公司;细胞计数试剂盒(cell counting kit-8,CCK-8)购自大连美仑生物技术有限公司;Annexin V-FITC/PI凋亡试剂盒购自南京凯基生物科技发展有限公司;Transwell小室(直径6.5 mm,孔径8 μm)和基底膜基质胶购自美国Corning公司。
1.2 仪器
PCR仪购自德国Biometra公司;实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)仪购自美国ABI公司;电泳系统购自美国Bio-Rad公司;全自动图像工作站购自美国Kodak公司;多功能酶标仪购自美国Thermo Scientific公司;流式细胞仪购自美国Beckman公司;倒置显微镜购自日本Olympus公司。
1.3 RTFQ-PCR
使用TRIzol从SHG44细胞提取总RNA,根据说明书将1 μg总RNA加入20 μL混合体系中进行反转录。用于PCR扩增的寡核苷酸引物:PTTG1的正义链为5’-ACCCGTGTGGTTGCTAAGG-3’,反义链为5’-ACGTGGTGTTGAAACTTGAGAT-3’;GAPDH的正义链为5’-CTGGGCTACACTG AGCACC-3’,反义链为5’-AAGTGGTCGTTG AGGGCAATG-3’。PCR反应体系扩增条件:94 ℃变性45 s,退火45 s,循环40次,最后72 ℃延伸45 s。按照RTFQ-PCR检测试剂盒(TaqMan®2×Universal PCR Master Mix,No Amp Erase®UNGb)的说明进行实验,整个操作在冰上进行,注意避光。PCR结束后得到扩增曲线和Ct值,基因差异表达水平用2-ΔΔCt方法计算:ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组
1.4 Western blot
提取SHG44细胞总蛋白,BCA法测定蛋白浓度。用10%聚丙烯酰胺凝胶电泳,湿转至聚偏二氟乙烯膜上。5%脱脂奶粉室温封闭1 h,一抗4 ℃冰箱温育过夜,洗膜,室温温育二抗,ECL试剂盒显影。使用Image Station 4000R软件分析蛋白质条带灰度值。
1.5 CCK-8检测细胞增殖能力
为了评估基因PTTG1对细胞增殖的影响,根据试剂说明书使用CCK-8测定。将SHG44细胞接种到96孔板中,24 h后换100 μL新鲜培养基。PTTG1 siRNA或阴性对照siRNA以50 nmol/L的浓度转染细胞。分别于转染后的0、24、48和72 h向细胞培养液中加入10 μL的CCK-8,再温育3 h,在450 nm处检测吸光度(D)值,计算细胞活力。
1.6 流式细胞术检测细胞凋亡
将细胞接种至12孔板中,PTTG1 siRNA或阴性对照siRNA以50 nmol/L的浓度转染细胞。24 h后收集细胞,按照Annexin V-FITC细胞凋亡检测试剂盒说明书操作,使用流式细胞术检测细胞凋亡。
1.7 细胞划痕实验检测细胞迁移能力
用无血清培养基将细胞接种至6孔板中,PTTG1 siRNA或阴性对照siRNA以50 nmol/L的浓度转染细胞。24 h后用10 μL移液管尖端刮擦细胞,并在划痕0、6、12和24 h后,用倒置显微镜进行拍摄,观察划痕中细胞的覆盖情况,即细胞的迁移能力,用Image J软件测量统计。
1.8 Transwell检测细胞侵袭能力
PTTG1 siRNA或阴性对照siRNA以50 nmol/L的浓度转染SHG44细胞24 h,然后将SHG44细胞用无血清培养基重悬,并在铺有基底膜基质胶的Transwell上室中接种。在下室中加入含10%FBS的DMEM培养基。24 h后,用棉签刮下未迁移的膜上表面的细胞,用4%多聚甲醛溶液固定迁移到下表面的细胞,用结晶紫试剂染色。将小室翻转后置于倒置显微镜下进行细胞计数;实验重复3次,取其均数作为这个小室的侵袭细胞数。
1.9 统计学处理
采用Graphpad Prism 5.0软件进行分析。实验结果以±s表示,多组间比较采用one-way ANOVA,两组间比较采用非配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 siRNA可以显著抑制PTTG1基因和蛋白的表达
为了证实siRNA能否抑制SHG44细胞PTTG1基因和蛋白的表达,我们将PTTG1 siRNA或阴性对照siRNA以50 nmol/L的浓度转染SHG44细胞,24 h后通过RTFQ-PCR和Western blot检测PTTG1 mRNA和蛋白质的表达,确认沉默效果。同时设立了未转染细胞组(blank组)。结果发现,blank组与阴性对照siRNA组蛋白和mRNA水平均无显著差异;PTTG1 siRNA能够明显抑制PTTG1 mRNA的表达(图1A),同时明显降低PTTG1蛋白水平(图1B、C)。沉默效率约为37%。
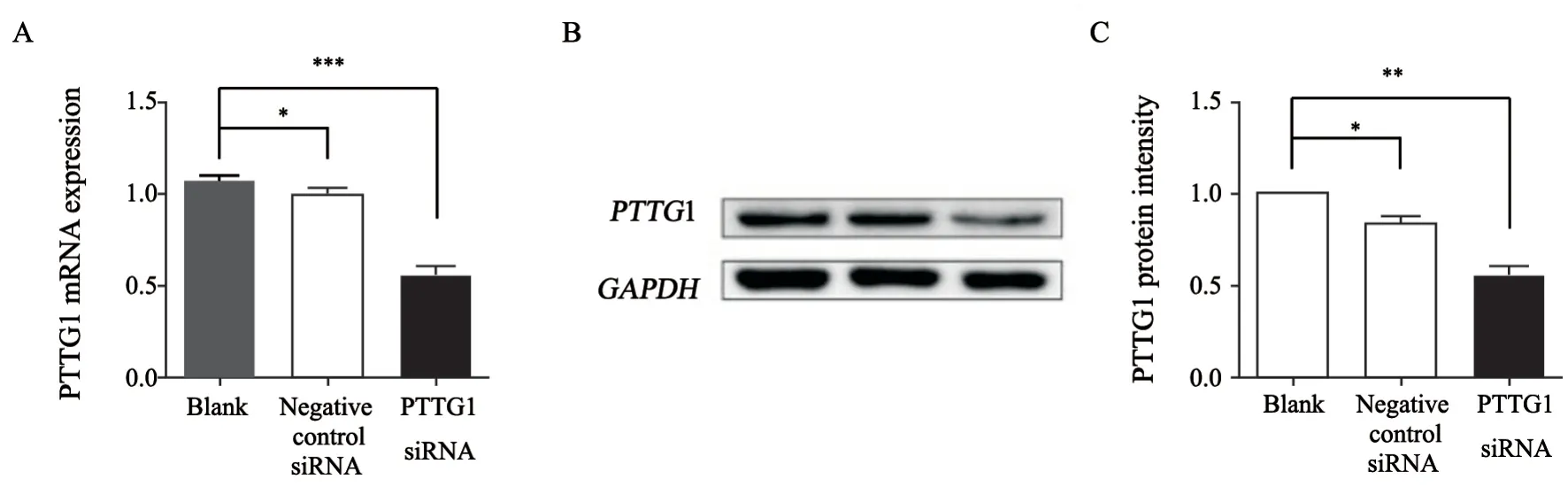
图1 PTTG1 siRNA的沉默效率Fig.1 PTTG1 siRNA silencing efficiency
2.2 下调PTTG1的表达能够明显抑制SHG44细胞增殖能力
无限增殖是恶性胶质瘤细胞特征性生物学行为之一,根据CCK-8说明书进行操作,在450 nm处测量D值,计算细胞活力。结果发现,相比于阴性对照组,PTTG1 siRNA组在24、48和72 h处的细胞活力明显下降(图2)。这说明下调PTTG1的表达可明显抑制SHG44细胞增殖能力。
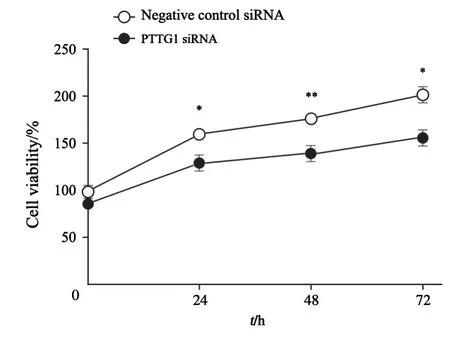
图2 下调PTTG1能够明显抑制SHG44细胞增殖能力Fig.2 Inhibition of PTTG1 can suppress the proliferative ability of SHG44 cells
2.3 下调PTTG1的表达能够明显促进SHG44细胞凋亡
用流式细胞术测定细胞凋亡情况。双色散点图中绿色荧光FITC为横坐标,红色荧光PI为纵坐标。活细胞仅有很低强度的背景荧光,早期凋亡细胞仅有较强的绿色荧光,晚期凋亡细胞有绿色和红色荧光双重染色(图3A)。结果发现,阴性对照组的活细胞比例为(88.430±1.486)%,PTTG1 siRNA组的活细胞比例为(80.700±1.966)%,与阴性对照组相比显著下降(图3B);阴性对照组早期凋亡细胞比例为(2.103±0.743)%,PTTG1 siRNA组早期凋亡细胞比例为(6.707±2.448)%,有所上升(图3C);阴性对照组晚期凋亡细胞比例为(5.205±0.956)%,PTTG1 siRNA组晚期凋亡细胞比例为(8.987±0.665)%,明显上升(图3D)。这说明下调PTTG1的表达能够明显促进SHG44细胞凋亡。
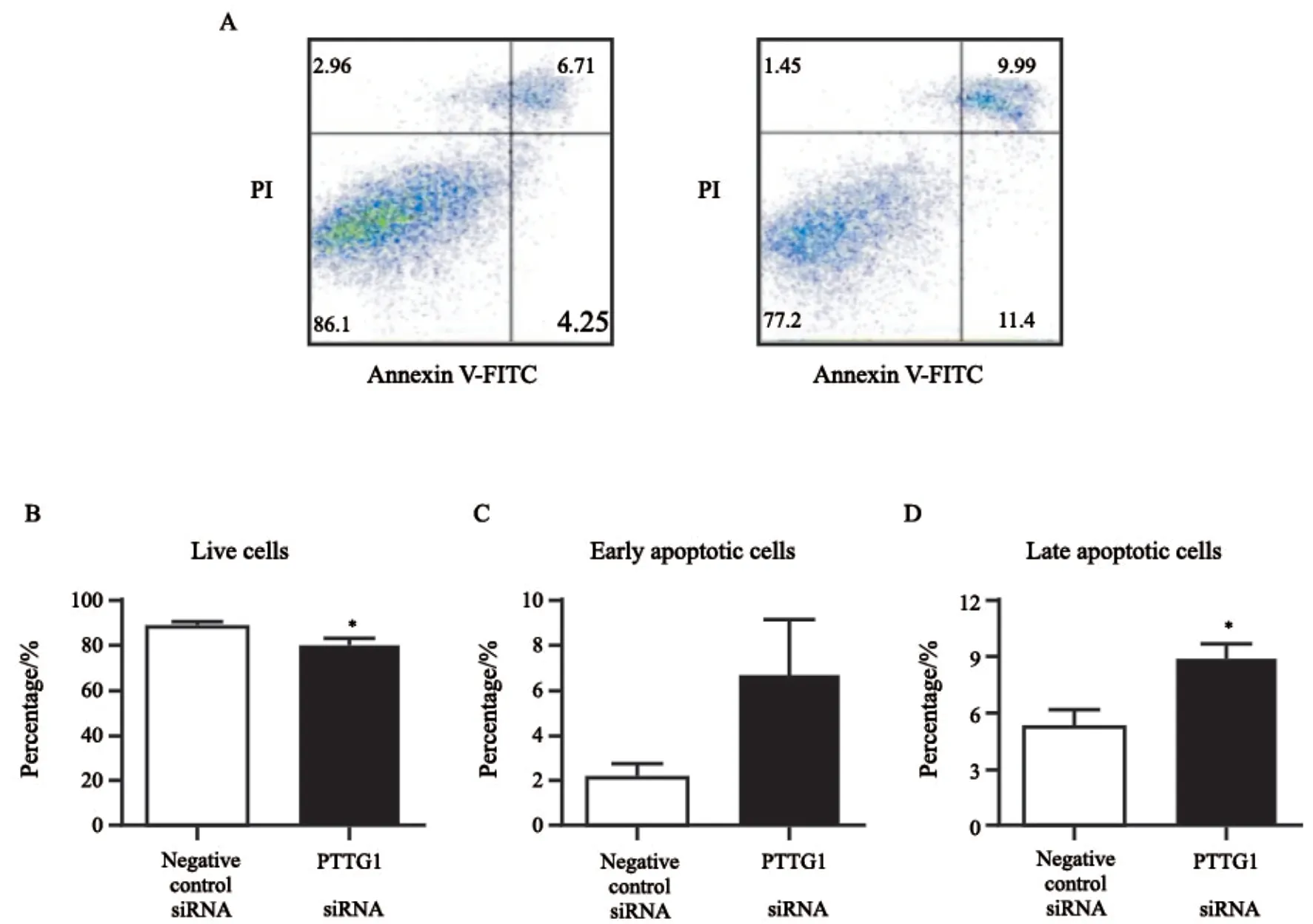
图3 下调PTTG1的表达能够明显促进SHG44细胞凋亡Fig.3 Inhibition of PTTG1 can increase the apoptosis of SHG44 cells
2.4 下调PTTG1的表达能够明显抑制SHG44细胞迁移能力
用划痕实验测定细胞迁移能力。结果显示,0 h时阴性对照组划痕面积为(83.680±5.740)mm2,PTTG1 siRNA组划痕面积为(85.710±2.624)mm2。24 h后阴性对照组划痕出现愈合(图4A),面积为(65.690±2.784)mm2;PTTG1 siRNA组划痕面积为(79.130±2.797)mm2,与阴性对照组相比差异有统计学意义(图4B)。这表明下调PTTG1的表达能抑制SHG44细胞迁移能力。

图4 下调PTTG1的表达能够明显抑制SHG44细胞迁移能力Fig.4 Inhibition of PTTG1 can suppress the migration ability of SHG44 cell
2.5 下调PTTG1的表达能够明显抑制SHG44细胞侵袭能力
肿瘤细胞在转移过程中通过其极强的侵袭能力,侵入淋巴管、血管、其他组织及器官,形成肿瘤的转移病灶,使得其恶性程度加深。为了观察抑制PTTG1的表达能否降低SHG44细胞侵袭能力,利用Transwell小室测定细胞侵袭能力。结果显示,阴性对照组细胞穿膜数量为67.500±4.372,PTTG1 siRNA组细胞穿膜数量为26.330±1.406(图5A、B)。这说明下调PTTG1的表达能够明显抑制SHG44细胞侵袭能力。
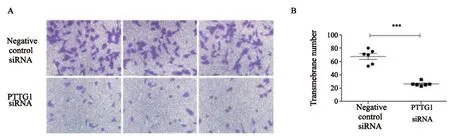
图5 下调PTTG1表达能够明显抑制SHG44细胞侵袭能力Fig.5 Inhibition of PTTG1 can suppress the invasion ability of SHG44 cells
3 讨 论
胶质瘤是最常见的颅内恶性肿瘤[8],儿童和中年人为患病的高危人群[9]。临床上较常见的治疗方法是手术切除和辅助化疗,然而这些治疗方法对于恶性胶质瘤而言效果不佳[10]。因此寻找更好的治疗方法势在必行。随着现代生命科学的发展,胶质瘤中涉及重要基因的功能及癌变过程中激活的信号通路为揭示胶质瘤发生、发展的本质,以及肿瘤的治疗带来新思路[11]。
PTTG1是一种细胞转化因子[12],在细胞转化、增殖和肿瘤形成中起着重要作用。在正常人体内,PTTG1在睾丸和胸腺组织中表达最高,但在其他组织(如脾脏、脑组织、胰腺、心脏及肝脏等)中低表达或无表达。但当这些组织发生癌变时,PTTG1呈现高表达趋势[13]。在肿瘤形成过程中,PTTG1可以在以下方面发挥作用:① 在细胞转化过程中,PTTG1可以在缺乏相关辅助刺激因子的情况下独立诱导细胞转化,促进增殖;②PTTG1导致细胞染色体以非整倍体方式分裂,诱导肿瘤形成;③PTTG1的高表达可以刺激成纤维细胞生长因子和血管内皮生长因子分泌,促进血管生成[5,14]。
研究发现PTTG1过表达可以诱导裸鼠细胞上皮-间质转化及肿瘤形成,并且与恶性肿瘤的高侵袭性密切相关[15];下调胶质瘤细胞中PTTG1的表达,不仅能有效地降低其侵袭性,还能提高恶性胶质瘤患者的生存率。因此我们推测PTTG1是与肿瘤转移相关的重要标记基因。
本研究采用CCK-8进行细胞增殖活力的测定,结果表明,PTTG1 siRNA转染24 h后,神经胶质瘤细胞SHG44在24、48和72 h的增殖活力显著低于对照组,表明PTTG1低表达抑制了SHG44细胞增殖能力。进一步通过划痕实验和Transwell小室实验证实,降低PTTG1的表达可显著抑制胶质瘤细胞的迁移和侵袭能力。此外,为了进一步证实PTTG1对恶性胶质瘤细胞生物学特性的影响,我们采用流式细胞术检测了SHG44细胞凋亡情况。结果显示,与对照组相比,PTTG1沉默后早期凋亡和晚期凋亡细胞数均有所增加,活细胞数量显著减少。以上结果均提示,PTTG1作为有效靶点参与了胶质瘤细胞增殖、凋亡、迁移和侵袭过程,但相关机制仍需进一步研究。
综上所述,我们使用siRNA干扰技术沉默SHG44细胞中PTTG1基因,抑制其表达,观察其对胶质瘤细胞SHG44增殖、凋亡、侵袭和迁移能力的影响。结果发现,PTTG1 siRNA能够明显抑制PTTG1 mRNA和蛋白的表达,并且显著降低细胞的增殖、迁移及侵袭能力,增加细胞凋亡。因此,下调PTTG1的表达可以降低神经胶质瘤的恶化程度,有望为胶质瘤的临床治疗提供了新的思路。

