纳米材料在肿瘤诊疗中的应用研究进展
尹翼鹏晨,张 琴,傅小龙
上海交通大学附属胸科医院放疗科,上海 200030
恶性肿瘤是严重威胁人类健康和影响人类寿命的元凶之一。近10年来,恶性肿瘤发病率和死亡率节节攀升,给世界公共卫生和社会经济带来沉重负担[1]。在中国,随着城市化、工业化、老龄化的不断发展,疾病谱也在发生着巨大变化,自20世纪70年代以来,中国恶性肿瘤病死率上升了142.85%[2]。据中国疾病预防控制中心公布的数据,恶性肿瘤发病率和死亡率均居各种疾病发病率和死亡率的首位,2015年肿瘤发病率为313.28/10万,死亡率为205.40/10万,大部分患者确诊时已经是中晚期,总体疗效不佳,5年生存率为36.9%[3]。在目前的肿瘤综合治疗中,手术治疗、化疗、放疗是肿瘤治疗的三大主要手段,然而患者接受各种手段治疗之际均存在一定的复发、转移风险,也可能出现治疗相关的并发症[4-5],因此寻找新的治疗手段成为十分重要的问题。
近年来,纳米技术在生物医药,尤其是恶性肿瘤诊治上的发展和应用受到广泛关注。纳米材料是对至少在某一维度下尺寸介于1~100 nm或以这种结构组合而成的超精细材料的统称。纳米材料的尺寸介于原子水平与宏观物体水平之间,赋予纳米材料特殊的性质,如比表面积大、反应活性高、强度高、热阻低、比热容高、扩散性高、特殊的磁性和光学性质等,使纳米粒子拥有更高的可塑性,使其在医学影像学诊断和药物运输中的应用成为可能。
纳米材料具有良好的生物相容性和靶向性,而肿瘤组织的血管有异常增殖的特点:血管密度高而管壁完整性差,间隙宽,对大分子颗粒具有通透性且淋巴回流比较慢,因此一定大小的纳米粒子可以进入并停留于肿瘤组织,实现在肿瘤组织高效准确地富集,这种效应称为“增强渗透滞留(enhanced permeability and retention,EPR)效应”,属于被动靶向效应[6](图1)。近年来研究人员设计了各种基于纳米材料的靶向递药系统,改善了众多疏水药物的水溶性、稳定性及在体内的药物代谢动力学过程,能够主动靶向运输药物至肿瘤部位,实现药物的定向释放,在增加药物疗效、克服耐药的同时降低药物毒性。纳米材料还可以通过促进对放射线的吸收或改善肿瘤乏氧状况来增敏放疗。有光热效应的纳米材料不仅可以原位杀伤肿瘤细胞,同时可以增加肿瘤细胞对化疗和放疗的敏感性,因此可以将化疗、放疗、光疗和免疫治疗等多种治疗手段相结合,达到协同治疗肿瘤的目的,从而显著提高肿瘤的治疗效果,这为减少传统疗法的不良反应带来了新的可能[7-9]。此外,纳米材料有很好的穿透效果和肿瘤富集效果,可以用于实时、动态、可视化的肿瘤造影,作为分子探针用于磁共振、核医学、光学成像等多种成像模式及兼具治疗功能的诊疗一体化材料。本文总结和列举了近年来纳米材料在肿瘤诊疗中的应用,旨在为广大研究者提供参考。
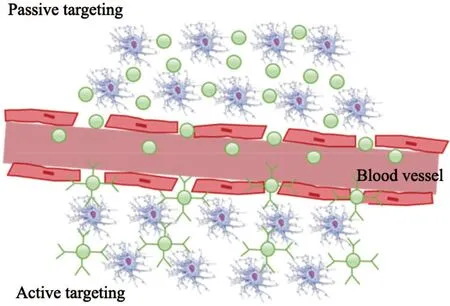
图1 纳米材料对肿瘤的被动靶向和主动靶向Fig.1 Passive targeting and active targeting of nanomaterials in tumor
1 纳米材料在肿瘤诊断中的应用
癌症发现和确诊的时机决定着患者的生存期。对大多数肿瘤患者,Ⅰ期癌症患者5年生存率超过90%[10]。然而恶性肿瘤往往起病隐匿,早期缺乏特异性临床表现,待临床症状明显时患者多处于中晚期,治疗效果差。目前恶性肿瘤诊断主要通过生物学检测及影像学方法,生物学方法灵敏度和特异度都有限,且无法对肿瘤定位,活组织检查为有创性且标本有限。影像学方法受成本及风险制约,同时对直径小于0.5 cm的肿瘤仍然无能为力。因此,发展先进技术,实现对肿瘤的早期诊断和监测具有重要意义。目前,可以将纳米材料制成有靶向性的纳米造影剂或纳米探针,用于不同类型的影像设备,进而从细胞、分子水平揭示机体的生理、病理状况和代谢水平等,在肿瘤诊断和评价预后等方面已经和正在呈现出良好的应用前景。
在众多的影像学方法中,磁共振成像(magnetic resonance imaging,MRI)具有无创、安全、分辨率高的特点,且对软组织成像好。但是MRI灵敏度不高,临床上常用钆的配合物作为T1加权成像造影剂,钆剂具有一定的肾毒性。Fe3O4纳米粒被认为是对人体无毒的T2加权成像造影剂[11],与钆剂相比具有灵敏度高、组织相容性好、超顺磁性等特点[12]。1996年已通过美国食品药品管理局(Food and Drug Administration,FDA)批准的以Fe3O4纳米粒为基础的MRI造影剂Ferumoxsil(商品名GastroMARK®)上市,用于口服消化道MRI造影。
利用放射性核素进行显像在核医学领域具有重要地位,不仅灵敏度高,而且可定量,最常见的类型有正电子发射断层成像(positron emission tomography,PET)和单光子发射计算机断层成像(single-photon emission computed tomography,SPECT)。目前,通过放射性核素对纳米材料进行标记可以用于监测纳米药物的分布和实现靶向成像。例如,研究人员先后利用186Re-BMEDA[13]和99mTc-PEGylate[14]标记的多柔比星脂质体行SPECT,可以对药物在体内的分布进行示踪,同时还具有促进药物释放的作用。用64Cu标记的Mn3O4纳米粒联合抗CD105抗体TRC105可以靶向至荷瘤鼠乳腺癌血管行PET(图2)[15]。

图2 核素标记抗体结合的Mn3O4纳米粒在肿瘤的PET和MRIFig.2 Radiolabeled,antibody-conjugated Mn3O4 nanoparticles for tumor vasculature targeted PET and MRI
超声成像具有安全、便捷的特点,在医学影像领域具有天然的优势。目前已开发出可靶向至肿瘤血管相关标志物的纳米超声影像材料。例如,可靶向至高表达血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的肿瘤血管的超声纳米微泡不仅可以更清晰地对肾转移癌的肿瘤血管进行超声成像,而且可以促进抗VEGFR靶向药物在肿瘤血管中的定位[16]。
光学成像具有无辐射、无创、高分辨率和可控性好等优点,然而其穿透力差。通常利用荧光素产生荧光信号进行荧光成像,近红外荧光(near- infrared fluorescence,NIRF)探针因其穿透力强、安全而得到广泛应用,目前已被用于小动物活体成像系统及肿瘤转化医学研究领域。目前,有大量的纳米材料[17]如脂质体、金属或非金属纳米粒等均可以包载NIRF实现靶向肿瘤的光学成像[18]。另外,光声成像(photoacoustic imaging,PAI)是一种新兴的成像模式,它利用生物组织对光吸收的差异,并以超声信号对这种差异进行捕捉和成像[19],不仅反映组织解剖的信息,同时可提供机体代谢的信息,实现功能成像与分子影像的结合。研究发现,利用NIRF标记的超顺磁性四氧化三铁(superparamagnetic iron oxide,SPIO)纳米粒靶向至高表达人类表皮生长因子受体(human epidermal growth factor receptor 2,HER2)的卵巢癌荷瘤鼠,可以获得高分辨率的光声图像,从而为卵巢癌根治术确定更加精确的切除范围[20]。
目前出现将多种不同类型的成像手段联合使用的多模态成像技术,可以将不同的影像手段加以整合,产生协同作用,为肿瘤的精确诊断、精准治疗提供更加全面、准确的影像信息。例如,64Cu标记的SPIO载多柔比星纳米粒既可以治疗小鼠脑胶质瘤,也可以进行双模态PET和MRI[21]。有报道将Cy5、钆和叶酸共同包埋于金纳米粒可实现对小鼠的三模态光学成像、MRI和CT成像[22]。这种对肿瘤多模态成像与诊疗一体化的研究,将是未来肿瘤纳米医学发展的新方向。
2 纳米材料在肿瘤化疗中的应用
化疗是传统的肿瘤治疗方法之一,大多数肿瘤都需要用到化疗手段,然而化疗存在不良反应大(脱发、呕吐、骨髓抑制等)、肿瘤耐药、药物水溶性和靶向性差等缺陷,限制了化疗在临床上的应用。另外,肿瘤治疗往往出现多重耐药(multidrug resistance,MDR)。由于肿瘤组织静水压高、细胞间质渗透压低,间质液有向肿瘤外组织流动的趋势,肿瘤细胞膜表面还可以表达P糖蛋白,将摄取的药物外排。纳米材料所具有的独特性质使它可以与化疗药结合为纳米药物,是一种有前景的抗癌方式[23]。常用的纳米药物制剂类型主要有脂质体、树突状聚合物、聚合物纳米粒、固体脂质纳米颗粒、介孔二氧化硅纳米颗粒、聚合物胶束、磁性纳米粒、金纳米粒等[24]。第一个被批准用于临床的纳米药物载体系统是载多柔比星的盐酸多柔比星脂质体[25]。不同种类的纳米粒各有优劣,除了上述纳米粒外,近年来还有以细胞或细胞膜为载体的纳米药物载体出现,包括红细胞、白细胞、肿瘤细胞和干细胞等。相较于一般的纳米粒,细胞膜表面某些分子可以具有肿瘤归巢的特性,更加有利于靶向递药[26]。
小于200 nm的纳米粒具有较强的EPR效应,被广泛用于肿瘤的靶向治疗。主动靶向是指在纳米粒上附加可以与肿瘤标志物(如特异性肿瘤相关抗原和受体等)结合的配体,使纳米粒有效聚集于特定肿瘤部位,有利于药物在肿瘤组织中的聚集,减少药物在非肿瘤部位中的分布,减轻药物引起的不良反应。常用的配体有抗体、小分子类和适配体等。纳米材料具有很大的比表面积,能够有效地装载疏水性的药物,保护药物,增加其在血液循环中的稳定性和生物利用度,通过聚乙二醇(polyethylene glycol,PEG)等修饰可以实现长循环的目的[27]。小分子化疗药物主要通过被动扩散进入肿瘤细胞,效率较低且靶向性不佳,易被肿瘤细胞膜表面的转运蛋白识别并外排发生耐药。用纳米材料载化疗药物可以改变药物进入肿瘤细胞的方式,增加肿瘤细胞对药物的摄取进而克服耐药。研究发现,脂质体纳米粒可以通过胞吞的方式介导药物进入肿瘤细胞,进一步逃避转运蛋白的外排和溶酶体的吞噬而克服耐药[28]。一些阳离子聚合物如普朗尼克具有运输至细胞核的特点[29],可以利用这类材料载以细胞核为靶点的化疗药物使其顺利到达靶点。
研究表明,热疗联合化疗可以显著增强化疗的效果[30],主要的机制有:① 热疗可以抑制肿瘤细胞DNA的修复,增强化疗对肿瘤细胞DNA的损伤;② 热疗可以扩张肿瘤血管,帮助化疗药物更多地进入肿瘤组织;③ 热疗能增加肿瘤细胞膜的通透性,使化疗药物更易于进入肿瘤细胞;④ 热疗可降低对化疗耐药肿瘤细胞的耐药性;⑤ 肿瘤组织中心部位细胞pH低且乏氧,对热疗敏感而对化疗不敏感,相反肿瘤组织周围细胞对化疗更敏感,二者可以协同互补。许多实验也证明了热化疗的良好抗肿瘤效果,例如,载顺铂的磁性纳米粒,用热化疗方法治疗大鼠神经胶质瘤,对肿瘤杀伤效果显著优于对照组[31]。
3 纳米材料在肿瘤放疗中的应用
放疗是临床上用于肿瘤治疗的标准疗法之一,据统计,有接近60%的肿瘤患者接受过放疗[32]。然而由于放疗耐受及放疗后复发等问题,放疗的疗效并不能令人满意。
具有较高原子序数的金属纳米材料,如金、银等,当辐射光子入射时,会发生光电效应和康普顿效应,金属原子发生能级跃迁,释放俄歇电子,同时散射康普顿电子,这些电子在纳米粒表面产生高密度电离能,从而使放射线能量增强,并富集于肿瘤细胞内,从而增强了放射线对肿瘤细胞DNA的损伤,进一步促进肿瘤细胞DNA双链断裂、抑制DNA合成和修复[33-35]。同时,这种电离作用可以增加肿瘤细胞内自由基的产生,增强放射线对肿瘤细胞的杀伤[36]。金纳米粒在体内外已被广泛地用作放射治疗的增强试剂,Wang等[37]研究了葡萄糖通过巯基与金纳米粒耦连后,发现肺癌A549细胞对纳米粒的摄取能力明显提高,而且该纳米材料可以提高肺癌A549细胞对6 MV X射线的放射敏感性,射线对肺癌A549细胞的抑制率与纳米材料的浓度呈正相关。
有些功能性纳米材料可以通过改善肿瘤乏氧来进一步增强放疗的效果。Hauser等[38]将细胞穿膜肽与纳米Fe3O4相连接,加入肺腺癌A549细胞系,纳米粒高效富集于肿瘤细胞内,且肿瘤细胞线粒体活性大幅下降,将纳米材料和放疗联合使用,肺癌细胞内活性氧自由基(reactive oxygen species,ROS)产生增多,且肿瘤细胞存活率进一步下降(图3)。Angelopoulou等[39]构建以磁性铁颗粒为核心的纳米粒搭载降糖药达格列嗪,阻断乏氧区肺癌细胞维持生存所必需的糖酵解过程,导致对放疗不敏感的肿瘤细胞乏氧区细胞死亡,从而起到放疗增敏的作用。
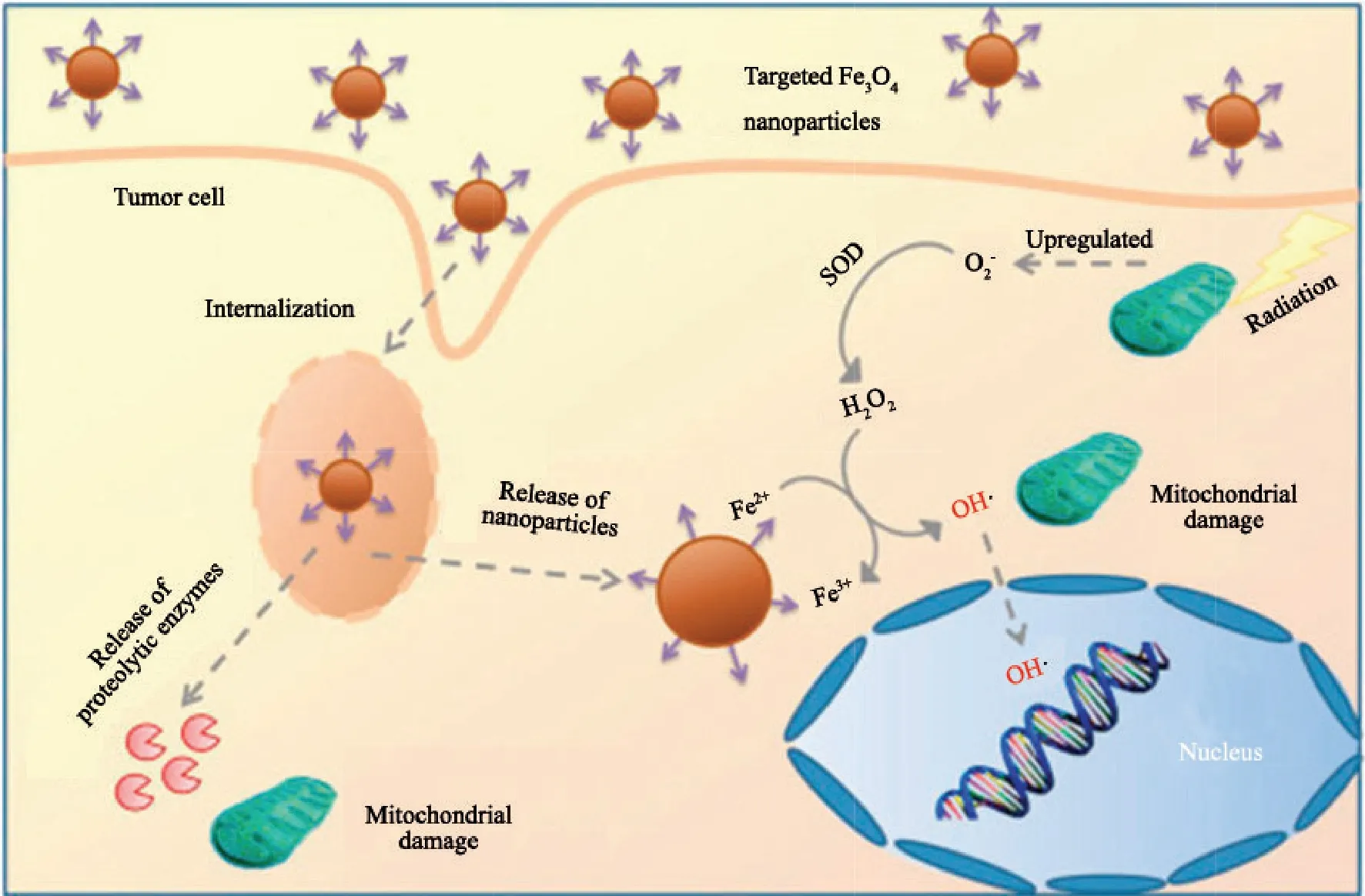
图3 靶向性Fe3O4纳米粒对放疗的增效Fig.3 Targeted Fe3O4 nanoparticles for the enhancement of radiation therapy
研究表明,热疗和放疗联合使用可以产生“1+1>2”的协同效果,提高放疗的疗果[40]。可能的机制有:① 热疗可以抑制肿瘤细胞DNA修复,增强放疗对肿瘤细胞DNA的损伤;② 热疗可以扩张肿瘤血管,提高肿瘤细胞氧浓度,增强放疗作用;③ 放疗后肿瘤细胞对热疗更加敏感;④ 有丝分裂期(M期)的肿瘤细胞对放疗敏感,细胞增殖期(S期)的肿瘤细胞对热疗敏感。研究证实,将可靶向肿瘤的产热纳米粒与188Re结合,在较低剂量下即可有效杀伤肿瘤细胞[41]。研究表明,将超顺磁性纳米粒用于磁流体热疗和放疗(外照射剂量20 Gy)联合使用治疗大鼠前列腺癌比单独使用放疗的效果更好[42]。
4 纳米材料在肿瘤光疗中的应用
近年来,光疗用于肿瘤治疗越来越受到关注。光疗包括光热治疗(photothermal therapy,PTT)和光动力治疗(photodynamic therapy,PDT)。
PTT相对安全且便于控制,然而存在对深部组织穿透性差,热量难以富集等缺点,使用具有光热效应的纳米材料可以有效地将光能转化为热能,并靶向至肿瘤细胞,减少了对周围组织的损伤。在PTT中,纳米材料本身就具备治疗的属性。常用的光吸收剂有纳米金、石墨烯和近红外染料等[43-44]。肿瘤组织血管较迂曲,散热效率低下,受热时热量容易蓄积,故PTT可以有效地破坏肿瘤细胞而对正常细胞损伤较小[45]。Dickerson等[46]将PEG修饰的金纳米棒注入荷瘤鼠,近红外光照射可使小鼠肿瘤体积缩小1/4。研究发现,Fe3O4磁簇在808 nm激光下可以产生光热效应,对肺癌A549细胞和荷瘤鼠都具有明显的治疗效果[47]。此外,近红外染料和卟啉类物质兼具多模态成像和PTT效果,例如,透明质酸-花菁类染料-铁复合纳米粒可以用于荧光成像、磁共振多模态成像和PTT,该材料在785 nm激光1 W/cm2的功率下照射约5 min即可升高28 ℃,相同条件下对MCF-7移植瘤小鼠治疗可消除肿瘤(图4)[48]。然而光热纳米材料尤其是无机纳米材料在生物体内难以降解,具有潜在的毒性以及诱发免疫相关不良反应的可能。研发具有更好的生物相容性、可降解性、低毒性的光热转换材料将是未来发展的热点。
PDT主要利用光敏剂对肿瘤细胞进行杀伤,包括两种类型:Ⅰ型过程是光敏剂直接与细胞微环境成分反应,产生过氧化物或超氧化物,氧化破坏肿瘤细胞[49];Ⅱ型过程是利用含卟啉的光敏剂在特定波长光照下产生高反应性的单线态氧进而杀伤肿瘤细胞。光敏剂本身往往靶向性、水溶性和生物利用度较差,利用纳米材料作为载体搭载光敏剂可以提高其稳定性和靶向性[50-51]。光敏剂产生的ROS半衰期短,通过纳米材料将光敏剂靶向富集到肿瘤后,只有靠近光敏剂的细胞可发生PDT过程,有效地减少对周围正常组织的损伤[52]。李方舟等[53]制备了载多柔比星的介孔碳纳米粒,发现多柔比星与兼有PTT和PDT效果的介孔碳纳米粒联合使用对乳腺癌细胞具有明显的抑制作用。
5 纳米材料在肿瘤免疫治疗中的应用
肿瘤的免疫治疗是通过激活机体的免疫功能或解除免疫抑制来治疗肿瘤的新方法,具有特异性强、能清除微小病灶、减少复发的优点。2013年,“癌症免疫循环”概念被提出,认为肿瘤相关抗原(tumor-associated antigen,TAA)、肿瘤特异性抗原(tumor-specific antigen,TSA)可以递呈给免疫细胞,启动免疫反应,识别并杀伤肿瘤细胞,为肿瘤的免疫治疗提供了理论依据[54]。目前临床常用的免疫治疗方法包括免疫检查点抑制剂和过继细胞疗法(adoptive cell therapy,ACT)。免疫检查点抑制剂包括溶细胞性T淋巴细胞相关抗原4(cytolytic T lymphocyteassociated antigen 4,CTLA4)抗体、程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体和程序性死亡[蛋白]配体-1(programmed death ligand 1,PD-L1)抗体[55]。ACT是通过向患者输入经改造的免疫细胞以达到抗肿瘤效果的方法[56]。纳米材料可以增加抗体、免疫因子等的稳定性,在防止其降解的同时,增加免疫因子在肿瘤部位的富集,提高其靶向性和疗效,减少免疫治疗相关不良反应。

图4 透明质酸-花菁类染料-铁复合纳米粒用于荧光成像、磁共振多模态成像和PTTFig.4 Hyaluronic acid-cyanine dye-iron composite nanoparticles used in fluorescence imaging,magnetic resonance multimodal imaging and PTT
癌症疫苗是利用TAA、TSA及免疫因子等激活机体免疫应答治疗肿瘤的方法,而通过纳米材料的组装可以保护免疫成分不被内环境所影响,并主动靶向肿瘤特异性T细胞,激活特异性免疫应答[57]。研究人员设计了含TSA的纳米疫苗,与不含纳米材料的疫苗相比,机体可产生更多的肿瘤特异性细胞毒性T淋巴细胞和更强的免疫应答,该疫苗与免疫检查点抑制剂联合使用可以产生协同作用,抑制肿瘤的复发[58]。传统ACT需要先离体免疫细胞,利用纳米支架可以实现在体对免疫细胞的招募和富集,例如,用含有寡核苷酸和粒细胞-巨噬细胞集落刺激因子的纳米聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]支架植入小鼠皮下,可以招募和激活树突状细胞,诱发免疫反应,清除肿瘤[59]。研究发现,放疗可以具有远隔效应,放疗照射原位肿瘤时会释放炎症因子和TAA,诱导肿瘤特异性免疫反应的发生,与免疫治疗可以产生协同作用,发挥全身性抗肿瘤的效果[60]。有报道将可以捕获TSA的纳米粒和放疗联合使用可以增强放疗的效果及远隔效应,对黑色素瘤荷瘤鼠原发灶行放疗及注射该纳米材料可以有效抑制肿瘤生长和复发[61]。Chen等[62]的研究显示,PTT联合含免疫佐剂及CTLA-4单抗的纳米材料可提高结肠癌和乳腺癌小鼠T细胞水平,抑制肿瘤生长,同时产生记忆效应,抑制肿瘤复发(图5)。
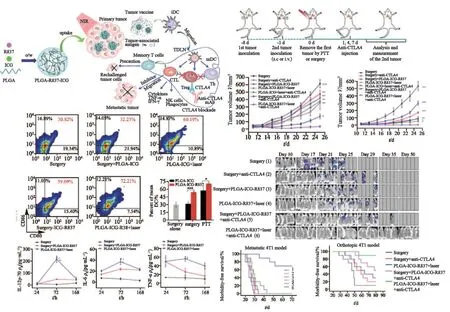
图5 PTT联合含免疫佐剂纳米粒在免疫检查点抑制剂免疫治疗增效中的应用Fig.5 PTT with immune-adjuvant nanoparticles together with checkpoint blockade for effective cancer immunotherapy
6 结语
纳米技术具有诸多优越的性质,使其在肿瘤诊疗领域的应用越来越广泛,为解决传统肿瘤诊疗中的难题带来了新的途径和思路。然而,纳米技术目前仍存在纳米材料制备、生物安全性、毒性、分析方法和机制研究等问题,有待进一步完善。目前的研究大多以实验室研究为主,到进入临床还需要更多的努力。相信在不久的将来,纳米技术会有更大的发展,而肿瘤的诊疗也将迎来更美好的明天。

