UPLC-Q-TOF-MS快速鉴定黄山野生绞股蓝中皂苷类物质
程满环,郑雪怡,朱媛媛,张 娜
黄山学院现代教育技术中心;2黄山学院化学化工学院,黄山 245041
绞股蓝Gynostemmapentaphyllum(Thunb.)Makino为葫芦科绞股蓝属(GynostemmaBl.)多年生草质藤本植物,主要散布在中国的湖南,湖北,云南,广西等省,被誉为“南方人参”、“不老长寿药草”[1]。其药用价值很高,现代研究表明,绞股蓝具有降三高、抗衰老、提高免疫力、抗肿瘤等功能[2-6]。绞股蓝中含有丰富的皂苷类、黄酮类、多种氨基酸和微量元素等,其中,皂苷类物质是绞股蓝主要活性物质,一直是研究的热点,文献报道已有一百多种皂苷类物质从绞股蓝中分离鉴定出来,绞股蓝皂苷与人参皂苷结构相似,主要为达玛烷型结构[7-9]。
目前,绞股蓝皂苷提取、分离、鉴定的主要方法是“通法”提取、分离得到纯品后进行表征[10-13]。整个流程存在工作量大,耗时、消耗大量溶剂等不足。超高效液相色谱串联四级杆飞行时间质谱联用技术(UPLC-Q-TOF-MS)能快速实现中药复杂体系中化学成分的分离鉴定,已成为中药化学研究的一个活跃领域[14-18]。
黄山野生绞股蓝资源非常丰富,但基本处于未开发利用状态。本项目拟选取黄山野生绞股蓝为研究对象,采用UPLC-Q-TOF-MS技术,以具有代表性的达玛烷型皂苷标准品裂解规律和特征碎片离子为诊断信息,结合Masslynx软件、ChemSpider数据库以及文献资料,分离鉴定黄山野生绞股蓝中皂苷类物质,为黄山野生绞股蓝的开发、利用提供实验基础。
1 材料
1.1 仪器
超高效液相色谱串联四极杆飞行时间质谱仪(美国waters公司,型号:UPLC H-CLASS+QTOF G2-XS),配有电喷雾离子源(ESI),MassLynx V4.1软件。
1.2 试药
绞股蓝样品采自于黄山学院校园内,经黄山学院生命与环境科学学院翟大才副教授鉴定确认,凭证标本(标本号:HS20170828)存放于黄山学院分析测试中心。人参皂苷Rb1、Rb3、Re、Rd对照品均购自中国食品药品检定研究院,生产批号分别为110704-201223、111686-201504、110754-201324和111818-201603;乙腈、甲醇、甲酸均为色谱纯,购自美国Fisher公司;纯水为Milli-Q系统纯化水(美国Millipore公司);其余试剂均为分析纯,购自国药集团化学试剂有限公司。
2 方法
2.1 供试品溶液的制备
新鲜绞股蓝样品,50 ℃下烘干,粉碎,过3号药筛备用。称取绞股蓝粉末1 g,包入滤纸套,加入石油醚100 mL,索氏提取10 h至石油醚提取液无色,取出滤纸套内绞股蓝样品,风干至石油醚全部挥发,得到去除色素和油脂的绞股蓝样品。
称取0.5 g去除色素和油脂的绞股蓝样品,用30 mL 80%的甲醇浸泡过夜,超声提取60 min后,提取液减压蒸干,残渣加水溶解,以水饱和正丁醇溶液萃取2次,每次30 mL,合并萃取液,减压旋干,以色谱纯甲醇定容至10 mL容量瓶,摇匀,过0.22 μm微孔滤膜即得。
2.2 对照品溶液的配制
分别精密称取人参皂苷Rb1、Rb3、Re和Rd对照品适量,加甲醇溶解,配制成浓度为0.1 g/L对照品溶液,供 LC-MS 分析。
2.3 色谱条件
色谱柱waters acquity HSS T3(2.1 mm ×100 mm,1.8 μm);流速0.3 mL/min;柱温30 ℃;进样量1 μL;流动相0.1%甲酸水溶液(A)和乙腈(B);梯度洗脱条件:0~2 min,20% B;2~12 min,20%~28% B;12~14 min,28%~34% B;14~37 min,34%~70% B;37~42 min,70%~80% B。
2.4 质谱条件
电喷雾离子源(ESI),正离子扫描模式;扫描范围m/z50~1 500;毛细管电压3 kV;锥孔电压40 V;离子源温度120 ℃;干燥气温度550 ℃;干燥气流量900 L/h;碰撞电压20~30 V。
2.5 绞股蓝中已知皂苷类物质数据库的建立
根据国内外专业数据库ChemSpider及相关研究文献,收集整理了绞股蓝中已报道皂苷类物质147个,包括化合物名称,化学式,精确质量,结构式等信息,建立绞股蓝中已知皂苷数据库。
3 结果与讨论
3.1 达玛烷型皂苷对照品质谱裂解规律
文献报道皂苷类物质液质分析一般采用ESI负离子模式[14,19],本实验对比研究了绞股蓝中皂苷类成分在正、负离子模式下信号差异,结果表明正离子模式下总离子流信号明显强于负离子模式,且实验发现,在负离子模式下,即使碰撞能加到60~70 V,绞股蓝皂苷母离子都很难碎裂,离子碎片信息很少,不利于结构的推断。而在正离子模式下,碰撞能20~30 V,母离子即发生碎裂,离子碎片信息丰富,裂解规律性好,因此本实验选择正离子扫描模式。
按2.3,2.4实验条件,将4个达玛烷型皂苷对照品溶液进液质分析,分别采集正离子模式下一级、二级质谱。总结达玛烷型皂苷的裂解规律和特征碎片信息。4个达玛烷型皂苷对照品的结构式示于图1。

图1 4个达玛烷型皂苷对照品的化学结构Fig.1 Structures of 4 reference saponins with damanane type structure
Re、Rb1、Rb3和Rd四种对照品的混标,在正离子模式下的总离子流图见图2,二级质谱图见图3。由图2可知,4种对照品在正离子模式下,分离良好,有明显的信号峰。再结合相同条件下单标进样,可以确定四种皂苷Re、Rb1、Rb3和Rd的保留时间分别为4.27、15.92、17.57、18.63 min。

图2 对照品混合液总离子流图 Fig.2 Total ion chromatogram of mixed reference substances
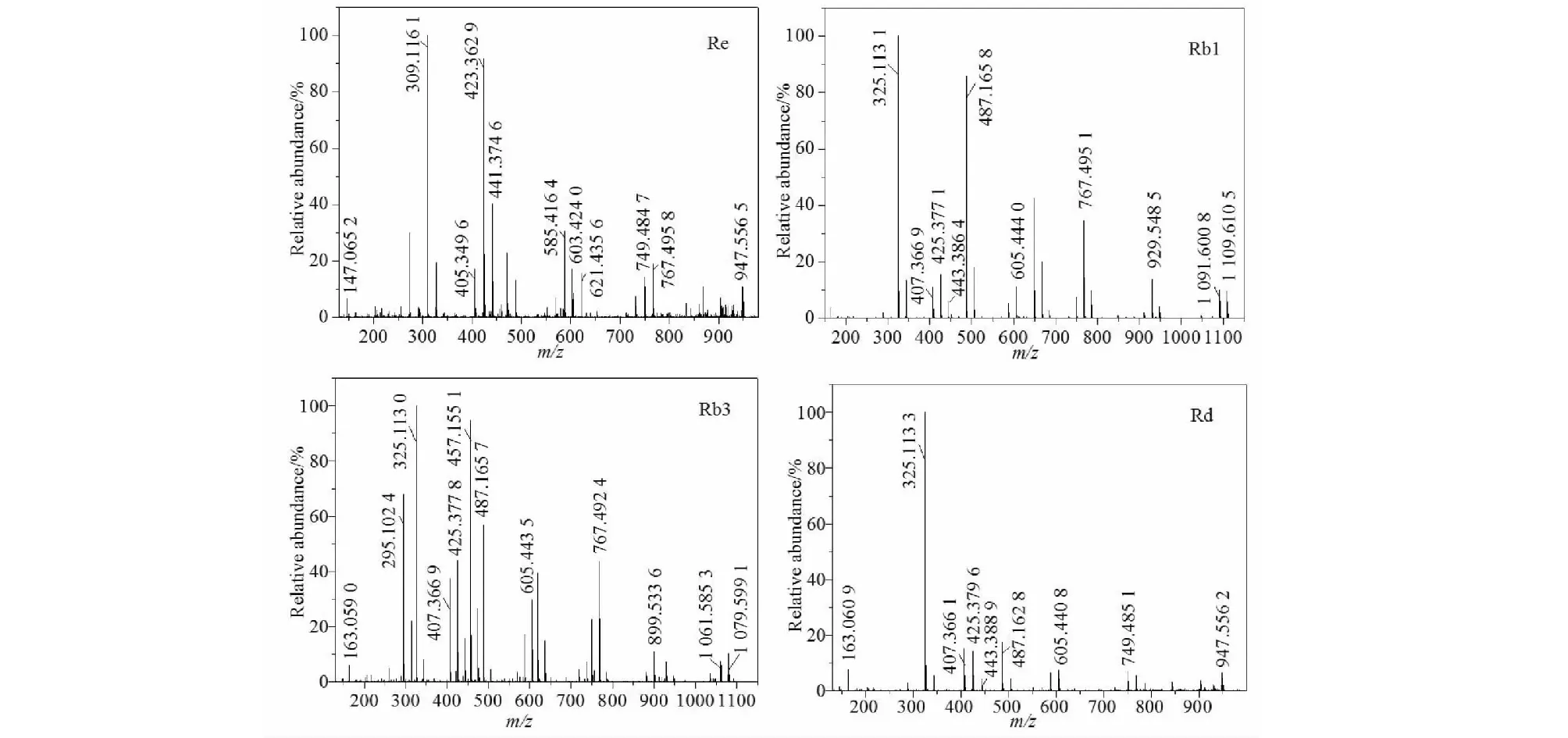
图3 Re、Rb1、Rb3和Rd在正离子模式下二级质谱图Fig.3 MSMS spectrums of Re,Rb,Rb3 and Rd in positive mode
人参皂苷Re,分子式C48H82O18,m/z947.556 5为Re的母离子峰[M+H]+,与理论值947.557 9差-1.4 mDa。m/z767.495 8为母离子失去一分子葡萄糖和一分子水后形成的碎片离子峰[M+H-Glu-H2O]+,m/z621.435 6为母离子失去一分子葡萄糖、一分子鼠李糖和一分子水后形成的碎片离子峰[M+H-Glu-Rha-H2O]+,m/z441.374 6为母离子失去两分子葡萄糖、一分子鼠李糖和两分子水后形成的碎片离子峰[M+H-2Glu-Rha-2H2O]+,m/z423.362 9为母离子失去两分子葡萄糖、一分子鼠李糖和三分子水后形成的碎片离子峰[M+H-2Glu-Rha-3H2O]+;m/z309.116 1为葡萄糖与鼠李糖相连糖的碎片离子峰[Glu-Rha+H]+;m/z147.065 2为鼠李糖的碎片离子峰[Rha+H]+。
人参皂苷Rb1,分子式C54H92O23,离子m/z1 109.610 5为皂苷Rb1的母离子峰[M+H]+,与理论值1 109.610 7差0.2 mDa。m/z1 091.600 8,929.548 5,767.495 1,605.444 0,425.377 1碎片离子分别对应[M+H-H2O]+,[M+H-Glu-H2O]+,[M+H-2Glu-H2O]+,[M+H-3Glu-H2O]+,[M+H-4Glu-2H2O]+;m/z325.113 1为两个葡萄糖相连糖的碎片离子峰[Glu-Glu+H]+;m/z163.060 6为葡萄糖的碎片离子峰[Glu+H]+。
人参皂苷Rb3,分子式C53H90O22,离子m/z1 079.599 1为母离子峰[M+H]+,与理论值1 079.600 2差-1.1 mDa。m/z1 061.585 3,899.533 6,767.492 4,605.443 5,425.377 8碎片离子分别对应[M+H-H2O]+,[M+H-Glu-H2O]+,[M+H-Glu-Xyl-H2O]+,[M+H-2Glu-Xyl-H2O]+,[M+H-3Glu-Xyl-2H2O]+。
人参皂苷Rd,分子式C48H82O18,离子m/z947.556 2为母离子峰[M+H]+,与理论值947.557 9差-1.7 mDa。m/z749.485 1,605.440 8,425.379 6碎片离子分别对应[M+H-Glu-2H2O]+,[M+H-2Glu-H2O]+,[M+H-3Glu-2H2O]+。
综上所述,达玛烷型皂苷因其苷元四环结构稳定,在正离子模式下其裂解规律主要为糖苷键的断裂和苷元上羟基脱水,产生的特征碎片分别为母离子失去162(葡萄糖:Glu),146(鼠李糖:Rha),132(木糖:Xyl)或18(水:H2O)后形成的。
3.2 黄山野生绞股蓝中皂苷类物质分析鉴定
按照2.3,2.4实验条件进样,采集供试品溶液正离子模式下总离子流图,示于图4。绞股蓝中皂苷类成分在ESI正离子模式下获得了良好响应和分离。实验中采用Masslynx软件分析处理数据,结合对照品裂解规律,文献报道,ChemSpider等数据库,快速鉴定出供试品中含皂苷类物质25种,结果见表1,以下举例说明各类皂苷物质鉴定过程。

图4 正离子模式下绞股蓝样品的总离子流图Fig.4 Total ion chromatogram of extract from Gynostemma pentaphyllum
3.2.1 利用对照品鉴别化合物
化合物18(tR=17.55 min)和19(tR=18.66 min)经与对照品比对,保留时间分别与对照品Rb3和Rd相一致,且质谱图(图5)中主要离子碎片及相对丰度也与对照品一致,因此化合物18鉴定为Rb3,化合物19鉴定为Rd。

图5 化合物18(A)和19(B)正离子模式下质谱图Fig.5 MSMS spectrums of compound 18 (A) and 19(B) in positive mode
3.2.2 利用数据库鉴定已知皂苷类化合物
已知绞股蓝皂苷中含有多种同分异构体,有些同分异构体能从质谱图中加以区分,有些则很难区分。如化合物22(tR=21.91 min)与23(tR=22.72 min)具有相同特征离子峰和裂解规律(见图6),分子离子峰均为 801.50 [M+H]+,加合离子峰m/z823.49 [M+Na]+。推断二者为同分异构体,计算元素组成为C42H72O14。俩化合物均具有相同的特征碎片峰,m/z783.49 [M+H-H2O]+;m/z621.44 [M+H-H2O-Glu];m/z441.37 [M+H-2H2O-2Glu]+。区别:对比俩质谱图,m/z621.44的丰度差别较大,化合物23在m/z621.44的丰度明显小于化合物22,说明化合物22更易失去一分子葡萄糖;且化合物23有比较明显的m/z325.119 6峰,说明化合物23的两个葡萄糖是相连的。有研究表明,两个单糖链很容易失去一个糖,而由两个糖形成的糖链失去一个糖不如失去两个糖稳定[19]。结合文献,比对数据库,可推断化合物22为:3-O-β-D-吡喃葡萄糖基2α,3β,12β,20 (S)-3羟基-达玛烷24-烯20-O-β-D-吡喃葡萄糖苷,化合物23为Gypenoside LXXIV[12],其分子示意图示于图7。
化合物14(tR=15.80 min)与15(tR=16.20 min)具有相同特征离子峰和裂解规律(见图8),均有相同的m/z1 095.59 [M+H]+,m/z1 117.57 [M+Na]+,推断二者为同分异构体,计算元素组成为C53H90O23。俩化合物均具有相同质谱碎片峰,m/z915.53 [M+H-H2O-Glu]+,783.48 [M+H-H2O-Glu-Xyl]+,m/z621.43 [M+H-H2O-2Glu-Xyl]+,m/z441.37 [M+H-2H2O-3Glu-Xyl]+,m/z163.05[Glu+H]+,m/z295.10 [Glu-Xyl+H]+。两化合物具有相同的特征碎片,且丰度基本一致,说明俩同分异构体取代基相同,只是取代基位置异构,对于此类同分异构体,质谱很难区别。结合文献[9],比对数据库,可推断化合物14和15可能为LXIX 或者 LXVII。依据此方法,共鉴定出17种已知绞股蓝皂苷,其中包含4对同分异构体。

图6 化合物22(A)和23(B)正离子模式下二级质谱图Fig.6 MSMS spectrums of compound 22 (A) and 23 (B) in positive mode

图7 化合物22和23结构示意图Fig.7 Structures of compound 22 and 23
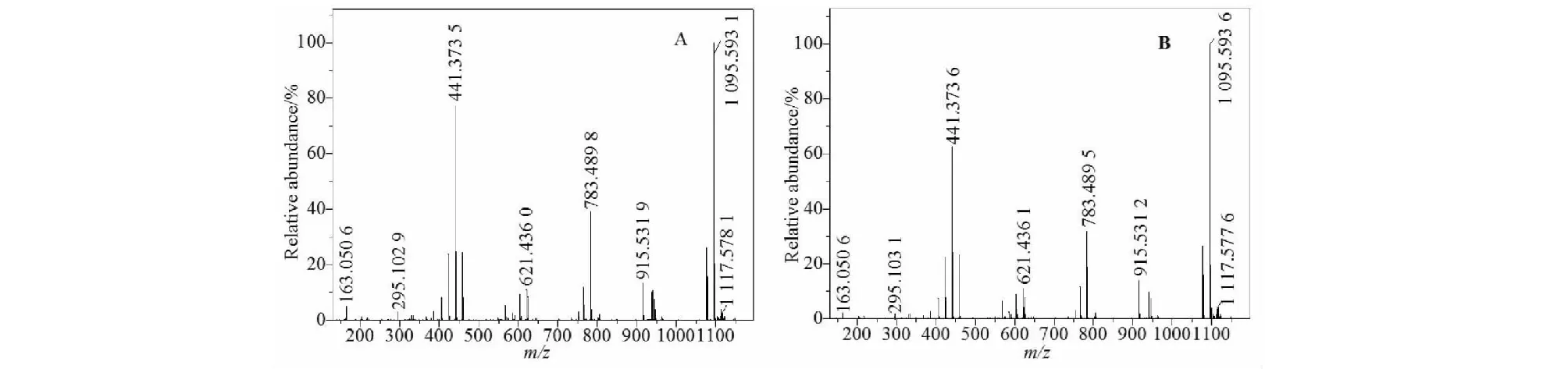
图8 化合物14(A)和15(B)正离子模式下二级质谱图Fig.8 MSMS spectrums of compound 14 (A) and 15 (B) in positive mode
3.2.3 未知苷类化合物的鉴定
化合物5、6、7和11具有相同的分子离子峰m/z995.54 [M+H]+,m/z1 017.53 [M+Na]+,这四种化合物为同分异构体,计算元素组成为C48H82O21。分析二级质谱碎片离子均有m/z815 [M+H-H2O-Glu]+,m/z653 [M+H-H2O-2Glu]+,m/z455 [M+H-3H2O-3Glu]+,符合绞股蓝皂苷质谱裂解规律,比对绞股蓝皂苷数据库,数据库中未找到符合化合物。在线检索ChemSpider数据库得到化合物(2α,3β,12β,23E)-20-(β-D-Glucopyranosyloxy)-25-hydroperoxy-2,12-dihydroxydammar-23-en-3-yl 2-O-β-D-glucopyranosyl-β-D-glucopyranoside(ChemSpider ID:58859103),其结构与该化合物二级质谱特征碎片相符,据此推测化合物5、6、7和11为ChemSpider ID:58859103或其同分异构体。这是在绞股蓝中首次发现的化合物。同理可推断化合物3和9为(3β,6α,12β)-3-{[6-O-(D-Glucopyranosyl)-β-D-glucopyranosyl]oxy}-24-hydroperoxy-6,12-dihydroxydammar-25-en-20-yl 6-O-L-arabinopyranosyl-β-D-glucopyranoside(ChemSpider ID:24641426)或其同分异构体。

表1 黄山野生绞股蓝中皂苷类化合物的鉴定结果Table 1 Identification results of saponins from wild Gynostemma pentaphyllum in Huangshan
续表1(Continued Tab.1)

编号No.tR(min)M+H观测值Observed(m/z)化学式Formula 偏差Error (mD)MSMS特征碎片Characteristic fragments(m/z)鉴定结果Identification result 1213.63931.563 9C48H82O170.9751(931-18-162)605(931-18-162-146)443(931-18-162-146-162)LXXIII1314.281 079.601 0C53H90O220.8899(1 079-162-18) 737(1 079-162-18-162) 605(1 079-162-18-162-132) 443(1 079-162-18-162-132-162)LXIII1415.801 095.593 1C53H90O23-2.0915(1 095-162-18)783(1 095-162-132-18)621(1 095-162-132-18-162) 441(1 095-162-132-18-162-162-18) LXIX / LXVII1516.201 095.593 6C53H90O23-1.5915(1 095-162-18)783(1 095-162-132-18)621(1 095-162-132-18-162) 441(1 095-162-132-18-162-162-18) LXIX / LXVII1617.111 107.596 5C54H90O231.4945(1 107-162)783(1 107-162-162)621(1 107-162-162-162)459(1 107-162-162-162-162) 1[11]1717.22963.551 4C48H82O19-1.5783(963-18-162) 621(963-18-162-162) 459(963-18-162-162-162) XLVI1817.551 079.598 5C53H90O22-1.7899(1 079-162-18)767(1 079-162-18-132)605(1 079-162-18-162-132)425(1 079-162-18-162-132-162-18)人参皂苷 Rb31918.66947.558 7C48H82O180.8749(947-18-162-18) 605(947-18-162-162)425(947-18-162-162-162-18)人参皂苷 Rd2019.03917.511 5C46H76O180.5737(917-18-162) 605(917-18-162-132)443(917-18-162-132-162) LV2120.50933.541 6C47H80O18-0.7753(933-18-162) 621(933-18-162-132) 441(933-18-162-132-162-18) LXIV2221.91801.499 2C42H72O14-0.8621(801-18-162) 441(801-18-162-162-18)LXXIV2322.72801.498 9C42H72O14-1.1621(801-18-162) 441(801-18-162-162-18) 3-O-β-D-吡喃葡萄糖基2α,3β,12β,20(S)-3羟基-达玛烷24-烯20-O-β-D-吡喃葡萄糖苷2424.69771.488 7C41H70O13-0.8591(771-18-162) 459(771-18-162-132)Gynoside A2526.40783.488 4C42H70O13-1.1621(783-162) 441(783-162-162-18) XXVIII
4 结论
绞股蓝中皂苷类化合物均为达玛烷型皂苷,本研究首先分析了4个达马烷型皂苷对照品的裂解规律和特征碎片离子,再依据其裂解规律和特征碎片离子,同时结合文献报道和数据库分析鉴定黄山野生绞股蓝中皂苷类物质。本实验从黄山野生绞股蓝中共鉴定出25个皂苷类化合物,其中有6个化合物在该植物中属首次发现,研究可为黄山野生绞股蓝的开发利用提供理论基础。
本研究建立了UPLC-Q-TOF-MS技术快速分离、鉴定绞股蓝中皂苷类化合物的分析方法,该方法能够在较短时间内完成皂苷类成分分离、鉴定工作,避免了从粗提物纯化才能鉴别的繁琐过程,为黄山野生绞股蓝药效物质基础及其作用机制研究提供了数据支撑。然而该方法也存在一定的局限性,对于一些同分异构体很难区分,还需要进一步结合核磁共振等技术进行分析。
——碳正离子的产生及稳定性比较

