褐藻多糖硫酸酯通过调控HDAC1基因的表达促进胃癌细胞凋亡*
余 亮, 江惠丽, 刘豪杰, 韩 玮
(1 鄂州市中心医院消化内科, 湖北 鄂州 436000; 2安徽医科大学第一附属医院消化内科, 安徽 合肥 230000)
褐藻多糖硫酸酯(fucoidan sulfate)又称为褐藻糖胶、岩藻聚糖,为存在于多种藻类的细胞间多糖,为一种水溶性杂多糖,主要成分有岩藻糖和硫酸根及木糖、半乳糖、甘露糖、葡萄糖、糖醛酸、蛋白质、Na+、K+和Mg2+等[1-2]。大量研究已证实,褐藻多糖硫酸酯具有抗凝血、抗氧化、调节血脂血糖、保护肾脏、抗病毒、抗肿瘤、保护神经及调节免疫的活性[3-5]。褐藻多糖硫酸酯在胃癌中的治疗作用早已有相关报道[6],但其具体的作用机制尚未十分清楚。组蛋白脱乙酰酶(histone deacetylases,HDACs)调控组蛋白和非组蛋白的去乙酰化,经典的HDACs包含HDAC1~HDAC11的成员,对于细胞增殖、分化和凋亡至关重要[7]。HDACs的异常表达或激活常出现在各种恶性肿瘤中,包括口腔鳞癌、前列腺癌和胃癌[8-10]。HDACs抑制剂可以诱导体内外的抗肿瘤作用[11]。大量研究报道,HDAC1在胃癌中具有重要作用,但其与褐藻多糖硫酸酯的作用关系尚未清楚。本研究以人胃癌细胞BGC-823为研究对象,观察褐藻多糖硫酸酯及敲减和过表达HDAC1对胃癌细胞生长和凋亡的影响,揭示其机制可能与褐藻多糖硫酸酯下调HDAC1有关,将为褐藻多糖硫酸酯治疗胃癌提供依据。
材 料 和 方 法
1 实验材料
DMEM培养基、胎牛血清、MTT和胰蛋白酶均购自GIBCO;LipofectamineTM2000、BCA蛋白定量试剂盒和逆转录试剂盒购自TaKaRa;PVDF膜购自Roche;Annexin V-FITC/PI 双染细胞凋亡检测试剂盒、SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购自碧云天生物技术公司;
2 实验方法
2.1 细胞培养 用含10%胎牛血清的DMEM培养液培养人胃癌细胞BGC-823,置于37 ℃、5% CO2的培养箱中每2~3 d更换一次培养液。
2.2 细胞转染 收集对数生长期BGC-823细胞,以每孔1×105个接种在6孔细胞板,常规培养24 h,细胞融合度约为75% 时,按照脂质体LipofectamineTM2000说明书操作步骤操作,将si-HDAC1、si-NC、pcDNA 3.1-HDAC1和pcDNA 3.1分别转染至BGC-823细胞,转染6 h后,更换培养基,除si-HDAC1组和si-NC组外,其余各组的细胞给予褐藻多糖硫酸酯0.6 g/L共培养24 h,分别标记为si-HDAC1组、si-NC组、fucoidan+pcDNA 3.1-HDAC1组和fucoidan+pcDNA 3.1组,收集各个组细胞,RT-PCR法检测转染效果。转染成功后,用于后续实验。
2.3 MTT实验 按照2.2分组取适量各组细胞,加入20 μL 5 g/L的MTT溶液,培养3.5 h,然后弃去上清,每孔加入150 μL DMSO,震荡,使结晶溶解,在490 nm波长下检测细胞吸光度(A)值。细胞的活力与吸光度值成正比。
2.4 Annexin V-FITC/PI双染流式细胞术检测细胞凋亡 按照2.2分组将各转染组细胞用结合缓冲液 500 μL 悬浮细胞,分别加入5 μL的 Annexin V-FITC和PI,混匀,室温避光静置15 min。采用流式细胞仪分析测定结果。细胞的凋亡率(%)= 早期凋亡率+晚期凋亡率。每个样品重复3次。
2.5 RT-qPCR实验 按照2.2分组取适量对数生长期各组细胞,遵照RNA抽提试剂盒说明书要求操作提取RNA,进行定量,然后按逆转录试剂盒按照说明书操作合成cDNA。最后按RT-qPCR试剂盒说明书操作进行HDAC1的mRNA检测。用2-ΔΔCt计算HDAC1的mRNA表达水平。HDAC1的上游引物序列为 5′-CGCATGACTCATAAT-3′,下游引物序列为5′-GCTGTGGTACTTGGTCATCT-3′;内参照GAPDH的上游引物序列为5′-TCCCTCAAGATTGCTAGCAA-3′,下游引物序列为5′-AGATCCACAACGGATACATT-3′。
2.6 Western blot检测 按照2.2分组取适量各组细胞,加入裂解液,冰上裂解30 min。12 000 r/min离心10 min,取上清置于EP管,加入5×SDS上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF膜;5%脱脂奶粉将膜封闭2 h,洗膜,加入Ⅰ抗,4 ℃过夜孵育,洗膜,加Ⅱ抗,4 ℃孵育2 h。加发光液,曝光。
3 统计学处理
实验中所有数据均采用SPSS 21.0软件进行分析。计量资料用均数±标准差(mean±SD)表示,多组间数据比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
结 果
1 不同浓度的褐藻多糖硫酸酯对胃癌细胞活力的影响
将胃癌细胞BGC-823培养24 h后,用MTT法检测褐藻多糖硫酸酯(0、0.2、0.4、0.6、0.8和1.0 g/L)对BGC-823细胞活力的抑制率,结果显示,与0 g/L组相比,0.2 g/L组、0.4 g/L组、0.6 g/L组、0.8 g/L组和1.0 g/L组的抑制率均显著升高,且呈浓度依赖性(P<0.05)。选用抑制率为50%左右的褐藻多糖硫酸酯浓度(0.6 g/L)用于后续实验,见图1。
2 褐藻多糖硫酸酯对胃癌细胞凋亡的影响
运用流式细胞术检测褐藻多糖硫酸酯处理过的胃癌细胞的凋亡率,与control组相比,fucoidan组细胞的凋亡率显著升高(P<0.05),见图2。
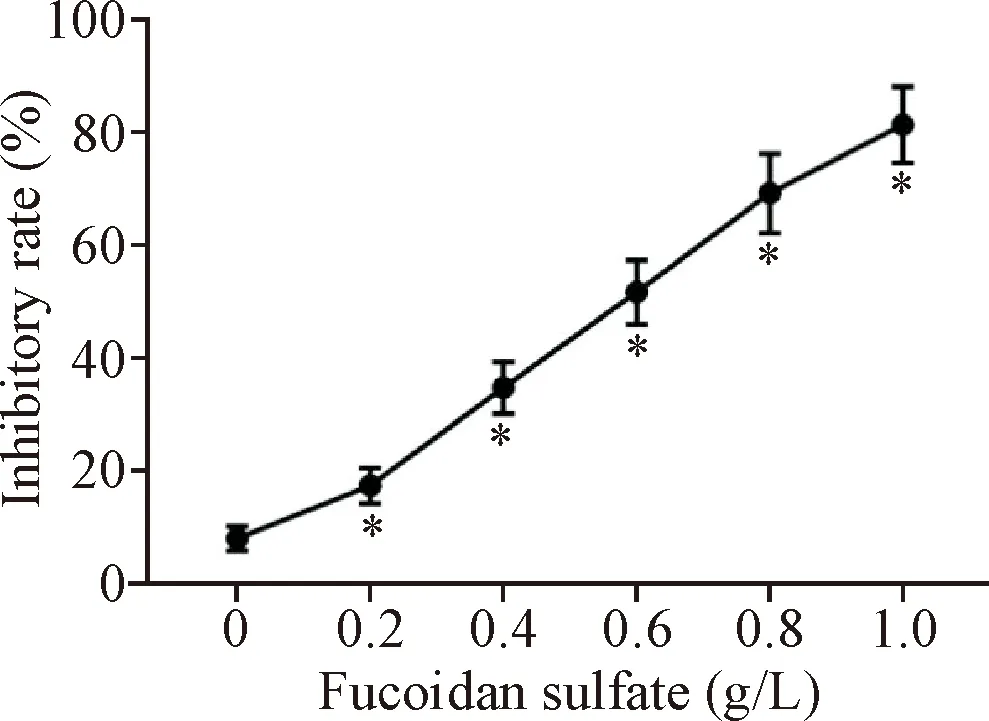
Figure 1. The effect of fucoidan sulfate on the inhibitory rate of the viability of the gastric cancer BGC-823 cells. Mean±SD.n=3.*P<0.05vs0 g/L group.
图1 褐藻多糖硫酸酯对胃癌细胞抑制率的影响
3 褐藻多糖硫酸酯对胃癌细胞中凋亡相关蛋白表达的影响
与control组相比,fucoidan组胃癌细胞中Bcl-2蛋白表达量显著降低,Bax蛋白表达量显著升高(P<0.05),见图3。
4 褐藻多糖硫酸酯对胃癌细胞中HDAC1表达的影响
运用RT-qPCR和Western blot检测胃癌细胞中HDAC1的表达,与control组相比,fucoidan组细胞中HDAC1的mRNA表达水平显著降低,HDAC1蛋白表达也显著降低(P<0.05),见图4。

Figure 2. The effect of fucoidan sulfate on apoptosis of gastric cancer BGC-823 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图2 褐藻多糖硫酸酯对胃癌细胞凋亡的影响
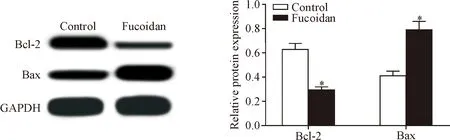
Figure 3. The effect of fucoidan sulfate on the apoptosis-related protein expression in gastric cancer cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3 褐藻多糖硫酸酯对胃癌细胞中凋亡相关蛋白表达的影响

Figure 4. The effect of fucoidan sulfate on the expression of HDAC1 in the gastric cancer BGC-823 cells. A :the mRNA expression of HDAC1; B: the protein expression of HDAC1. Mean±SD.n=3.*P<0.05vscontrol group.
图4 褐藻多糖硫酸酯对胃癌细胞中HDAC1表达的影响
5 敲减胃癌细胞HDAC1的表达
将si-HDAC1和si-NC转染BGC-823细胞,与si-NC组细胞相比,si-HDAC1组细胞中HDAC1的mRNA和蛋白表达显著降低(P<0.05),见图5。
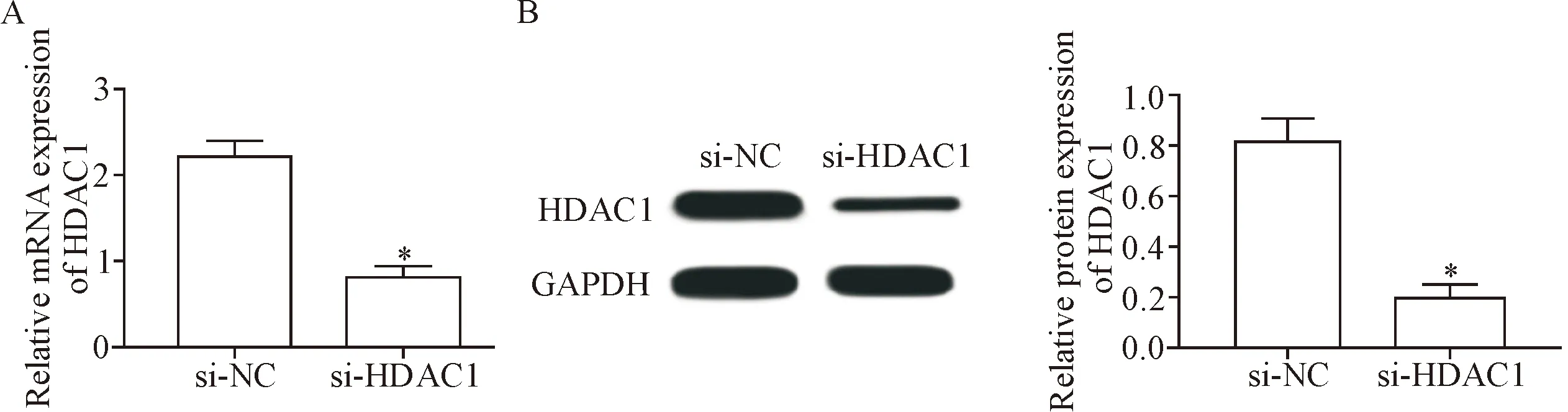
Figure 5. Knock-down ofHDAC1expression in the gastric cancer BGC-823 cells. A: the mRNA expression of HDAC1; B: the protein expression of HDAC1. Mean±SD.n=3.*P<0.05vssi-NC group.
图5 敲减胃癌细胞HDAC1的表达
6 敲减HDAC1的表达对胃癌细胞活力和凋亡的影响
与si-NC组相比,si-HDAC1组细胞活力在48和72 h时显著降低(P<0.05),见图6A,细胞凋亡率显著升高(P<0.05),见图6B。
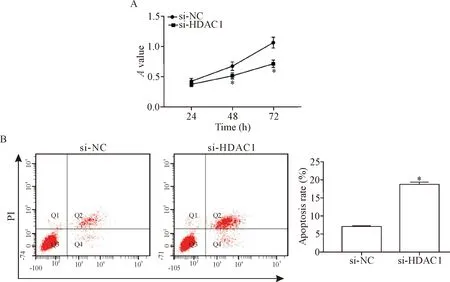
Figure 6. The effect ofHDAC1expression knock-down on the viability and apoptosis of the gastric cancer BGC-823 cells. A: the changes of the cell viability; B: the changes of the apoptosis. Mean±SD.n=3.*P<0.05vssi-NC group.
图6 敲减HDAC1表达对胃癌细胞活性和凋亡的影响
7 过表达HDAC1逆转了褐藻多糖硫酸酯对胃癌细胞活力的抑制和凋亡的促进作用
与control组相比,fucoidan组细胞中HDAC1的蛋白表达量显著降低(P<0.05),细胞活力显著降低(P<0.05),细胞凋亡率显著升高(P<0.05);与fucoidan+pcDNA 3.1组相比,fucoidan+pcDNA 3.1-HDAC1组细胞中的HDAC1蛋白表达量显著升高(P<0.05),细胞活力显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),见图7。
讨 论
大量研究表明,褐藻多糖硫酸酯具有抗炎、抗氧化、抗凝血、抗免疫缺陷和抗肿瘤等多种生物活性[12-14]。值得注意的是褐藻多糖硫酸酯在乳腺癌、前列腺癌、肺癌、肝癌和白血病等多种肿瘤的治疗中具有较高的疗效[15]。Park等[16]发现褐藻多糖硫酸酯通过诱导自噬和凋亡能有效地抑制胃癌细胞的生长,其机制与抗凋亡Bcl-2和Bcl-xL表达的下调,线粒体膜电位的丧失,半胱天冬酶的激活以及多聚(ADP-核糖)聚合酶蛋白的伴随降解和微管相关蛋白轻链3(LC3)-I向LC3-II的转化和增加beclin-1的积累相关,表明褐藻多糖硫酸酯诱导细胞凋亡和自噬细胞死亡,凋亡和自噬机制都有助于褐藻多糖硫酸酯诱导的胃癌细胞死亡。Yoshimoto等[17]发现,在胃癌细胞MKN45中褐藻多糖硫酸酯可下调磷酸化ASK1水平,失活ASK1-p38信号通路,从而抑制MKN45细胞增殖及DNA合成。本研究检测了褐藻多糖硫酸酯(0、0.2、0.4、0.6、0.8和1.0 g/L)处理的BGC-823细胞的抑制率发现,褐藻多糖硫酸酯对BGC-823细胞的抑制率呈浓度依赖性递增,且最适浓度为0.6 g/L;流式细胞术检测褐藻多糖硫酸酯处理的BGC-823细胞凋亡发现,褐藻多糖硫酸酯可上调BGC-823细胞的凋亡率,下调Bcl-2,上调Bax表达;深入研究发现,褐藻多糖硫酸酯可下调BGC-823细胞中HDAC1的表达,推测褐藻多糖硫酸酯的作用机制可能与抑制HDAC1表达相关。这是国内外首次发现的褐藻多糖硫酸酯的功能机制。
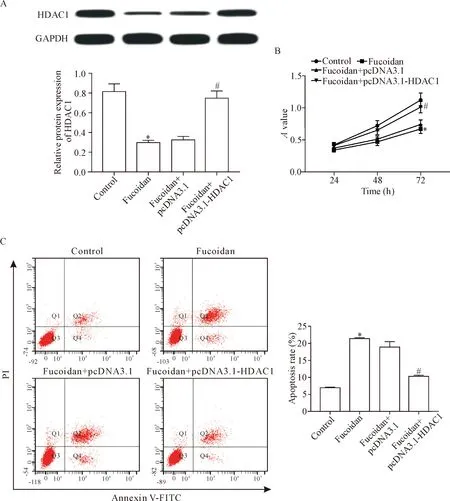
Figure 7. Over-expression of HDAC1 reversed the inhibition of cell viability and the promotion of apoptosis in the gastric cancer BGC-823 cells induced by fucoidan sulfate. A: the changes of HDAC1 protein level; B: the changes of the cell viability; C: the changes of the apoptosis. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsfucoidan+pcDNA 3.1 group.
图7 过表达HDAC1逆转了褐藻多糖硫酸酯对胃癌细胞活性的抑制和凋亡的促进作用
在过去的几十年中的研究显示,表观遗传异常可能是肿瘤的标志之一。例如,组蛋白的翻译后修饰可能通过调节基因转录,染色质重塑和核结构在肿瘤发展和进展中发挥关键作用[18]。组蛋白乙酰化是一项研究良好的翻译后组蛋白修饰,由组蛋白乙酰转移酶(HATs)和组蛋白脱乙酰酶(HDACs)的相反活性控制[19]。通过去除乙酰基,HDAC逆转染色质乙酰化并改变癌基因和抑癌基因的转录[20]。此外,HDAC使许多非组蛋白细胞底物脱乙酰化,这些底物控制着广泛的生物过程,包括肿瘤的发生和发展[21]。早在2001年,Choi等[22]在胃癌的研究中已证实,HDAC1在胃癌组织中过度表达,且大多定位于肿瘤细胞的细胞核。Nakagawa等[23]阐明,HDAC1、2、3和8组成的I类HDAC在人类的几种肿瘤及癌细胞中高表达,包括胃癌、食道癌、结肠癌、前列腺癌、乳房癌、卵巢癌、肺癌、胰腺癌和甲状腺癌,表明了HDAC抑制剂可用于治疗人类的多种肿瘤。Cao等[24]在胃肠道恶性肿瘤的研究中阐明,HDAC1在胃肠道恶性肿瘤中的表达水平,特别是在结直肠癌中的表达水平明显高于非癌组织,且其与肿瘤分期及分级显著正相关,与患者总体存活率呈负相关,提示HDAC1可以作为胃肠道恶性肿瘤的良好诊断和预后标志物。本研究检测敲减HDAC1表达的胃癌细胞凋亡时发现,敲减HDAC1表达可促进胃癌细胞凋亡;过表达HDAC1可逆转褐藻多糖硫酸酯对胃癌细胞凋亡的促进作用。
综上所述,褐藻多糖硫酸酯可促进胃癌细胞凋亡,其机制可能与褐藻多糖硫酸酯负向调控HDAC1有关。本研究结果为褐藻多糖硫酸酯用于胃癌的预防和治疗提供了依据。

