血根碱抑制人胃癌SGC-7901细胞增殖、迁移和细胞周期的研究
胡 灿,金建伟,陆仲夏,3,徐志远,倪益秀,吕 航,汪丽菁,程向东
(1. 浙江中医药大学第一临床医学院,浙江 杭州 310053;2. 浙江中医药大学附属第一医院胃肠外科,浙江 杭州 310006;3. 中国海洋大学医药学院,山东 青岛 266100;4. 浙江省肿瘤医院超声科,浙江 杭州 310022)
胃癌是我国常见的恶性肿瘤之一,其中有65%~70%的患者在就诊时已为中晚期。药物治疗包括分子靶向治疗是中晚期胃癌治疗的重要手段,尽管近年来针对胃癌的新型靶向药物研究取得了一定的进展,但普遍存在敏感性低、耐药发生率高等问题,制约着临床应用和疗效。近年来,运用中草药治疗胃癌已成为目前国内外研究的热点[1]。血根碱(sanguinarine,San)分子式为C20H14NO4,分子量为332,是一种苯并菲啶类生物碱,主要来源于博落回、血水草等中草药[2]。文献报道,血根碱具抗菌、消炎、驱虫等多种药理学作用,并且其抗癌作用得到了越来越多的关注[3]。本研究以胃癌SGC-7901细胞为研究对象,探究血根碱对胃癌细胞增殖、迁移及细胞周期的影响,为血根碱用于治疗胃癌提供理论依据。
1 材料
1.1 细胞株胃癌SGC-7901细胞为浙江中医药大学附属第一医院中心实验室冻存。
1.2 药物与试剂血根碱(批号BP1253),购自成都普瑞法科技开发有限公司,用DMSO配制成2 mmol·L-1浓度,使用前,用培养基配制成所需浓度。RPMI 1640细胞培养基、胎牛血清,均购自美国Gibco公司;MTT细胞活性试剂盒,购自美国Sigma公司;细胞周期检测试剂盒,购自康为世纪生物科技有限公司;细胞裂解液、GAPDH抗体、ECL反应液,均购自碧云天生物科技有限公司;基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)、MMP-9、细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶4(cyclin dependent kinases 4, CDK4)、p16抗体,均购自Cell Signaling Technology。
1.3 仪器FC500流式细胞仪(Beckman公司);冷冻离心机(Eppendrof公司);酶标仪(Thermo Scientific公司)。
2 方法
2.1 人胃癌SGC-7901细胞的培养将冻存的人胃癌SGC-7901细胞置于37 ℃恒温水浴箱中,使其融化,移入离心管,加入5 mL RPMI 1640培养液吹打均匀,1 000 r·min-1离心5 min,弃上清液。加入5 mL含10%胎牛血清的RPMI 1640培养液悬浮细胞,反复吹打使细胞均匀分散,接种到培养瓶中,置于37 ℃、5% CO2培养箱中培养备用。
2.2 细胞形态学观察将SGC-7901细胞铺于96孔板中,培养24 h。用培养液将血根碱稀释成不同浓度(3、6、9 μmol·L-1),加入胃癌细胞中,正常对照组加入培养液,继续培养24 h。置于倒置显微镜下,观察其细胞形态及生长状态。
2.3 MTT法检测细胞活性取对数生长期的SGC-7901细胞,以每孔1×104个细胞接种于96孔板中,5% CO2、37 ℃饱和湿润条件培养24 h。设置空白对照组(含培养液)、血根碱低、中、高浓度组(3、6、9 μmol·L-1)。加药培养24 h后,每孔加入20 μL MTT溶液,避光37 ℃孵育2 h。酶标仪490 nm波长检测吸光度,存活率%=(实验组OD值/对照组OD值)×100%。该实验重复3次。
2.4 流式细胞术检测细胞周期取对数期的SGC-7901细胞,以1×106个每孔接种于6孔板中,培养24 h。加药处理方式同“2.3”。继续培养24 h,胰酶消化后,吹打混匀,收集细胞悬液,1 000 r·min-1离心后,弃上清。PBS溶液洗涤后,用500 μL 1×Binding buffer重悬,吸取100 μL重悬液于1.5 mL离心管中,向每管加入5 μL PI,室温避光孵育15 min,1 h内进行流式细胞术检测。
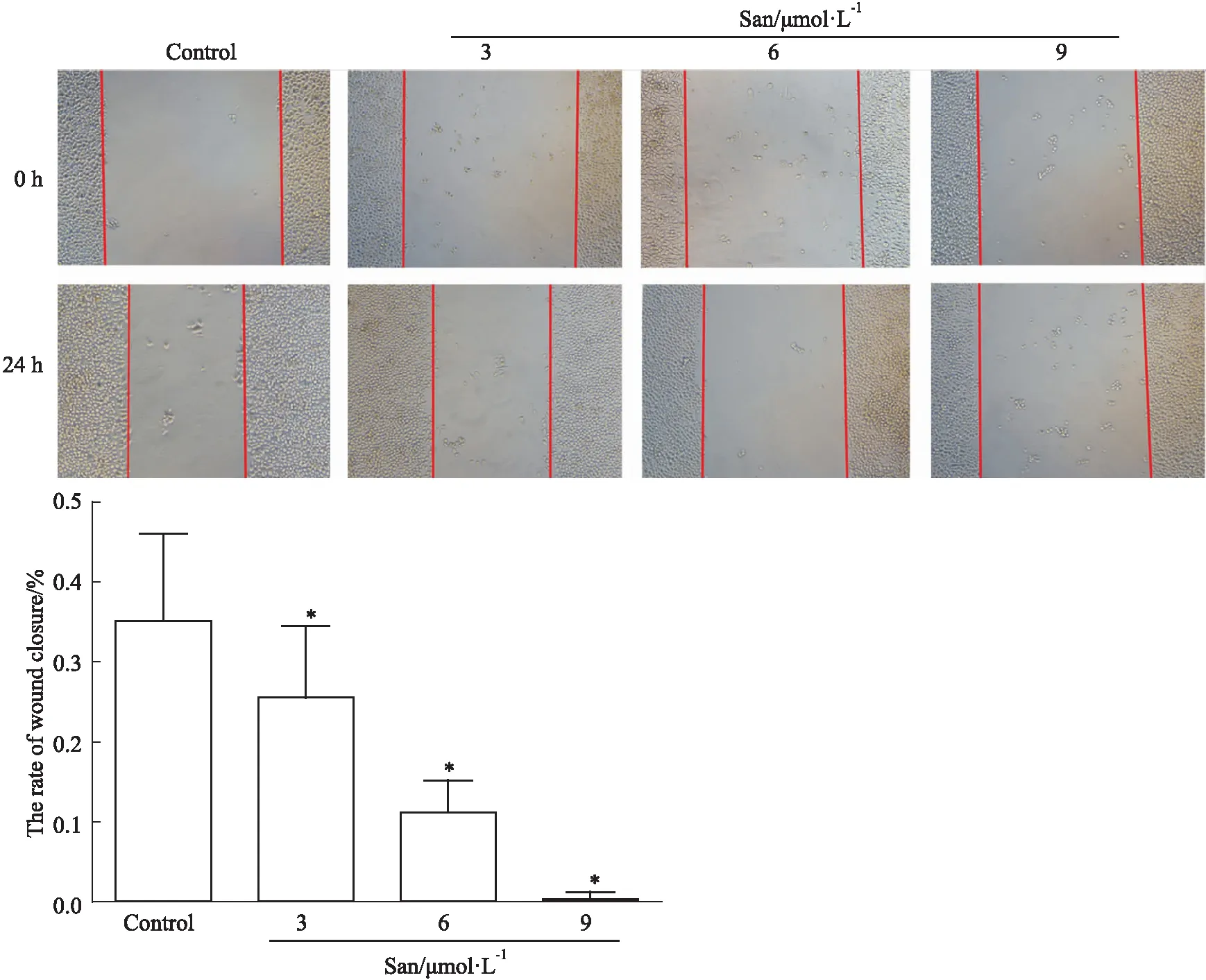
2.5 划痕法检测细胞迁移取对数期的SGC-7901细胞,以5×105个每孔接种于6孔板中培养。当细胞单层铺于板底约90%时,用200 μL灭菌的枪头垂直于孔板,轻轻划线,每组设计3个平行孔,弃去培养液,并用PBS轻轻冲洗细胞碎片,并在倒置显微镜下拍照。然后加入含不同浓度血根碱(0、3、6、9 μmol·L-1)的培养液培养24 h,在倒置显微镜下拍照。以上实验重复3次。愈合比%=(0 h空白面积-24 h空白面积)/0 h空白面积×100%。
2.6 Western blot检测蛋白表达取对数生长期的胃癌细胞,以1×106个每孔接种于6孔板中,培养24 h。加药培养24 h,收集细胞悬液,离心后弃上清。在冰上,以蛋白裂解液裂解细胞30 min,并每隔10 min振荡混匀1次。4 ℃、12 000 r·min-1离心15 min,取上清。BCA法测蛋白浓度,经SDS-PAGE电泳、转膜后,室温封闭2 h;TBST洗膜3次后,4 ℃一抗孵育过夜。TBST再次洗膜3次后,室温孵育二抗2 h,TBST洗膜3次,条带经ECL孵育后,于暗室扫膜显影。
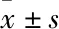
3 结果
3.1 血根碱对胃癌SGC-7901细胞形态的影响给药24 h后,在倒置显微镜下观察细胞形态。如Fig 1所示,对照组细胞生长正常,排列紧密、胃癌细胞呈菱形。血根碱处理后,胃癌细胞贴壁情况下降,细胞皱缩呈圆形,出现细胞破裂情况。血根碱能抑制胃癌细胞生长,并改变胃癌细胞形态。
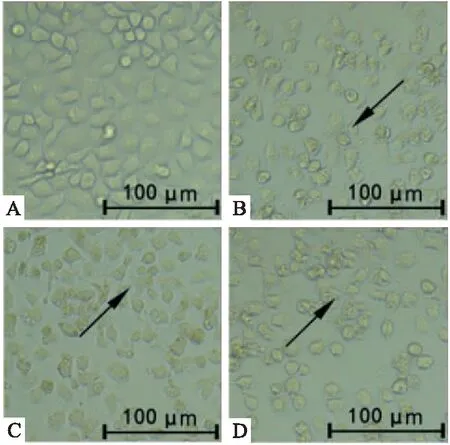
Fig 1 Effect of sanguinarine on morphology of SGC-7901 cells
A: Control; B: 3 μmol·L-1sanguinarine; C: 6 μmol·L-1sanguinarine; D: 9 μmol·L-1sanguinarine.Arrows indicated cell morphology of SGC-7901 cells in gastric cancer treated with sanguinarine.
3.2 血根碱对胃癌SGC-7901细胞活性的影响Fig 2结果显示,与对照组相比,血根碱(3、6、9 μmol·L-1)作用于胃癌SGC-7901细胞后,细胞存活率明显降低(P<0.05)。血根碱在3~9 μmol·L-1浓度范围内,对SGC-7901细胞的活性有明显抑制作用,且呈浓度依赖性。
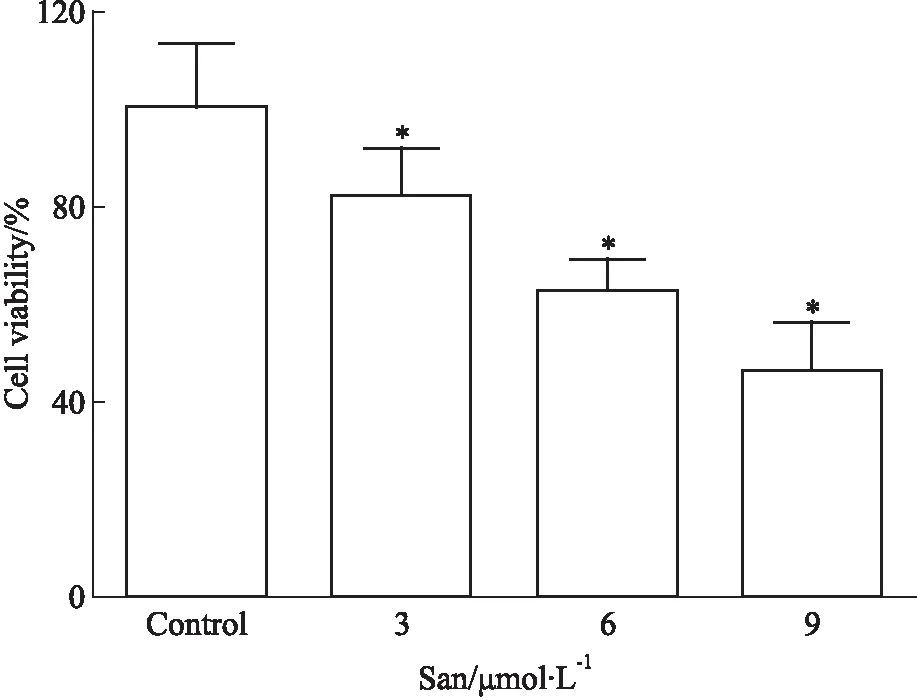
Fig 2 Effect of sanguinarine on cell
3.3 血根碱对胃癌SGC-7901细胞周期的影响如Fig 3所示,与对照组相比,血根碱作用人胃癌SGC-7901细胞24 h后,G1期细胞明显增多,且呈浓度相关性。血根碱阻滞SGC-7901细胞于G0/G1期。
3.4 血根碱对胃癌SGC-7901细胞迁移的影响用倒置显微镜拍摄加药0、24 h时,胃癌细胞的划痕愈合情况。如Fig 4所示,随着血根碱浓度的提高,细胞划痕的愈合趋势逐渐减弱。提示血根碱抑制胃癌SGC-7901细胞的迁移能力。
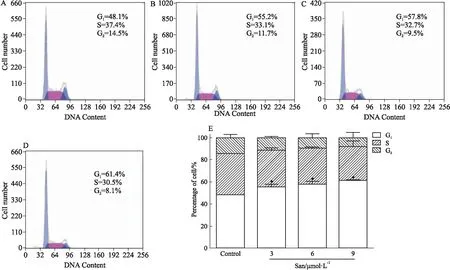
Fig 3 Effect of sanguinarine on cell cycle of SGC-7901
A: Control; B: 3 μmol·L-1sanguinarine; C: 6 μmol·L-1sanguinarine; D: 9 μmol·L-1sanguinarine; E: Quantitative map of sanguinarine on SGC-7901 cells.*P<0.05vscontrol.
*P<0.05vscontrol
3.5 血根碱对SGC-7901细胞中MMP-2、MMP-9、p16、CDK4及cyclin D1蛋白水平的影响如Fig 5所示,血根碱明显下调胃癌细胞MMP-2、MMP-9的蛋白表达量(P<0.05)。细胞周期相关蛋白检测结果显示,血根碱明显下调CDK4、cyclin D1的蛋白表达(P<0.05),明显上调p16的蛋白表达(P<0.05)。
4 讨论
胃癌是全球第二大常见的消化系统肿瘤,近年来,其发病率和死亡率呈快速上升的趋势[4]。目前治疗胃癌的方法主要有手术和放化疗,但因其价格昂贵、副作用大,并不能让患者满意。中药治疗胃癌已经具有数千年的临床经验,具有疗效好、不良反应少等特点[5]。血根碱是从中药罂粟科博落回中提取的一种成分,具有广泛的药理作用。血根碱能改善多种药物引起的肝损伤。有研究表明,血根碱能刺激B淋巴细胞和T淋巴细胞增殖,增强机体免疫的功能。此外,血根碱对宫颈癌、结肠癌、舌癌等多种肿瘤具有明显的抑制和杀伤作用,具备成为抗癌药物的潜力[6]。国内有学者研究发现,血根碱能通过下调宫颈癌中MMP-2、MMP-9的表达,调节宫颈癌细胞的侵袭和转移能力,并呈现一定程度的剂量依赖性[7]。
胃癌细胞的迁移与侵袭是胃癌扩散和复发的重要原因[8]。肿瘤细胞在侵袭和转移过程中必须破坏细胞外基质(extracellular matrix,ECM)[9]。而MMP能有效降解ECM的主要成分Ⅳ型胶原[10]。因此,MMP-2及MMP-9的蛋白表达量常用于反映细胞的迁移及侵袭能力,血根碱能通过下调MMP-2和黏附蛋白(E-cadherin),抑制宫颈癌细胞的侵袭能力[11]。本研究发现,血根碱能抑制胃癌SGC-7901细胞的迁移能力,并且随着药物浓度的增加,抑制作用越强。通过蛋白免疫印迹法检测迁移相关蛋白MMP-2、MMP-9结果显示,血根碱明显下调胃癌细胞MMP-2、MMP-9的蛋白表达量,且与浓度相关,表明血根碱可能通过下调胃癌细胞的MMP-2、MMP-9的蛋白表达量,从而抑制胃癌细胞的迁移能力。
细胞周期的紊乱导致细胞过度增殖是胃癌发生的重要原因[12]。G1期与S期的节点是重要的细胞周期调控点,由细胞周期蛋白(cyclins)、细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinases inhibitors, CKIs)、CDKs等蛋白精准调控[13-14]。Cyclin D1与CDK4形成的cyclin/CDK激酶复合物,是细胞由G1期进入S期所必需的[15]。而p16蛋白与CDKs竞争性结合cyclin D,并阻碍其与cyclin D形成激酶复合物,从而阻止细胞从G1期进入S期,细胞增殖受抑制。在本研究中,流式细胞术结果显示,血根碱作用胃癌SGC-7901细胞24 h后,处于G1期胃癌细胞的比例明显上升,S期的比例明显下降,存在G1/S阻滞。蛋白免疫印迹结果显示,与空白对照组相比,血根碱作用后cyclin D1、CDK4蛋白表达量明显下调,而p16蛋白表达明显上调。以上结果表明,不同浓度的血根碱通过调控cyclin D1、CDK4及p16的蛋白表达,阻滞细胞周期进展,最终抑制胃癌细胞增殖。

Fig 5 Effect of sanguinarine on expression levels of MMP-2, MMP-9, cyclin D1, CDK4 and
*P<0.05vscontrol
综上所述,本研究表明血根碱在体外表现出较强抑制胃癌细胞生长的作用,其机制可能与阻滞胃癌细胞周期有关,同时血根碱还能通过抑制胃癌细胞的迁移达到抗癌目的,为血根碱用于治疗胃癌的临床研究提供了重要的理论依据。