基于脂质代谢组学评价五味子素B诱导的急性高甘油三酯血症小鼠模型
王晓艳,储著胜,张 辉,张书琦,潘思源,唐进法,高锦明
(1. 河南中医药大学第一附属医院药学部,河南 郑州 450000;2. 北京中医药大学中药学院,北京 100102;3. 浙江中医药大学学生处,浙江 杭州 310053;4. 河南中医药大学药学院,河南 郑州 450008;5. 香港科技大学生命科学部,香港 999077)
高脂血症是指血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-C)升高或者高密度脂蛋白胆固醇(high density lipoproteincholesterol,HDL-C)降低的一种脂代谢异常性疾病,亦被称为脂质异常血症[1]。高脂血症是诸多疾病的重要诱因,包括动脉粥样硬化、冠心病、心肌梗死等。因此,降脂药物的开发越来越受到人们的重视,而制备与临床疾病相近似、稳定性好、可行性高、适用性和可控性强、简单易行的适合于降血脂药物研究,尤其是药物筛选的动物模型尤其重要。目前,制备高脂血症模型的常用动物包括鼠类、兔、猪等,造模方法包括高脂饲料喂养法[2]、脂肪乳剂灌胃法[3]、复合因素造模法[4]、Triton WR-1339肌肉注射法[5]等。最常用的造模方法是给动物喂养高脂饲料,但高脂饲料配方不统一,有的含有化学药品。模型主要的表现是血TC升高,而TG升高不明显,甚至降低,而且制备流程繁琐和耗时较长。
五味子素B(schisandrin B,Sch B)作为传统中药五味子中含量最高的联苯环辛烯类木脂素,具有解毒保肝[6]、抗炎[7]、抗氧化[8]、抗肿瘤[9]等药理作用。前期研究发现,Sch B(0.1~2 g·kg-1)一次给药,在12~96 h内就能很好地模拟临床高脂血症-脂肪肝-肝损伤的发病过程,并为降血脂药非诺贝特所逆转[10-11]。脂质代谢组学是研究脂质代谢调控的新学科,能够从系统分子水平上对生物体内的脂质类代谢产物进行研究,进而分析整体脂质代谢轮廓的变化[12]。因此,本研究利用脂质代谢组学技术,进一步阐明Sch B诱发高甘油三酯血症小鼠血清脂质代谢物的改变,筛选相关差异代谢物,为新模型提供脂代谢组学实验依据。
1 材料与方法
1.1 仪器与试剂超高效液相色谱-四极杆飞行时间质谱联用仪(UPLC-Q/TOF-MS,美国Waters公司);真空离心浓缩仪(miVac Duo,英国GeneVac公司);分析天平(Mettler Toledo AL204,瑞士梅特勒-托利多公司);低温台式高速离心机(Neofuge 1600R,上海力申科学仪器有限公司)。Sch B,香港科技大学高锦明教授提供,纯度大于95%;甲醇和乙腈均购于北京化工厂;氯仿购于美国Sigma;TC试剂盒和TG试剂盒,均购自中生北控生物科技股份有限公司。
1.2 动物分组与给药ICR小鼠,♂,体质量(23~27) g,购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001。高脂/糖饲料配方:基础饲料80%、猪油10%、果糖10%,加水适量,充分混匀,浸泡过夜,捏成适当大小的块状,自然晾干,备用。
小鼠分4组,每组10只,分别为正常饲料(normal diet,ND)组、ND+Sch B组、高脂高糖饲料(high fat/fructose diet,HFFD)组、HFFD+Sch B组。各组小鼠分别用正常饲料和高脂高糖饲料喂养10 d,根据前期研究结果,选择最大效应剂量的Sch B(2 g·kg-1,其有效剂量为0.1~2 g·kg-1,一次给药的最大耐受量大于5 g·kg-1)用橄榄油配制,于d 8灌胃给药,对照组用橄榄油(5 mL·kg-1)灌胃。48 h后,小鼠眼眶取血,存放EP管中,静置2 h,4 ℃、3 500 r·min-1离心8 min,取上部血清,-80 ℃保存。
1.3 生化学检测取血清,按照试剂盒说明书操作,检测血清TG和TC含量。
1.4 血清样本前处理与UPLC-Q/TOF-MS分析条件取各组小鼠血清100 μL置1.5 mL离心管中,加入蛋白沉淀剂氯仿 ∶甲醇=3 ∶1(V/V)500 μL,涡旋提取5 min后,常温静置10 min,低温(4 ℃)12 000 r·min-1离心5 min。取上清100 μL,离心浓缩,以100 μL异丙醇 ∶乙腈=1 ∶1(V/V)进行复溶。采用同样的处理方法制备质量控制(quality control,QC)样本。
色谱分离条件:分离系统中采用色谱柱Waters UPLC CSH C18(2.1 mm×100 mm,1.7 μm),柱温设定为50 ℃。流动相A为乙腈 ∶水=4 ∶6(V/V),其中含0.1%甲酸和10 mmol·L-1甲酸铵;流动相B为乙腈 ∶异丙醇=9 ∶1(V/V),其中含0.1%甲酸和10 mmol·L-1甲酸铵。流速:0.3 mL·min-1,进样量为2.0 μL。采用梯度洗脱,0~1 min,40% B;1~16 min,40%~100% B;16~18 min,100% B;18~20 min,100%~40% B;20~22 min,40% B。
质谱检测参数:采用Xevo G2-S Q/TOF-MS质谱系统,电喷雾离子源(electrospray ionization,ESI)正负两种模式,各气路均使用氮气;扫描范围:m/z 50~1 200,分辨率设定为30 000。锥孔电压:35 V;离子源温度120 ℃;毛细管电压:3200V(+)/2500V(-);脱溶剂气温度:400 ℃;脱溶剂气流速:800 L·H-1;圆锥气流速:50 L·H-1。
1.5 数据处理使用Masslynx 4.1数据管理软件采集,将LC/MS分析得到的数据导入Progenesis QI软件,对数据进行读取、色谱峰自动识别、峰匹配等一系列处理,再将得到的数据导入SIMCA-P 13.0软件进行(正交)偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)。OPLS-DA分析后,取VIP值大于1的所有数据进行显著性统计分析,两组间样本比较采用t检验,P<0.05的代谢物即可能为潜在的差异代谢物。
2 结果
2.1 建立高脂血症动物模型Tab 1结果显示,ND+Sch B组小鼠血清TG水平是ND组的3.71倍(P<0.01),TC水平无明显变化。与ND组比,HFFD组小鼠血清TC水平明显升高18.18%(P<0.05),TG水平无明显变化。与HFFD组比,HFFD+Sch B组小鼠血清TG水平是前者的4.17倍(P<0.001),虽然TC水平升高16.67%,但无统计学意义(P>0.05)。与ND组比,HFFD+Sch B组小鼠血清TG和TC水平分别升高267.46%和37.88%(P<0.01)。
Tab 1 Changes of serum lipids in
*P<0.05,**P<0.01vsND;##P<0.01vsHFFD
2.2 建立脂质代谢组学方法为了尽可能地测定血清中所有脂质成分,采用正负离子两种检测模式,并对样本的提取方法、色谱分离条件和质谱检测条件进行了优化,建立的方法可检测到血清中磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰胆碱(phosphatidylcholine,PC)、神经鞘磷脂(sphingomyelin,SM)、磷脂酰肌醇(phosphatidylinositol,PI)、胆甾醇酯(cholesteryl ester)、TG等脂质分子。利用ESI正、负离子模式分别采集各组小鼠血清样本数据,获取血清样本的总离子流图。Fig 1、2显示,PE主要集中在0~4 min内洗脱,PI主要集中在4~8 min内洗脱,SM和PC主要集中在8~14 min内洗脱,而TG和胆甾醇酯主要集中在15~18 min内洗脱。所有代谢物在20 min内均能得到很好的分离,且4组的轮廓明显不同,由此说明本研究所建立的脂质代谢组学方法可行,较为全面地反映了各组小鼠血清中的主要脂质类成分的变化。
2.3 脂质代谢组学表征用半定量数据所得矩阵,建立正交偏最小二乘判别分析模型(OPLS-DA)区分ND组(a)和ND+Sch B(b)组小鼠的脂质代谢轮廓图。正离子模式下模拟的拟合参数为R2X=0.940,R2Y=0.981,Q2=0.959;负离子模式下模拟的拟合参数为R2X=0.923,R2Y=0.998,Q2=0.960,说明拟合得到的模型较好。OPLS-DA模型得分图见Fig 3A、3C。结果显示,ND组和ND+Sch B组存在明显的区分,说明这2组小鼠的血清脂质代谢轮廓图差异存在显著性。
采用OPLS-DA区分ND组(a)、HFFD组(c)、HFFD+Sch B组(d)小鼠的脂质代谢轮廓图,正离子模式下模拟的拟合参数R2X=0.951,R2Y=0.914,Q2=0.868,说明拟合得到的模型较好。负离子模式下模拟的拟合参数为R2X=0.890,R2Y=0.807,Q2=0.431。OPLS-DA模型得分图见Fig 3B、3D。结果显示,ND组、HFFD组和HFFD+Sch B组存在明显的区分,说明这3组小鼠的血清脂质代谢轮廓图差异存在显著性。
2.4 差异化合物的分析通过OPLS-DA载荷图和单因素方差分析寻找Sch B诱导高脂血症的差异代谢物,依据代谢产物的精确质量数查询HMDB(http://www.hmdb.ca)和LIPID MAPS(http://www.lipidmaps.org)等数据库,对差异性脂质分子进行结构归属。结果发现,ND+Sch B组TG(54 ∶4)、TG(54 ∶3)、TG(52 ∶4)、TG(54 ∶6)、TG(54 ∶2)、TG(54 ∶7)、TG(56 ∶7)、TG(50 ∶3)、TG(56 ∶5)、TG(50 ∶2)、TG(58 ∶8)、TG(56 ∶8)、TG(58 ∶9)、TG(56 ∶4)、TG(58 ∶10)、TG(50 ∶4)、TG(56 ∶3)、TG(52 ∶6)、PC(18 ∶0/18 ∶2)、PC(18 ∶1/18 ∶0)、PC(18 ∶2/16 ∶0)、PC(18 ∶1/20 ∶3)、PC(18 ∶1/16 ∶0)、PC(18 ∶2/0 ∶0)、PC(20 ∶4/16 ∶0)、PE(22 ∶6/0 ∶0)含量高于ND组,PE(18 ∶0/0 ∶0)含量低于ND组;HFFD组SM(d18 ∶1/16 ∶0)、PC(18 ∶1/18 ∶0)、Cholesteryl ester(20 ∶4)、SM(d16 ∶1/20 ∶0)、Cholesteryl ester(22 ∶6)、PC(18 ∶2/P-18 ∶1)、PC(O-16 ∶0/20 ∶4)、PC(22 ∶4/18 ∶1)、PC(18 ∶0/22 ∶5)、SM(d18 ∶2/18 ∶0)、PI(18 ∶0/20 ∶4)、TG(54 ∶1)、SM(d18 ∶2/16 ∶0)、PC(P-16 ∶0/20 ∶4)、SM(d16 ∶1/22 ∶0)、SM(d18 ∶1/20 ∶0)、TG(52 ∶1)、PC(18 ∶1/20 ∶3)、PC(20 ∶4/16 ∶0)、PC(18∶0/18 ∶1)、PC(18 ∶2/18 ∶0)、PC(22 ∶6/18 ∶0)含量高于ND组,TG(54: ∶)、TG(52 ∶4)、TG(54 ∶7)、PC(20 ∶3/0 ∶0)、PC(22 ∶6/0 ∶0)含量低于ND组;HFFD+Sch B组TG(54 ∶3)、TG(52 ∶4)、TG(54 ∶2)、TG(54 ∶6)、PC(18 ∶1/18 ∶0)、TG(52 ∶1)、TG(50 ∶2)、TG(50 ∶3)、TG(54 ∶7)、TG(54 ∶1)、TG(56 ∶5)、TG(56 ∶8)、TG(58 ∶8)、TG(50 ∶4)、TG(56 ∶4)、20 ∶4 Cholesteryl ester、PC(18 ∶2/18 ∶0)、PC(18 ∶1/16 ∶0)、PC(18 ∶0/18 ∶1)、PC(18 ∶2/16 ∶0)、PE(22 ∶6/0 ∶0)、PC(22 ∶6/18 ∶0)、PE(18 ∶2/0 ∶0)、PE(16 ∶0/0 ∶0)含量高于HFFD组,PE(18 ∶0/0 ∶0)含量低于HFFD组。
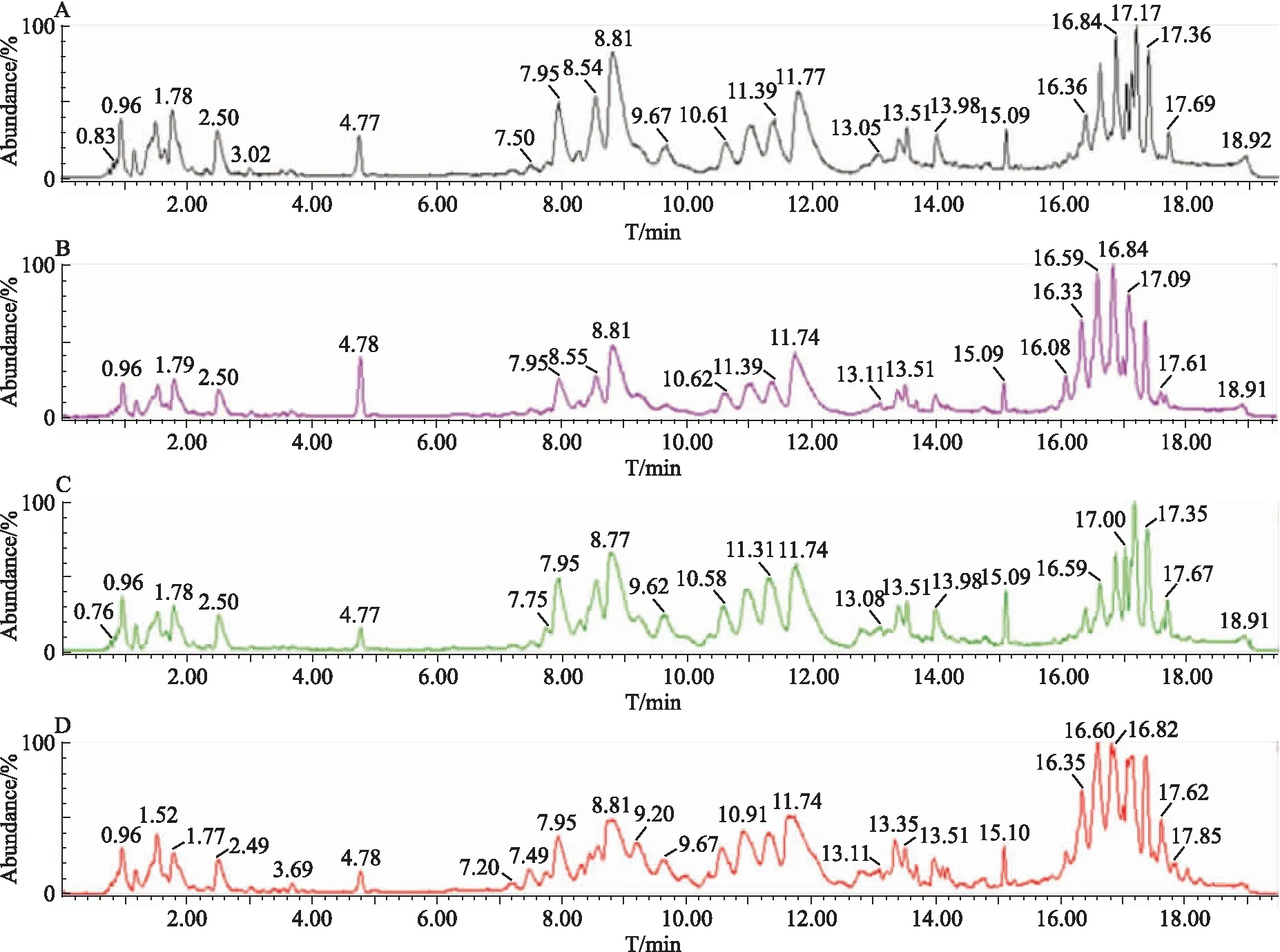
Fig 1 Chromatogram of serum samples on positive ion mode(n=8)
A: ND group; B: ND+Sch B group; C: HFFD group; D: HFFD+Sch B group.
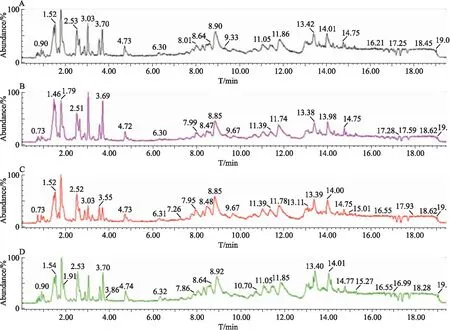
Fig 2 Chromatogram of serum samples on negative ion mode
A: ND group(n=6); B: ND+Sch B group(n=4); C: HFFD group(n=4); D: HFFD+Sch B group(n=4).
3 讨论
目前临床上将高脂血症分为高胆固醇血症、高甘油三酯血症、混合型高脂血症、低高密度脂蛋白血症。脂质作为生物体内重要的化合物,美国在“脂质代谢途径研究计划”中将其分为8类,分别为甘油脂类、鞘脂类、固醇脂类、脂肪酸类、甘油磷脂类、孕烯醇酮脂类、糖脂类、多聚乙烯类[13]。其复杂多样性决定了其很难用一种方法将所有脂类物质检测清楚。脂质代谢组学是目前新兴的代谢组学的一个分支,其主要针对机体内所有脂类物质进行系统研究,应用此方法对相关疾病的发病机制的研究更为敏感、完整和准确,并能进一步反映其内源性代谢物的量变与质变,为包括高脂血症在内的多种代谢性疾病的研究提供了重要手段,同时也成为评价高脂血症动物模型的有效方法。前期研究发现,Sch B一次大剂量给药对小鼠血清TG有明显的升高作用,并伴有肝细胞脂肪样变和肝损伤[11],具有制备高脂血症(急性单纯性高甘油三酯血症)动物模型的潜力。因此,本实验借助于脂质代谢组学技术对Sch B诱导的高脂血症进行评价,并为该模型的建立提供新的实验依据。作为对比,同时模拟人高脂高糖饮食嗜好,在正常饲料的基础上添加猪油和果糖制备高脂血症,以及在此基础上进一步观察Sch B对脂质代谢组学的影响。
UPLC-Q-TOF-MS技术因其具有高分辨力、高灵敏度、高选择性等优点,非常适合复杂生物代谢物的脂质组学的分析,是目前应用最为广泛的分析技术之一。代谢组学分析产生的数据信息含量丰富,并且是多维数据,对此数据的分析需要运用化学计量学及多元统计分析方法,对采集的原始数据进行压缩降维并归类分析。常用的分析方法主要包括主成分分析(principal component analysis,PCA)、层次聚类分析(hierarchical clustering analysis,HCA)、非线性影射(nonlinear mapping,NLM)等非监督分类方法,以及偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)、OPLS-DA、神经网络(neural network,NN)、k-最近邻法(k-nearest neighbor,KNN)、随机森林分析(random forest analysis,RF)等监督分类法。其中以PCA、PLS-DA、OPLS-DA使用最为广泛。并且OPLS-DA是在PLS-DA基础上发展而来的算法,与PLS-DA相比较而言,其将X变量中的系统变异分解为两部分,随着正交变异组分的增加,将提供更多的解释性和减少结果的误差。本实验采用监督模式的OPLS-DA分析,在明确样品分类的情况下,其分类效果比PCA更好。本研究结果证明,Sch B建立的高甘油三酯血症与高脂高糖饮食引起的高胆固醇血症,在脂代谢组学方面有明显的不同。

Fig 3 OPLS-DA score plots of serum samples
A and B represent the score plots on positive ion mode; C and D represent the score plots on negative ion mode. a: mice fed with ND; b: mice fed with ND and treated with Sch B; c: mice fed with HFFD; d: mice fed with HFFD and treated with Sch B.
通过对比高分辨的质量数和相关质谱碎片裂解信息,并结合HMDB、METLIN、LIPID MAPS等数据库,确定可能的归属和结构鉴定,筛选Sch B诱导高甘油三酯血症的差异代谢物。与生化检测结果中HFFD组小鼠血清TG水平与ND组无明显差异结果不同,脂质代谢组学显示出其代谢特征存在明显不同。进一步说明与生化试剂盒检测方法相比,脂质代谢组学能更敏感、更完整、更准确地反映其内源性脂代谢物的量变,这与文献报道一致[14]。
综上所述,该模型制备操作简便,Sch B一次灌胃在12~96 h内便可复制临床高脂血症-脂肪肝-肝损伤的发病过程。克服高脂饲料喂养造模的繁琐和模型不稳定的缺点,并能根据研究需要通过剂量的加减来控制模型的严重程度。Sch B单独给药升高血TG水平,可制备高甘油三酯血症动物模型。联合高脂高糖饮食可同时升高血TG和TC水平,制备混合型高脂血症动物模型。本文通过脂质代谢组学的研究,丰富了Sch B制备高甘油三酯血症动物模型的内涵和理论基础。
(致谢:本实验在北京中医药大学中药学院中药药理实验室和河南中医药大学第一附属医院中药药代动力学实验室开展,感谢各位老师和同学的帮助。)