青蒿琥酯抗小鼠血吸虫性肝纤维化的作用
孔庆明,戴方伟,丁豪杰,郑清四,卢领群,卓洵辉,楼 琦,楼 涤,郑 斌,丁建祖,褚晓峰,陆绍红
(1. 浙江省医学科学院寄生虫病研究所,2. 浙江省实验动物中心,浙江 杭州 310013;3. 桂林南药股份有限公司,广西 桂林 541004;4. 浙江省实验动物公共服务平台,浙江 杭州 310013)
肝纤维化是肝脏对病毒、寄生虫感染、酒精滥用、代谢性疾病等各种病因所引起的慢性损伤的一种反应,是各种慢性肝病共同的病理学基础,也是肝硬化形成的必经阶段[1]。血吸虫病是一种流行广泛、严重危害人类健康和社会经济发展的人兽共患寄生虫病。血吸虫尾蚴感染宿主后,雌性成虫所产虫卵大部分沉积于肝、肠等组织中,在与机体相互作用的过程中形成虫卵肉芽肿、组织损伤和继发性肝纤维化。肝纤维化是导致血吸虫病患者门脉高压、腹水、上消化道出血等严重并发症与死亡的最根本原因[2]。肝纤维化是一个可逆的病理过程,去除致病因素可以明显减轻肝纤维化,使肝脏功能恢复正常。如果不加以治疗,肝纤维化会转变为肝硬化[3]。对浙江嘉兴市吡喹酮救治的晚期血吸虫病患者随访发现,血吸虫病肝纤维化指标异常者仍然高达75.4%,彻底杀虫治疗并不能中止血吸虫病肝纤维化的进展[4-5]。虽然抗肝纤维化药物相关研究取得了一些进展,但是目前临床尚无理想的抗肝纤维化特效药物。
青蒿琥酯(artesunate,ART)是一种高效抗疟药,也是有效的血吸虫病预防药物。国内研究表明,ART能抑制肝星状细胞(hepatic stellate cells,HSC)增殖,具有抗四氯化碳致大鼠肝纤维化以及大鼠免疫性肝纤维化作用[6-8]。壳多糖酶在上皮细胞功能失调、免疫细胞活化、炎症反应与纤维化生成中起重要作用[9]。另外,ART可抑制p-ERK1/2的表达[10],提示ART抗肝纤维化的作用可能与抑制ERK通路有关。本研究拟以血吸虫性肝纤维化小鼠为动物模型,随机分为ART高、低剂量治疗组、模型组和正常组,以肝组织病理形态观察,结合透明质酸(hyaluronic acid, HA)、基质金属蛋白酶抑制因子1(tissue inhibitor of metalloproteinase 1,TIMP1)和Ⅲ型胶原α1(collagen type Ⅲ alpha 1,Col3α1)等分子指标,综合评估治疗前后的肝纤维化进程;通过肝组织中壳多糖酶3样蛋白1(chitinase-3-like protein 1,CHI3L1)、转化生长因子β1(transforming growth factor β1,TGF-β1)、细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)等的表达调控,探讨ART通过CHI3L1/ERK通路,改善血吸虫性肝纤维化的机制。
1 材料与方法
1.1 实验动物6周龄ICR清洁级♀小鼠,购自浙江省医学科学院实验动物中心。生产许可证号:SCXK(浙)2014-0001,使用许可证号:SYXK(浙)2014-0008。日本血吸虫感染钉螺,购自江苏省血吸虫病防治研究所。
1.2 药物、试剂与仪器青蒿琥酯粉剂(批号:170204),由桂林南药股份有限公司惠赠;吡喹酮(批号:170306),上海新华联制药有限公司生产,使用0.04 mol·L-1的羧甲基纤维素钠配制成混悬液备用。HE染色试剂盒(批号:G1120)、Masson染色试剂盒(批号:G1345),购自上海索莱宝生物科技有限公司;PCR引物,由上海生工生物工程公司合成;TGF-β1抗体(Abcam公司,货号ab92486);抗ERK(货号4695)、p-ERK抗体(货号4370),均购自CST公司;CHI3L1抗体(上海生工,货号D120410);β-actin抗体(Servicebio,货号GB12001)。ADVIO 2400全自动血清生化分析仪(拜耳中国有限公司);CFX96TM荧光定量PCR仪(伯乐生命医学产品上海有限公司)。
1.3 肝纤维化小鼠模型的建立与实验分组小鼠经腹部剃毛贴片感染日本血吸虫尾蚴,建立动物模型,每只感染(20±2)条尾蚴。24只清洁级小鼠随机分为4组,包括正常组、模型组、ART高、低剂量治疗组(50、25 mg·kg-1·d-1)。各组在感染血吸虫尾蚴7周后,进行连续3 d的吡喹酮灌胃杀虫,剂量为180 mg·kg-1·d-1。根据《日本血吸虫病肝纤维化诊断与疗效评估方案》说明,抗纤维化药物治疗在感染后16周开始,每天灌胃给药,连续8周,停药后4周处死小鼠,取肝脏备用。
1.4 血清肝纤维化指标检测采用全自动血清生化分析仪检测血清HA、Ⅳ型胶原(collagen type Ⅳ,CIV)和血清层黏连蛋白(laminin,LN)。
1.5 肝脏组织病理学观察肝组织经福尔马林溶液固定,石蜡包埋,常规组织切片,进行HE染色和Masson染色观察。根据《日本血吸虫病肝纤维化诊断与疗效评估方案》的规定,结合《肝纤维化诊断及疗效评估共识》,对肝脏的炎症与纤维化程度进行半定量计分。
1.6 肝纤维化与CHI3L1/ERK通路相关基因的qPCR与Western blot检测无菌刀片于干冰上,将组织样品切割成约3 mm×3 mm×3 mm大小,置于装有1 mL TRIzol裂解液的1.5 mL EP管中。将超细匀浆机工作头浸入TRIzol裂解液中5~10 s灭活RNA酶后,组织研磨。参照TRIzol试剂盒步骤抽提RNA,逆转录试剂盒逆转录成cDNA。采用SYBR Green实时荧光定量PCR两步法检测小鼠肝组织内纤维化与ERK信号通路相关基因:平滑肌肌动蛋白α2(alpha-actin-2,ACTA2)、结缔组织生长因子(connective tissue growth factor,CTGF)、TGF-β1、CHI3L1、Col3α1、TIMP-1、ERK1/2(MAPK1、MAPK3)的mRNA表达水平,以GAPDH为内参基因,2-ΔΔCt相对定量法处理数据。引物序列见Tab 1。

Tab 1 Primers for qPCR
取各组肝组织提取总蛋白,Bradford法测定蛋白含量。总蛋白变性5 min后进行Western blot实验。TGF-β1、ERK、p-ERK、CHI3L1抗体(1 ∶1 000)4 ℃孵育过夜,TBST洗膜后加入辣根过氧化物酶(HRP)标记的二抗(1 ∶3 000),以β-actin为内参。
2 结果
2.1 ART对小鼠血清肝纤维化指标的影响Tab 2结果显示,与正常组比较,模型组小鼠血清HA水平明显升高(P<0.01),含量大于1 mg·L-1。与模型组(HA以1 mg·L-1计算)比较,ART组小鼠血清HA水平呈降低趋势,高剂量组小鼠血清HA水平明显降低(P<0.01)。与模型组比较,各组小鼠血清CIV和LN水平无明显变化。
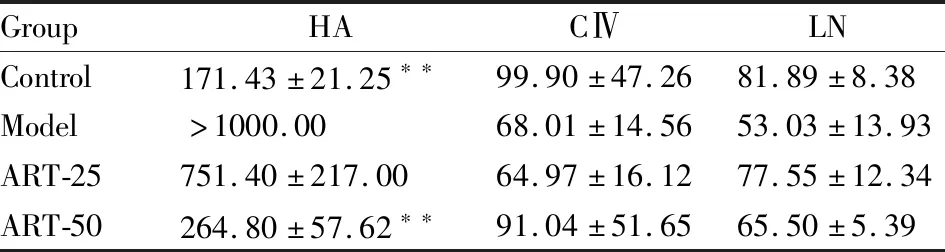
GroupHACⅣLNControl171.43±21.25∗∗99.90±47.2681.89±8.38Model>1000.0068.01±14.5653.03±13.93ART-25751.40±217.0064.97±16.1277.55±12.34ART-50264.80±57.62∗∗91.04±51.6565.50±5.39
**P<0.01vsmodel
2.2 肝、脾形态与肝组织病理学指标分析正常组小鼠的肝脾颜色、体积、质地正常。模型组小鼠肝脾脏器颜色深紫,质地粗糙,脾脏体积明显增大。ART组小鼠肝脾形态有所改善(Fig 1A),尤其高剂量给药组。Tab 3结果显示,正常组小鼠脾质量指数与模型组比较明显减小,差异具有显著性(P<0.01)。ART高剂量组小鼠的脾脏质量指数与模型组比较明显减小,差异具有显著性(P<0.01)。
Fig 1B的HE染色结果显示,与正常组比较,模型组小鼠肝组织正常结构被破坏,肝细胞索排列紊乱,可见界板及中央静脉周围肝细胞坏死及较多炎症细胞浸润;汇管区结缔组织不同程度增生扩大,向小叶内延伸,将肝小叶分隔成大小不等的肝细胞团。ART组的病理损害均减轻。Fig 1C的Masson染色显示,与正常组比较,模型组小鼠肝组织胶原增生明显,并与邻近汇管区及肝静脉相连,纤维间隔较厚。ART组汇管区及小叶内、小叶间胶原纤维间隔减少、变细。各组小鼠肝纤维化、炎症分期见Tab 3,ART高剂量组肝纤维化评分较正常组下降超过2分,说明ART治疗血吸虫性小鼠肝纤维化有效。
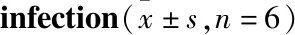
Tab 3 Effects of artesunate against liver fibrosis
**P<0.01vsmodel
2.3 ART对血吸虫性肝纤维化小鼠肝组织CHI3L1/ERK信号通路的影响qPCR检测结果显示(Fig 2A):与正常组比较,模型组小鼠肝纤维化评估指标TIMP-1、Col3α1 mRNA表达明显增加(P<0.01),ERK通路相关分子ACTA2、CTGF、TGF-β1、ERK1/2(MAPK1、MAPK3)的mRNA表达量也升高,其中,CHI3L1和ERK1/2基因的表达量升高差异具有显著性(P<0.01)。Western blot结果也显示(Fig 2B),与正常组比较,模型组中CHI3L1、TGF-β1蛋白的表达以及ERK1/2蛋白的磷酸化水平明显升高,血吸虫肝纤维化发生过程中,ERK通路被激活。给予ART干预后,与模型组相比,ART组小鼠肝脏TIMP1、Col3α1 mRNA表达水平明显降低(P<0.01),
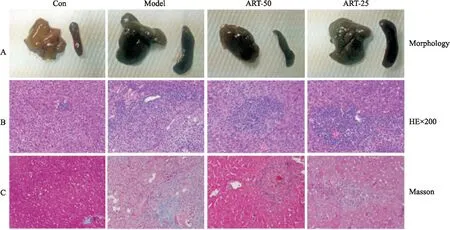
Fig 1 Hepatic pathology changes of artesunate against liver fibrosis in Schistosoma japonicum infection
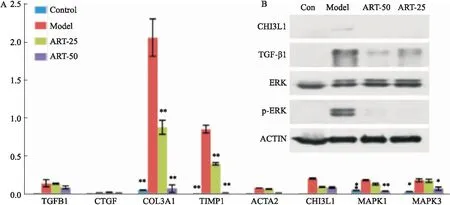
Fig 2 Effects of artesunate on expression of CHI3L1/ERK pathway in liver fibrosis induced by Schistosoma japonicum
A: Real-time PCR; B: Western blot.*P<0.05,**P<0.01vsmodel group.
ART高剂量组小鼠肝脏ERK通路相关分子ACTA2、CTGF、TGF-β1、CHI3L1和ERK1/2表达量降低,其中CHI3L1和ERK1/2基因的表达量的降低具有统计学意义(P<0.01)。与模型组比较,ART组中CHI3L1、TGF-β1蛋白的表达水平以及ERK1/2蛋白的磷酸化水平明显降低,说明ERK信号通路被抑制,ART能够通过CHI3L1/ERK信号通路介导抗血吸虫性肝纤维化。
3 讨论
理想的动物模型在肝纤维化病理和药效评价等方面具有重要的意义。病毒、酒精、饮食和血吸虫是导致人类肝纤维化的主要病因,前几种病因至今尚无理想的动物模型,尤其无法复制与临床情况相似的肝纤维化动物模型。大鼠是日本血吸虫的半适宜宿主,大鼠体内的虫体不能或较难发育为成虫,所以在肝脏较难观察到虫卵引起的病变[11]。兔子是日本血吸虫的适宜性宿主,但是日本血吸虫感染兔的晚期肝纤维化缓慢可逆[12]。小鼠感染血吸虫后,其肝脏在虫卵肉芽肿机械性、炎性因子和细胞因子等综合因素作用下,能够形成与血吸虫病患者肝纤维化相似的发病进程,是目前研究日本血吸虫病肝纤维化发病机制及药物防治较为理想的实验动物模型[13]。本研究以日本血吸虫感染方式构建了小鼠肝纤维化模型,该模型具有一次处理即可成模、纤维化病变与临床相似、模型可标准化、经济等特点,适用于肝纤维化发生机制的研究。研究中,模型组血清肝纤维化指标HA和脾脏质量指数较正常组变化差异有显著性,肝组织HE和Masson染色病理分析证实肝纤维化已形成。
抑制HSC的活化与增殖是预防和治疗肝纤维化的主要策略之一。ART是青蒿素的衍生物,体外实验表明,ART能够使活化的HSC发生凋亡[14],促凋亡机制是通过抑制细胞外基质的产生及激活或抑制一些信号通路,从而发生一定的级联效应。目前,ART可作用于HSC中TGF-β1/Smad、NF-κB、Wnt/β-catenin及TNF-α等介导的信号通路[14]。研究显示,多细胞寄生虫或含有壳多糖的病原体刺激上皮细胞分泌的壳多糖酶样蛋白CHI3L1在炎症与组织重塑中起着极其重要的作用,是巨噬细胞分化成熟的标志[15],被激活的巨噬细胞进一步活化HSC,并使之出现肌成纤维细胞样表型转化,激活后的HSC可自分泌TGF-β1等细胞因子使活化得以持续,最终导致纤维化。本研究以血吸虫性肝纤维化小鼠为动物模型,探究了ART体内抗肝纤维化的作用。模型组肝脏中维持细胞外基质合成与降解动态平衡的关键因子TIMP-1和Col3α1表达明显增加,ART处理后两因子表达量明显降低。与模型组比较,ART处理后小鼠肝脏CHI3L1和ERK1/2蛋白的磷酸化水平明显降低,说明ART可能通过抑制CHI3L1/ERK信号通路介导抗血吸虫性肝纤维化。
综上所述,ART在体内对血吸虫性肝纤维化具有保护作用,其机制可能与胶原蛋白合成抑制以及CHI3L1/ERK信号通路的传导抑制有关。本研究为ART抗肝纤维化的药物研究提供了新的理论基础。
(致谢:感谢中国疾病预防控制中心寄生虫病预防控制所惠赠吡喹酮。感谢浙江省实验动物与安全性研究重点实验室和浙江省医学生物工程疫苗重点实验室的老师、同学对本研究的支持与协助。)