A型流感病毒对肺巨噬细胞自噬的影响及麻杏石甘汤含药血清的干预作用
李 玲,张 波,卢芳国,蔡 亮,高 强,胡 珏,何谷良,吴 涛
(湖南中医药大学1. 中医学院、2. 医学院,湖南 长沙 410208;3. 湖南省疾病预防控制中心微生物检验科,湖南 长沙 410000;4. 湖南中医药大学研究生学院,湖南 长沙 410208)
流感性感冒(简称流感)是目前尚未得到有效控制的全球性急性呼吸道传染病,而A型流感病毒是人和动物流感的主要病原体[1-2]。近年研究发现,当流感病毒入侵时会诱导宿主细胞产生自噬,进而加剧流感病毒的致病作用,因此,具有调节细胞自噬功能的药物可能是流感治疗的有效靶点[3-4]。中医药防治流感历史悠久,优势明显。源自东汉医圣张仲景《伤寒论》的麻杏石甘汤是治疗外感发热肺热证的常用方,更是近年广泛用于治疗证属热毒袭肺证和热毒壅肺证流感的基本方[5]。
本课题组前期研究结果表明,麻杏石甘汤(Maxing Shigan decoction,MXSGD)能通过调节细胞因子的分泌等方式,发挥抗流感病毒作用,是较为理想的研究对象[6-8]。本研究将结合前沿的基础研究成果和已开展的前期研究工作,从形态-功能-分子三方面,探讨麻杏石甘汤是否通过调控流感病毒诱导的肺巨噬细胞自噬,最终实现干预流感病毒的致病作用及其效应机制,部分揭示麻杏石甘汤抗流感病毒的新作用靶点,丰富中医药防治流感病毒感染的科学内涵。
1 材料
1.1 药物与试剂麻杏石甘汤(麻黄9 g、杏仁9 g、石膏18 g、炙甘草6 g)购自湖南中医药大学附属第一医院门诊药房;磷酸奥司他韦胶囊(瑞士罗氏,批号B3017,每粒75 mg);胎牛血清(Gibco);自噬抑制剂3-MA(Selleck,S2767);雷帕霉素(rapamycin,RAPA)(Sigma,553210);麻黄碱对照品(批号:C15894)、伪麻黄碱对照品(批号:JA187615)、苦杏仁苷对照品(批号:B20687)、甘草酸铵盐对照品(批号:B20418),均购自上海源叶生物;甲醇、乙腈(色谱纯,美国TEDIA); LC3抗体(CST,4108);β-actin抗体(Abcam,ab8227);FTIC标记的羊抗兔二抗(Proteintech,SA00003-2);RIPA蛋白裂解液(CWBIO,CW2334S);ECL发光检测试剂盒(Thermo Fisher,35055)。
1.2 仪器3111 CO2细胞培养箱、1300生物安全柜(美国Thermo Scientific);AE31倒置显微镜(厦门Motic);CytExpert流式细胞仪(美国Beckman Coulter);Tecnai G2 spirit透射电子显微镜(美国FEI);A1R+激光共聚焦显微镜(日本Nikon);1525高效液相色谱仪(美国Waters);Synergy2多功能酶标仪(美国Bio-Tek)。
1.3 细胞株小鼠单核巨噬细胞白血病细胞RAW264.7,购于中国科学院细胞库,由本室传代培养后使用。
1.4 流感病毒株A型流感病毒(influenza A virus,IAV),A/PR/8/34株,由湖南师范大学病毒研究室惠赠。经10日龄鸡胚尿囊腔接种培养传代,血凝效价实验测定效价在1 ∶640以上者供实验用(本实验感染复数,MOI=0.1)。置于冰袋中备用。
1.5 实验动物成年健康新西兰大白兔12只,♂,体质量(1.8±0.2)kg,由湖南中医药大学动物实验中心提供,动物许可证号:SCXK(湘)2015-0004。适应性饲养1周。
2 方法
2.1 制备含药血清按动物体表面积剂量换算法,根据《方剂学》和《中药药理学》煎煮制备4倍临床等效剂量的麻杏石甘汤水煎液[9]。同时用双蒸馏水配制4倍临床等效剂量的阳性药物奥司他韦水溶液。分别灌胃新西兰大白兔各6只,1次/日,连续7 d,末次给药2 h后,兔心脏采血,3 000 r·min-1离心10 min,分离血清,得到空白血清、麻杏石甘汤含药血清和奥司他韦含药血清,同组兔血清混合并56 ℃ 灭活,过滤除菌,-20 ℃保存备用。用HPLC检测麻杏石甘汤和奥司他韦含药血清主要成分含量稳定,可用于后续实验。
2.2 激光共聚焦显微镜检测各组细胞的自噬情况常规培养RAW264.7细胞,以3×103个/孔接种于12孔培养板,培养16 h,待细胞贴壁后,弃原培养液,加入无血清培养基培养24 h,使细胞同步化到G0期后备用。实验分组方式见Tab 1。加入上述相应的干预因素,干预12 h后,处理细胞。进行如下操作:4%多聚甲醛固定30 min,冷0.01 mol·L-1PBS洗5 min×2次,5% BSA封闭30 min后,每孔加入一抗兔源LC3Ⅱ(1 ∶200)50 μL,4 ℃孵育过夜;室温孵育1 h,弃液,洗5 min×3次;加入FITC标记抗兔IgG(1 ∶200),37 ℃避光孵育30 min,弃液,洗5 min×5次;抗荧光淬灭剂的封片剂封片。共聚焦显微镜下检测。
2.3 透射电镜技术检测各组细胞的自噬情况和病毒颗粒分布情况常规培养RAW264.7细胞,以5×103个/孔接种于6孔板,实验分组方式同前。加入上述相应的干预因素,干预12 h后弃液,洗2次。消化重悬细胞并收集于EP管中。进行如下操作:1 000 r·min-1离心5 min,去上清,可见细胞沉淀,再慢慢滴入0.25%戊二醛,室温放置1 h后,4 ℃保存;1%锇酸后固定2 h,依次以50%、70%、90%、100%的丙酮脱水,包埋、染色;透射电子显微镜观察单位面积细胞内自噬体数目和形态。
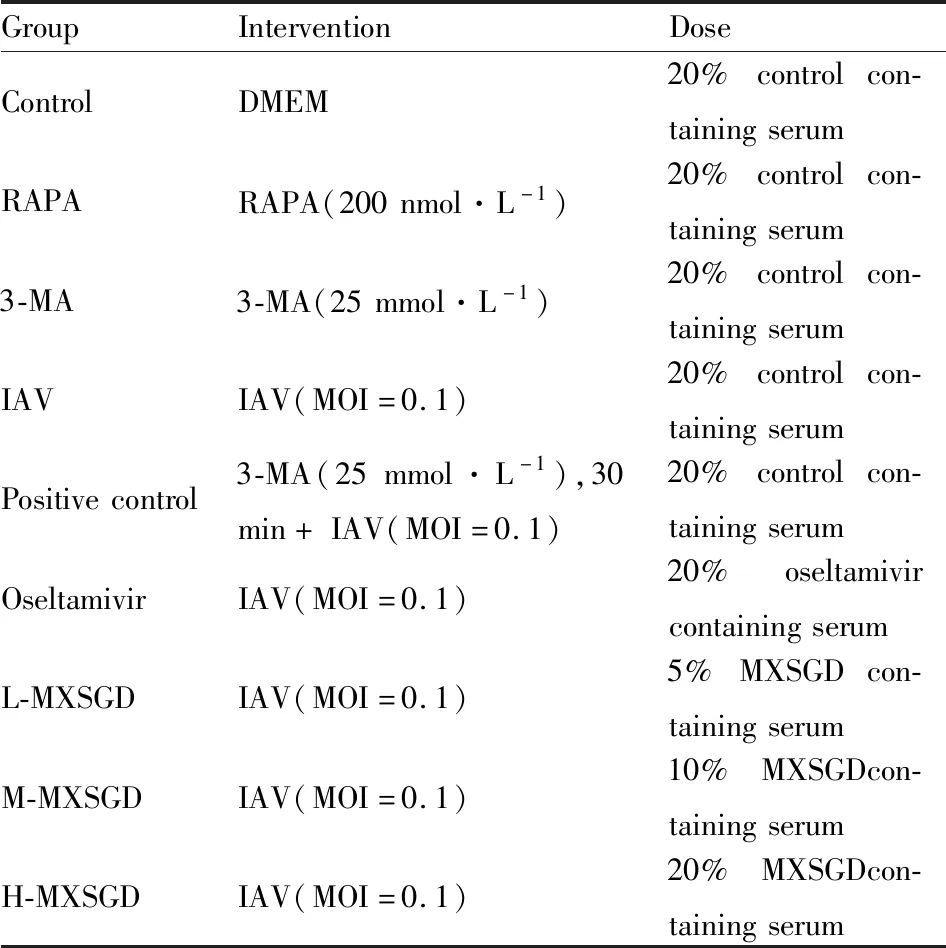
Tab 1 Grouping and intervention
2.4 Western blot法检测各组细胞自噬标志蛋白LC3-Ⅰ、LC3-Ⅱ表达细胞培养及干预方式同前,进行如下操作:吸去上清,PBS洗涤,刮下细胞,1 000 r·min-1离心5 min后,弃上清,加入100 μL RIPA裂解液(含1 mmol·L-1PMSF),冰上充分混匀后静置20 min,12 000 r·min-1离心10 min,取上清测定总蛋白浓度。取50 μg总蛋白上样, SDS-PAGE电泳,湿法转膜后封闭1 h,加入LC3和β-actin抗体(1 ∶1 000),孵育过夜,二抗(1 ∶3 000)室温孵育1 h,暗室加ECL化学发光剂,于化学发光仪成像,用图像分析软件Image Lab5.0对图像进行信号分析,并计算靶蛋白/内参蛋白的比值。
3 结果
3.1 麻杏石甘汤含药血清对流感病毒诱导的细胞自噬的影响如Fig 1所示,激光共聚焦显微镜下可见细胞内有绿色荧光(LC3)分布,用IPP6.0软件对细胞内绿色荧光聚集体的数量和强度进行IOD分析,结果显示流感病毒能有效诱导巨噬细胞的自噬,与已被证明可以诱导自噬的阳性药物RAPA组接近,与空白组和自噬抑制剂3-MA组比较,差异有显著性(P<0.01),且3-MA能有效抑制流感病毒诱导的细胞自噬。而各含药血清亦能不同程度抑制流感病毒诱导的细胞自噬,其中麻杏石甘汤含药血清浓度与LC3表达量(IOD值)呈负相关,相关系数r=-0.784,P=0.012。
3.2 麻杏石甘汤含药血清对流感病毒诱导的细胞自噬和病毒颗粒分布的影响如Fig 2所示,透射电镜下可观察自噬体的形成:吞噬泡(phagophore)-自噬小体(autophagosome)-自噬溶酶体(autolysosome)。结果显示,流感病毒能有效诱导巨噬细胞的自噬,不同阶段的自噬体明显增多,与已被证明可以诱导自噬的阳性药物RAPA组接近,与空白组和自噬抑制剂3-MA组比较,差异有显著性(P<0.01),且3-MA能有效抑制流感病毒诱导的细胞自噬。而各含药血清亦能不同程度抑制流感病毒诱导的细胞自噬,其中麻杏石甘汤含药血清浓度与自噬泡数量呈负相关,相关系数r=-0.884,P=0.002。
3.3 麻杏石甘汤含药血清对流感病毒诱导的细胞自噬标志蛋白LC3-Ⅰ、LC3-Ⅱ表达的影响如Fig 3所示,流感病毒能有效诱导巨噬细胞的自噬,自噬标志蛋白LC3Ⅱ含量明显升高,且LC3Ⅱ/LC3Ⅰ比值增加,与RAPA组接近,与空白组和自噬抑制剂3-MA组比较,差异有显著性,且3-MA能有效抑制流感病毒诱导的细胞自噬。而各含药血清亦能不同程度抑制流感病毒诱导的细胞自噬标志蛋白LC3Ⅱ、LC3Ⅱ/LC3Ⅰ比值增加,其中麻杏石甘汤含药血清浓度与LC3表达量(相对蛋白表达量)呈负相关,相关系数r=-0.962,P=0.000。
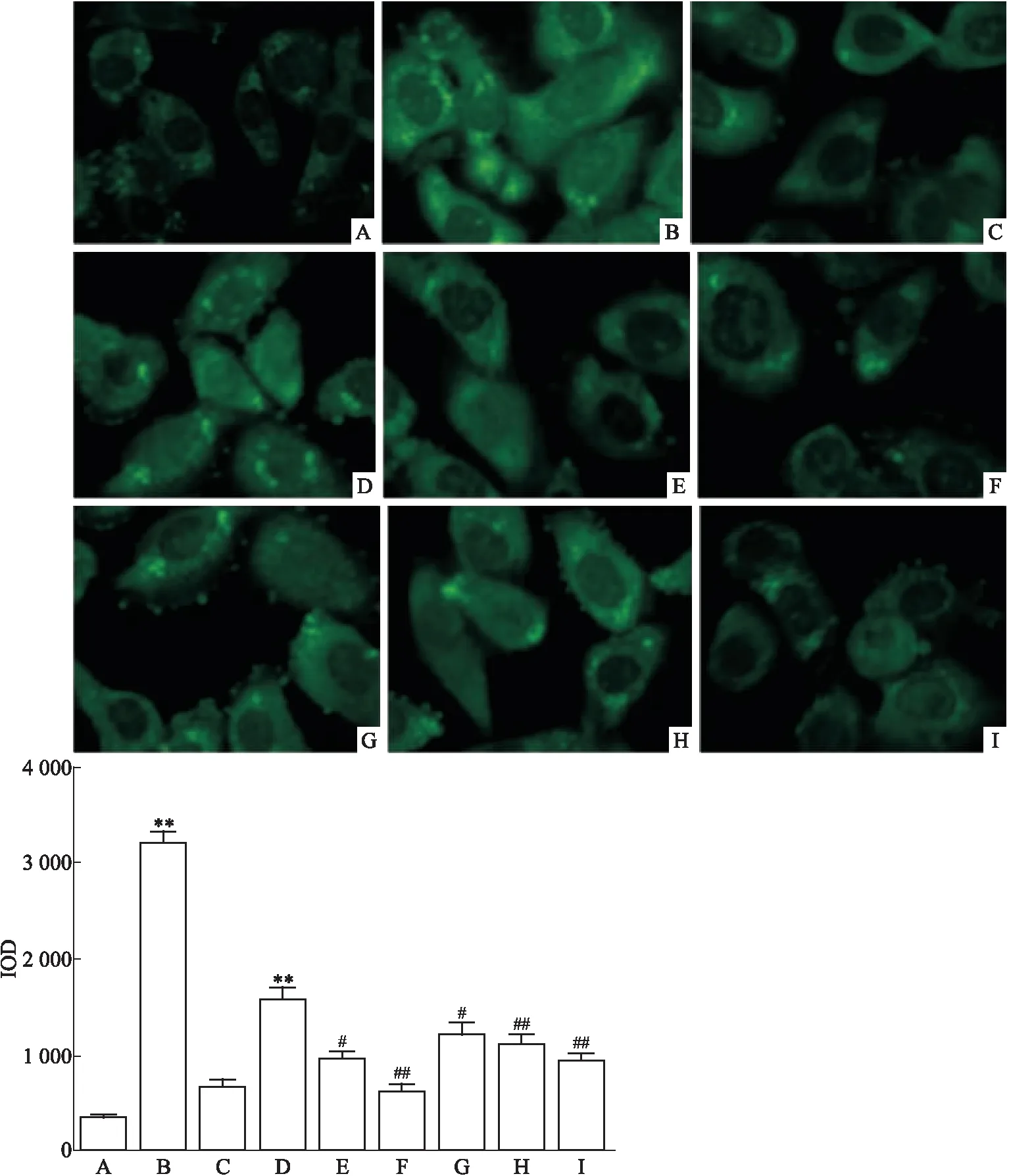
Fig1LC3expressionincellsofeachgroup(× 600) A:Control; B: RAPA; C: 3-MA; D: IAV; E: Positive control; F: Oseltamivir; G: L-MXSGD; H: M-MXSGD; I: H-MXSGD.**P<0.01vscontrol;#P<0.05,##P<0.01vsIAV.
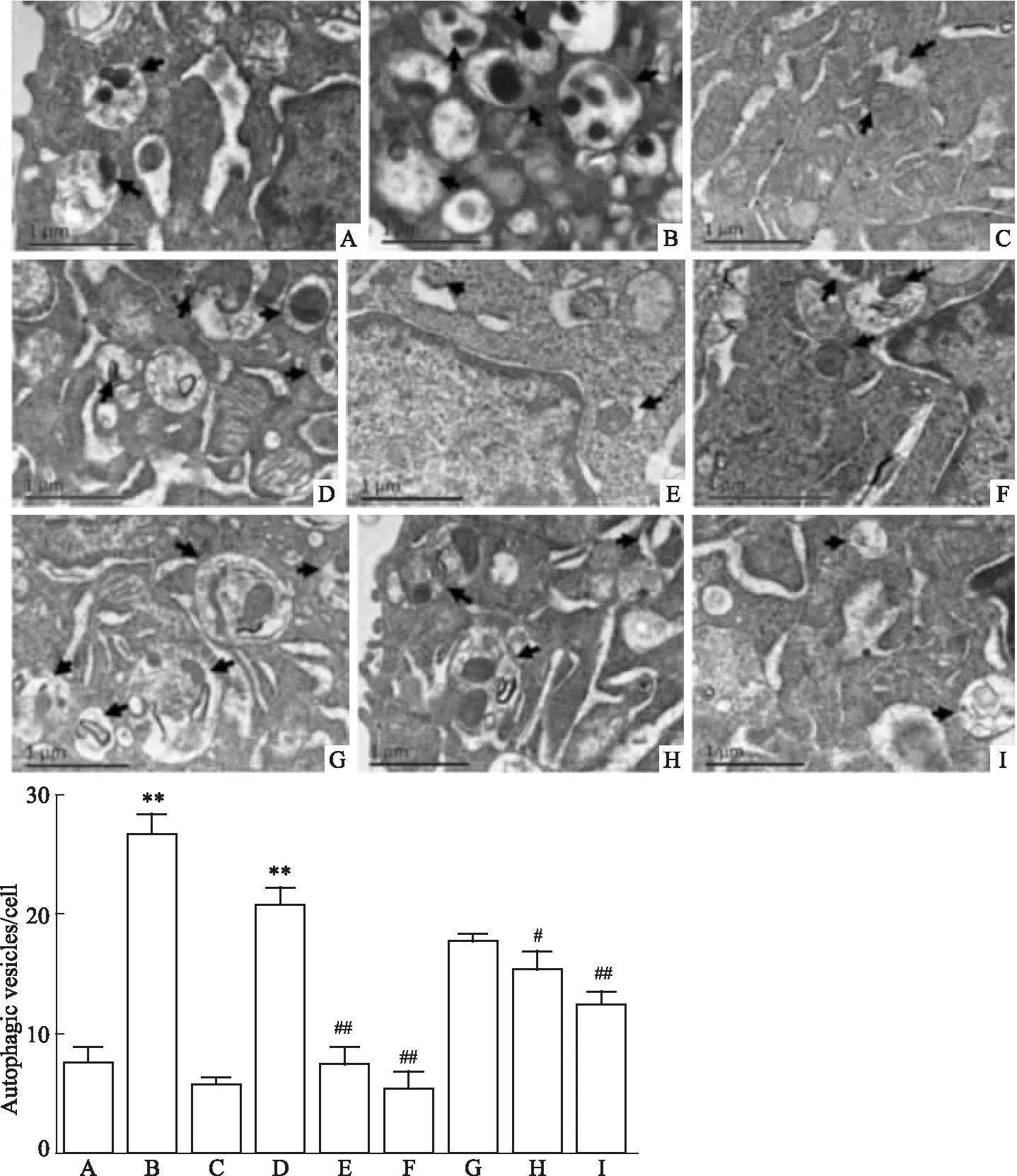
Fig2Ultrastructuralobservationofcellsineachgroup(×2 000)
A: Control; B: RAPA; C: 3-MA; D: IAV; E: Positive control; F: Oseltamivir; G: L-MXSGD; H: M-MXSGD; I: H-MXSGD.
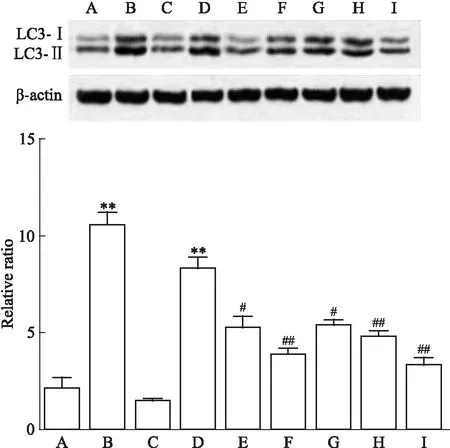
Fig 3 Protein expression of LC3-Ⅰ and LC3Ⅱ
A: Control; B: RAPA; C: 3-MA; D: IAV; E: Positive control; F: Oseltamivir; G: L-MXSGD; H: M-MXSGD; I: H-MXSGD.**P<0.01vscontrol;#P<0.05,##P<0.01vsIAV.
4 讨论
自噬是潜在的流感病毒与宿主之间相互作用的一个重要机制,因此,近些年研究者开始关注流感病毒感染和自噬机制之间的复杂关系。越来越多的证据表明,流感病毒可以引起自噬,是流感病毒的复制的一个必要过程[10-14]。因此,细胞自噬在流感病毒感染诱导炎症损伤中的作用机制是研究药物防治流感病毒感染引起炎症反应的重要靶点之一。
麻杏石甘汤方中君药辛温宣肺之麻黄与辛甘大寒清肺热之生石膏,两药合用相反相成,相制为用;臣药苦降利肺气之杏仁味,助君药清肺热定平喘;佐药炙甘草益气和中,调和诸药。四药合用,共成辛凉疏表,清肺平喘之功效。同时,在中医理论指导下,根据其配伍原则,该方前期研究显示,其能通过多途径、多靶点防治流感病毒感染引起的肺部炎症[6-8]。
本研究结果显示,不同浓度的麻杏石甘汤含药血清能有效抑制流感病毒诱导的细胞自噬,表现在下调LC3Ⅱ的表达,纠正LC3-Ⅱ/LC3-Ⅰ的平衡,减少自噬体的形成,且呈现一定的量效关系。为本课题组研究麻杏石甘汤防治流感病毒感染,找到了新的作用靶点,随着现代医学研究技术的发展和研究的不断深入,本课题组的后续研究将以此为基础进行进一步的机制探讨,以期找到麻杏石甘汤抑制流感病毒诱导的细胞自噬的作用机制,以及关键的效应物质。
综上所述,麻杏石甘汤可能通过抑制流感病毒诱导的细胞自噬,最终调控流感病毒的致病作用,但其进一步的作用机制还需深入研究。