乙二醛酶1在疾病中表达调控的研究进展
李 虹,李赫健,樊 奔,张文生,3
(北京师范大学地理科学学部1. 中药资源保护与利用北京市重点实验室、2. 天然药物教育部工程研究中心,北京 100875;3. 三七资源保护与利用技术国家地方联合工程研究中心,云南 昆明 650000)
甲基乙二醛(methylglyoxal,MG)是一种活性羰基化合物,主要通过糖酵解过程中磷酸二羟丙酮(dihydroxyactone phosphat,DHAP)和甘油醛-3-磷酸(glyceraldehyde-3-phosphate,G3P)的中间体,经非酶催化过程而产生的有毒副产物。MG能够与DNA的眯基残基端发生反应,对其进行修饰,从而使DNA双链断裂、形成DNA-蛋白质交联物等,抑制DNA及RNA的合成,与蛋白质形成交联,造成细胞凋亡和炎症等细胞毒性和组织损伤[1-2]。1913年,Neuberg[3]发现乙二醛酶系催化MG转化为无毒的D-乳酸。Racker[4]于1951年揭示了乙二醛酶系统主要由乙二醛酶1(glyoxalsse 1,Glo 1)和乙二醛酶2(glyoxalsse 2,Glo 2)两个连续的催化步骤,其中Glo 1是该系统中的限速酶。之后,针对Glo 1的基因表达调控机制及在相关疾病中表达变化越来越引起人们的关注。本文总结近年Glo 1在不同疾病中分子调控机制的有关文献,以期为深入研究Glo 1在疾病中的作用提供参考。
1 Glo 1基因的分子结构和遗传特征
人类Glo 1基因位于6号染色体上,介于着丝粒和人类白细胞抗原DR(human leukocyte antigen DR,HLA-DR)之间,全长27 252 bp,包含6个外显子和5个内含子,转录后产生2 071 bp的mRNA,编码184个氨基酸。人类Glo 1是由1个双等位基因所编码的两个结构相似的亚基GLO 1-A和GLO 1-E组成的二聚体,两个亚基的主要区别在于第111位氨基酸——GLO 1-A为丙氨酸,而GLO 1-E为谷氨酸。Glo 1等位基因是以一种简单的共显性方式遗传的,在所有组织中都有典型的表型表达。Glo 1主要包含3种等位基因酶:GLO 1-1、GLO 1-2和GLO 2-2。所有的等位基因酶相对分子质量均为46 ku(凝胶过滤)或42 ku(序列),等电点(pI)为4.8~5.1,但它们每一种具有独特的电荷密度和分子形状[5]。通过氨基酸序列比对,发现不同物种间Glo 1具有较高的同源性,这说明Glo 1基因在进化上具有高度的保守性(Tab 1)。
2 在疾病中Glo 1拷贝数变异(copy number variation,CNV)
CNV也称为拷贝数多态性,是个体之间基因组序列上>50 bp片段的插入、缺失、重复和复杂多位点的变异[6]。2004年,Redon等[7]对来自欧洲、非洲或亚洲的270名受试者进行检测,发现Glo 1基因具有122 kb的CNV,其中具有Glo 1 CNV的人数占总人数的2%。随后发现其他灵长类动物中也存在Glo 1 CNV。小鼠Glo 1 CNV在近交系小鼠中发现,是一段长达475 kb串联重复序列。Glo 1在人类和小鼠基因组中存在功能性CNV的位点,使Glo 1表达增加2-4倍。
2.1 在癌症中Glo 1 CNV近期研究表明,人肿瘤细胞系和原发性肿瘤中发现了Glo 1 CNV,Glo 1拷贝数增加是癌症中Glo1表达增加的主要原因之一。对520种人类肿瘤调查发现,大约有8%的肿瘤中Glo 1基因拷贝数增加,其中最高的是乳腺癌(19%)、小细胞肺癌(16%)和非小细胞肺癌(11%)(Tab 2)[8]。有研究发现,Glo 1的表达增加与癌症化学疗法中的多重耐药性(multi-drug resistance,MDR)相关,推测Glo 1基因拷贝数增加可能发生在肿瘤发展的早期阶段,并且导致Glo 1蛋白表达和活性增加,MG含量减少。在临床中,在低流行率(6%)的临床肝癌中发现Glo 1拷贝数增加,在更高的肝癌患病率(48%)中发现Glo 1表达增加,而具有Glo 1拷贝数增加的所有肝癌患者均高表达Glo 1[6]。

Tab 1 Comparison of amino acid homology of Glo 1 between species
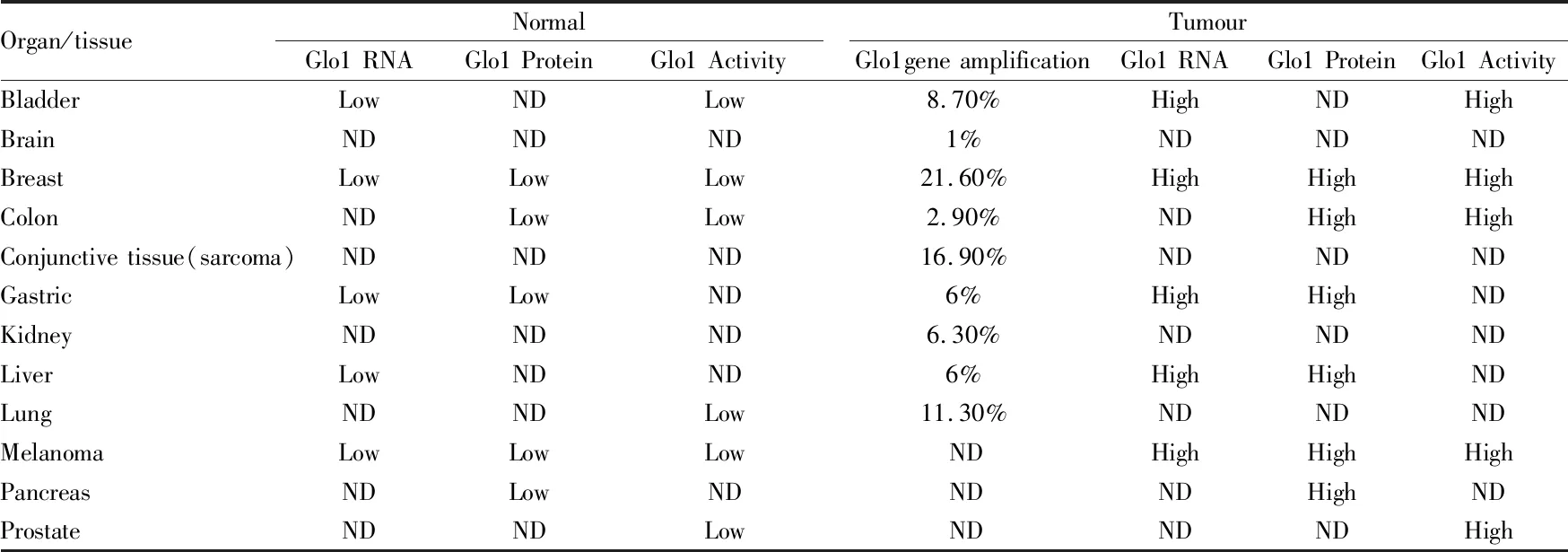
Tab 2 Glo 1 expression in human cancer and normal tissues
ND represents no change.
2.2 在焦虑症中Glo 1 CNVWilliams等[9]发现了实验室小鼠品系中的Glo 1 CNV,并与小鼠焦虑样行为相关。Cahan等[10]利用转基因小鼠进一步探索了Glo1 CNV与焦虑表型的关联,在Glo1过表达2、4和5倍的模型中,过表达4倍和5倍的小鼠表现出焦虑表型。此外,Glo1 拷贝数增加的BAC Tg小鼠较正常小鼠易出现焦虑样行为,原因或许与MG过度减少有关。MG是一种内源性γ-氨基丁酸(γ-aminobutyric acid,GABA)受体激动剂,激活突触GABAA受体,调节阶段抑制信号。Glo1拷贝数增加导致Glo1表达和活性增加,清除MG,从而减少GABAA受体的激动,导致焦虑症[11]。
3 在疾病中Glo 1单核苷酸多态性(single nucleotide polymorphism,SNP)
SNP是指在基因组水平上,一种常见的单个核苷酸的突变所引起的多态性变化,主要有单个碱基的转换或颠换,也可由碱基的插入或缺失造成,Glo 1基因存在多达70个SNP[12]。近年来,针对Glo 1 SNP与各种疾病(如神经系统疾病、癌症、糖尿病等)的关系越来越受到关注。
3.1 在神经系统疾病中Glo 1 SNPBarua等[13]采用蛋白质组学发现,Glo 1 rs2736654位点SNP与自闭症密切相关。AA基因型自闭症患者类淋巴母细胞中的Glo1活性比CC基因型细胞中Glo1活性明显降低。进一步研究发现,该位点C突变为A,导致Ala突变为Glu,从而改变了Glo 1基因结构与功能,致使Glo 1酶活性降低。Arai等[14]利用精神分裂症患者和正常人外周血提取DNA,对Glo 1基因进行重测序,发现2个杂合子框移突变,其中一个框移突变是位于第1个外显子97核苷酸插入1个腺嘌呤碱基,这一插入突变改变了酶的一级结构;另一个框移突变是位于第4个外显子365核苷酸删除了1个胞嘧啶碱基,改变了蛋白质的一级结构。这些框移突变使Glo 1酶表达和酶活性下降了40%~50%。此外,rsl781735和rsl049346也与精神分裂症易感性相关,连锁不平衡分析中发现这两个位点位于Glo 1启动子区域,并且是完全连锁。rsl781735和rsl049346突变致使Glo 1启动子活性下降,进而使Glo 1 mRNA以及Glo 1酶表达和活性降低[15]。
3.2 在癌症中Glo 1 SNP在113名乳腺癌患者和58名健康者中,Germanová等[16]研究发现,rs2736654位点多态性与乳腺癌的发生、发展具有明显的相关性。C等位基因增加乳腺癌发生发展的风险,C等位基因频率和CC基因型频率在乳腺癌患者中较高,在乳腺癌晚期阶段的频率也明显升高。CC型基因型携带者Glo 1表达量和酶活性升高。进一步研究发现,与雌激素阳性乳腺癌比较,C等位基因在雌激素阴性乳腺癌的频率更高,以及在雌激素受体阴性的患者中CC基因型频率更高,Glo 1表达量和酶活性明显更高。
3.3 在糖尿病中Glo 1 SNPGroener等[17]选取209名1型糖尿病患者和524名2型糖尿病患者,针对Glo 1 rs2736654位点进行基因分型,发现在1型糖尿病中,AA基因型频率的患病率明显较高,但基因型与糖尿病性视网膜病、肾病或神经病变均未发现相关性。相比之下,CC基因型在2型糖尿病患者中基因型频率较高,并且与糖尿病神经病变的患病率明显相关,而与糖尿病肾病或视网膜病变无关,其原因值得深入研究。
4 转录因子对Glo 1的调控
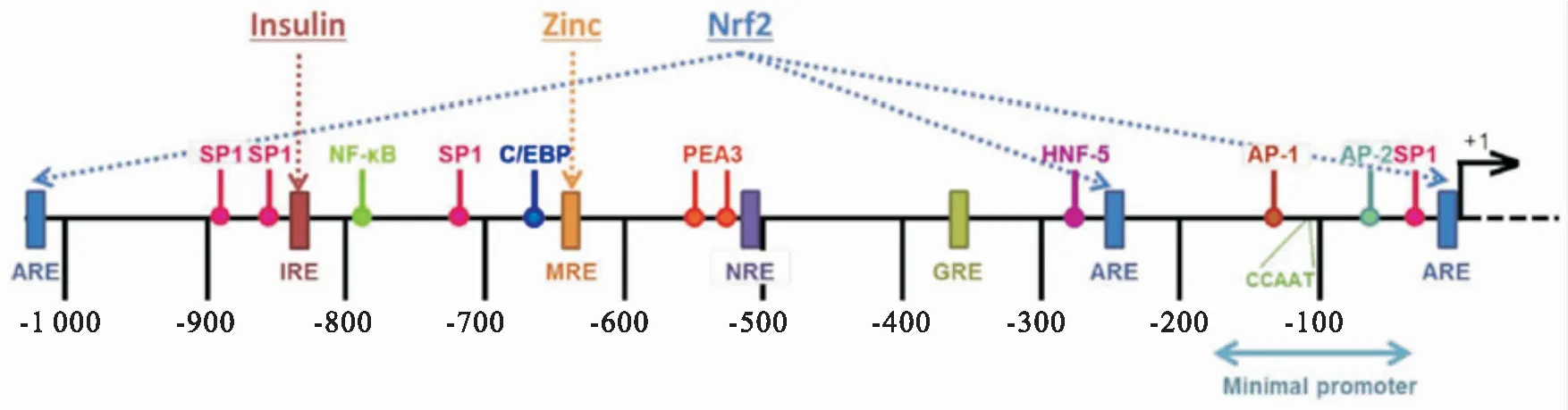
Fig 1 Schematic diagram of transcription factor binding site of Glo 1 gene promoter region
在Glo 1基因启动子区已经发现了几个重要的转录因子结合位点,包括抗氧化应答元件(antioxidant response-element,ARE)、胰岛素应答元件(insulin-response element,IRE)、金属应答元件(metal-response element,MRE)、负调节元件(negative regulatory element,NRE)和糖皮质激素应答元件(glucocorticoid response element,GRE)、特异性蛋白1(specificity protein 1,SP1)、核因子κB(nuclear factor κappa B,NF-κB)、CCAAT增强子结合蛋白(CCAAT-enhancer-binding protein,C/EBP)和激活蛋白1(activator protein 1,AP-1)等[5](Fig 1)。
4.1 在癌症中转录因子对Glo 1的调控ARE位于Glo 1基因第1个外显子的5’-UTR区域,当细胞处于氧化应激的状态时,核因子红细胞2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)被激活进入细胞核内,与ARE应答元件结合,从而调控Glo 1的转录[18]。在癌细胞中Nrf2表达增加,导致Glo 1基因转录水平上调。肝癌中Nrf2表达增加的高患病率与生存率降低有明显相关性,可能也与Glo 1介导的MDR有关。用Nrf2激活剂鼠草酸预处理SH-SY5Y神经母细胞瘤细胞,可减少MG及其衍生物晚期糖基化终末产物(advanced glycation end products,AGEs)形成。同时,鼠尾草酸还诱导了乙二醛酶系中谷胱甘肽(glutathione,GSH)的表达,这可能有利于形成D-乳酸,从而使MG在这些细胞中得以清除[19]。炎症中激活的NF-κB与Nrf2不同,能下调Glo1的表达。此外,AP-1/2和SP1位点位于Glo1基因最小启动子区域(-40~-182 bp),在癌细胞中两者缺失可导致启动子活性的完全丧失。用100 g·L-1的胰岛素处理HepG2细胞后,Glo 1基因的启动子活性上升了2倍,说明胰岛素可能通过IRE来调控Glo1的表达。25、75 μmol·L-1ZnCl2处理HepG2细胞48 h后,Glo 1基因的启动子活性上升了2倍,表明该序列中的MRE对Glo 1的表达具有调节作用[20]。
5 非编码RNA对Glo 1的调控
人类基因组计划揭示人基因组中有30亿个碱基对,其中1.5%能够编码蛋白质,98.5%是非蛋白质编码基因,这些基因序列一度被认为是垃圾基因。但随后的“DNA元件百科全书(encyclopedia of DNA elements,ENCODE)”计划表明,大约75%的人类基因组能被转录成RNAs,其中74%是非蛋白编码RNA(non-coding RNA,ncRNAs)。目前,ncRNA研究领域主要包含微小RNA(microRNA,miRNA)和长链非编码RNA(long non-coding RNA,lncRNA)。近年研究证明,ncRNAs在许多生命活动过程中扮演着重要角色[21]。
5.1 癌症中miRNA对Glo 1的调控miRNA是存在于真核生物及病毒中的一类长约19~25 nt短序列的内源性非编码RNA,在各物种间具有高度的保守性。miRNAs通过抑制翻译或降解靶标mRNA,调节基因的表达来参与调控一系列生命活动,包括细胞增殖、生长发育、器官形成、造血、凋亡、肿瘤的发生。在哺乳动物中,大约有50% mRNA的翻译由miRNA调控[22]。近些年,随着科学研究的进展,大量的miRNA已经被鉴定出来,截至目前,发现人的成熟miRNA有2 693条,小鼠的有2 013条,秀丽隐杆线虫的有267条。研究发现,miR-137直接靶向Glo 1 3′-UTR。过表达miR-137可以降低黑色素瘤细胞内源性Glo 1 mRNA和蛋白表达,而miR-137抑制剂上调Ma-Mel-79b和Ma-Mel-86b细胞中Glo 1 mRNA的表达,抑制黑色素瘤细胞的增殖,表明Glo 1可能是黑色素瘤的潜在治疗靶点[23]。
5.2 阿尔茨海默病中lncRNA对Glo1的调控lncRNA是一类长度大于200 nt的ncRNA,广泛存在于哺乳动物细胞中。lncRNA生物学功能多样,主要表现在表观遗传学调控、转录调控和转录后调控3个方面,参与各种疾病发生、发展[24]。Zhang等[25]运用lncRNA-seq对快速老化小鼠SAMP8和对照小鼠SAMR1脑lncRNA进行分析,发现有7条lncRNA调控Glo 1,但其调控机制尚需进一步阐明。
6 总结与展望
MG是含有2个羰基的有毒化合物,随着糖酵解过程产生,经过乙二醛酶系统代谢为无毒的D-乳酸而排除体外。但在糖酵解异常的病理状态下,体内Glo 1表达异常,造成MG积累量异常。MG的累积与多种疾病的发生、发展密切相关,包括癌症、神经系统疾病等。癌细胞为了存活和分裂,利用Warburg效应来产生大量的ATP,导致MG的大量产生,从而需要高速率的乙二醛酶系进行清除[26]。在多种类型的肿瘤中,Glo 1通过CNV或者利用转录因子进行表达调控,导致Glo 1表达和活性明显升高。在人类晶状体和大脑中,MG积累量随着年龄的增长而升高,而Glo 1的表达和活性随着年龄的增长而降低[27]。此外,在阿尔茨海默病的患者脑组织中,Glo 1表达在早期增加,但在晚期减少,MG的积累量也随之增加[28]。在神经系统疾病中,Glo 1可能通过SNP或者ncRNAs进行调控,导致Glo 1表达和活性降低,其机制尚需进一步的研究。综上,Glo1在不同疾病中的变化规律不同,CNV、SNP、转录因子和非编码RNA提示我们,从CNV、SNP、转录因子和非编码RNA等多方面综合系统研究Glo 1在不同疾病中表达调控的规律意义重大,通过这些研究可以为相关疾病的诊断和和治疗提供潜在的靶点和新思路。