循环miRNAs评估颈动脉粥样硬化斑块稳定性的临床意义
程兴 潘小玲 杨雯 胡传琛 陆海鹏 王建伟 应鸣翘 傅亚明 邵慧军 陈红芳
缺血性脑卒中易导致患者残疾甚至死亡,其中由于颈动脉粥样硬化斑块破裂、脱落所致的缺血性脑卒中约占20%。然而,目前临床上缺乏可以有效评估斑块稳定性以便筛选缺血性脑卒中高危人群的生物标志物。miRNAs是真核生物体内能够可逆性调控基因表达的一类非编码RNA,参与几乎所有人体生命活动的主要进程,包括细胞增殖、分化和凋亡等[1]。本研究选取5种可能与动脉粥样硬化斑块形成相关的miRNAs,即miR-21、miR-126、miR-155、miR-221、miR-222,比较其在不同类型颈动脉粥样硬化斑块患者中的表达水平,并探讨这些指标评估斑块稳定性的临床意义,现将研究结果报道如下。
1 对象和方法
1.1 对象 选取2016年9月至2017年3月我院神经内科就诊的脑梗死组患者35例(脑梗死组),其中男24 例,女 11 例,年龄 50~84(69.3±10.6)岁;同期体检中心经多普勒彩超证实存在颈动脉不稳定斑块患者41例(不稳定斑块组),男 24例,女17例,年龄 45~90(66.0±11.2)岁;稳定斑块患者 28例(稳定斑块组),男16 例,女 12 例,年龄 58~82(68.3±5.8)岁;另选健康体检者30例作为健康对照组,其中男16例,女14例,年龄54~78(66.7±7.2)岁。脑梗死组患者诊断均符合2014年中国急性缺血性脑卒中诊治指南标准,经头颅MRI检查证实为颈内动脉系统的脑梗死,且经多普勒彩超证实合并存在颈动脉不稳定斑块。所有受试者均排除急慢性炎症、恶性肿瘤及血液系统疾病,并均签署知情同意书。
1.2 研究方法
1.2.1 一般资料比较 记录并比较4组对象吸烟、饮酒情况及高血压、糖尿病、冠心病、房颤患病率,记录并比较各组血脂 4项水平(LDL-C、HDL-C、TG、TC)。
1.2.2 实时定量荧光PCR(RT-qPCR)检测 引物设计及合成委托上海吉玛制药技术有限公司进行,各基因的引物序列见表1。以Trizol试剂(美国Invitrogen公司)、氯仿提取血浆总RNA,异丙醇沉淀回收RNA,75%乙醇洗涤RNA沉淀,焦炭酸二乙酯(DEPC)水溶解,得到RNA溶液。利用提取的总RNA,加入特异性引物,用DEPC 水定容至 12μl,70℃温浴 5min,迅速置冰上 10s。离心,加入 4μl反应缓冲液、2μl dNTP、1μl RNA 酶抑制剂、1μl RevertAidTMM-MuLV 逆转录酶(加拿大 Fermentas公司),37℃温浴 5min,42℃温浴 1h,70℃温浴10min后终止反应。Q-PCR利用SYBR GreenⅠ PCR试剂盒(上海吉玛制药技术有限公司)完成。PCR反应条件:95℃ 10min;然后进入 95℃ 15s,60℃ 1min的循环(共40次),每个反应有3次重复。以5S rRNA作为内参基因,采用2-ΔΔCt方法计算相对表达量,各组相比健康对照组的表达倍数差异采用log2转换。
1.3 统计学处理 采用SPSS 18.0统计软件。符合正态分布的计量资料以表示,组间比较采用单因素方差分析;计数资料以百分率表示,组间比较采用χ2检验;健康对照组与脑梗死组中miRNAs和血脂水平的相关性采用Pearson相关分析,P<0.05为差异有统计学意义。

表1 RT-qPCR反应引物序列
2 结果
2.1 4组对象的一般资料比较 见表2。
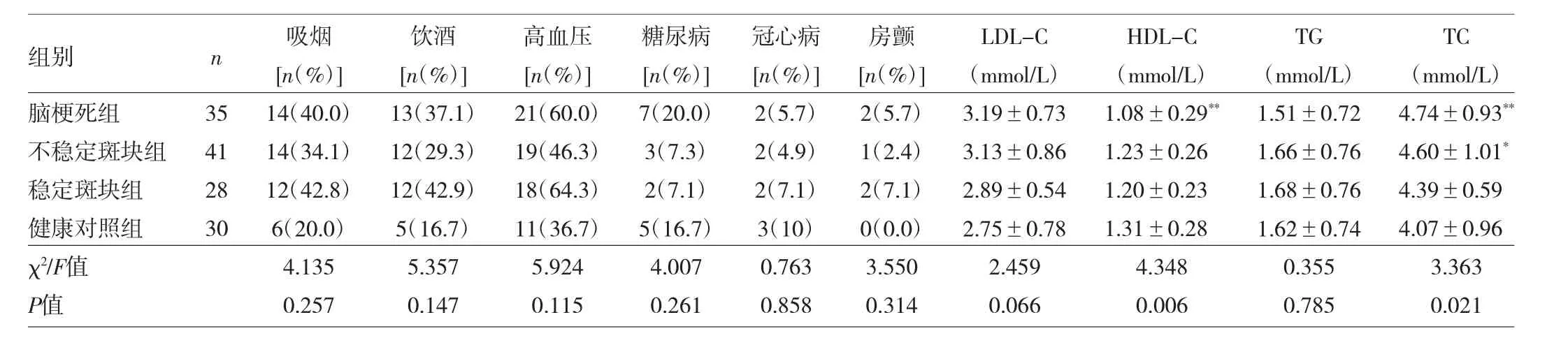
表2 4组对象的一般资料比较
由表2可见,4组对象吸烟、饮酒、高血压、糖尿病、冠心病、房颤患病率差异均无统计学意义(均P>0.05)。脑梗死组、不稳定斑块组的TC水平明显高于健康对照组,差异均有统计学意义(均P<0.05)。脑梗死组的HDL-C水平明显低于健康对照组,差异有统计学意义(P<0.01)。
2.2 4 组对象的 miR-21、miR-126、miR-155、miR-221、miR-222表达水平比较 见表3。

表 3 4 组对象的 miR-21、miR-126、miR-155、miR-221、miR-222 表达水平比较
由表3可见,脑梗死组、不稳定斑块组、稳定斑块组的 miR-21、miR-155、miR-221、miR-222 表达水平均明显高于健康对照组,差异均有统计学意义(均P<0.01)。不稳定斑块组的miR-126表达水平低于稳定斑块组,脑梗死组的miR-126表达水平低于不稳定斑块组,差异均有统计学意义(均P<0.01)。
2.3 miRNAs表达水平与血脂4项水平的相关性 见表4。
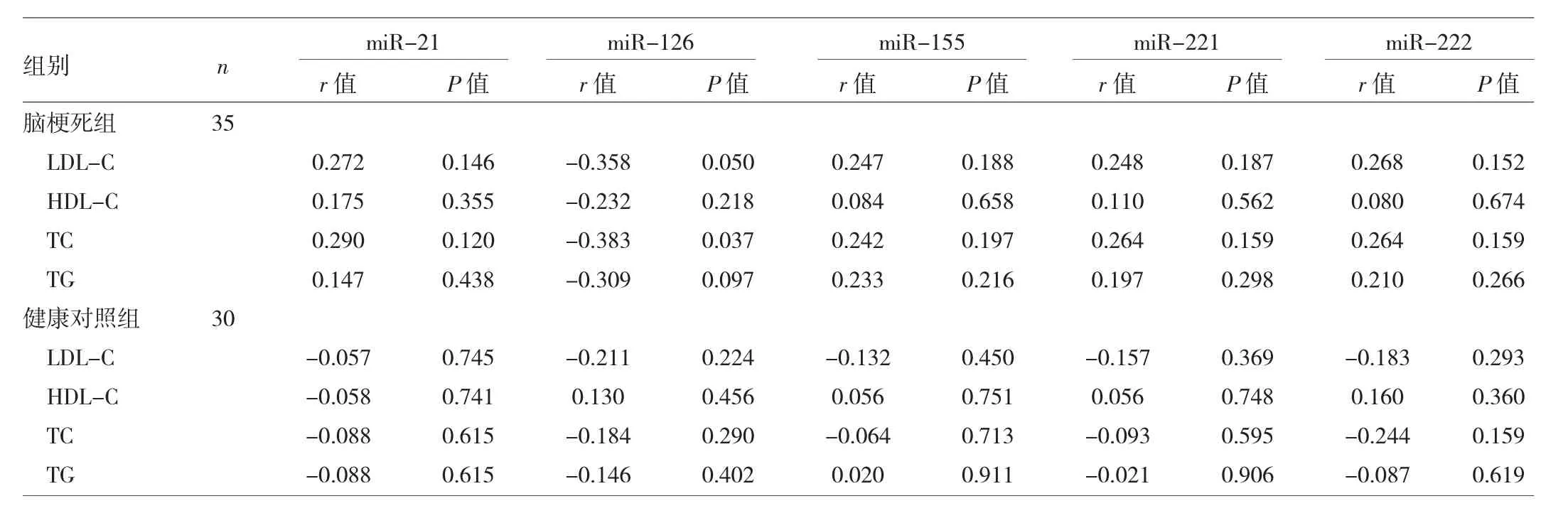
表4 miRNAs表达水平与血脂4项水平的相关性
由表4可见,脑梗死组的miR-126表达水平与LDL-C、TC 水平呈负相关,而 miR-21、miR-155、miR-221、miR-222与血脂水平无明显相关性。
3 讨论
动脉粥样硬化是累及中等或大血管的慢性血管炎症性疾病,目前认为其病理机制涉及血管内皮功能的失调引起管壁粥样硬化斑块的沉积,进一步发展导致血管的缺血、闭塞。miRNAs可通过调控血管内皮细胞的功能,参与血管平滑肌细胞从非增殖状态到增殖状态的转化,与动脉粥样硬化形成密切相关。本研究选取迄今为止文献报道在人体或动物实验中发现可能与动脉粥样硬化相关的其中5种miRNAs,即miR-21、miR-126、miR-155、miR-221、miR-222,进一步探究其在不同类型颈动脉粥样硬化斑块的表达差异。
通过比较5种miRNAs在脑梗死组、不稳定斑块组、稳定斑块组及健康对照组血浆中的表达水平,我们发现的确存在miRNAs表达水平的明显变化。其中,miR-21、miR-155、miR-221、miR-222 在脑梗死组、不稳定斑块组、稳定斑块组患者中均明显升高,提示其可能起到促进动脉粥样硬化形成的作用。有研究表明,动脉血管中miR-21的异常过表达易导致新生血管内膜损伤从而增加心血管事件风险[2-3]。Raitoharju等[4]发现miR-21在颈动脉粥样硬化患者中的表达水平显著上升,与我们的研究结果相一致。miR-155与内皮细胞炎症应答及机体免疫系统功能密切相关,通过调控内皮细胞一氧化氮合酶而影响血管内皮的舒张,从而促进动脉粥样硬化的发生[5]。在动脉粥样硬化小鼠的外周血和巨噬细胞中,miR-155的表达水平明显升高,敲除或抑制miR-155可明显缩小斑块的大小及抑制巨噬细胞的积聚[6-7]。而miR-221、miR-222的生物学功能则被认为具有细胞特异性:在血管平滑肌细胞中,miR-221、miR-222具有促进细胞增殖、迁移、凋亡的作用,而在血管内皮细胞中其作用则恰好相反[8]。本研究值得关注的另一个发现,miR-126在脑梗死组、不稳定斑块组、稳定斑块组之间存在显著梯度性的下降。miR-126在血管内皮细胞中高度表达,与血管重塑密切相关,可调控血管细胞黏附分子1、单核细胞趋化蛋白等相关靶基因的表达[9]。目前研究认为,miR-126的表达升高可起到抗动脉粥样硬化作用。在大鼠线栓法大脑中动脉闭塞模型中,血清miR-126的表达水平被检测到明显的降低[10]。目前认为,斑块的稳定性主要与其内部脂质含量相关,其中主要指的是氧化LDL-C[11]。另外,我们在脑梗死组与健康对照组比较中发现,miR-126的表达水平与LDL-C、TC水平呈明显负相关。因而,本研究首次揭示miR-126可能与颈动脉粥样硬化斑块的发展、演变密切相关,并且有望成为预测脑卒中风险评估的生物标志物。
本研究测定了与动脉粥样硬化斑块形成、演变密切相关的5种miRNAs在不同类型颈动脉粥样硬化斑块,即脑梗死组、不稳定斑块组、稳定斑块组及健康对照血浆中的表达水平。我们发现miR-21、miR-155、miR-221、miR-222在脑梗死组、不稳定斑块组、稳定斑块组中均明显升高,提示可能起着促进动脉粥样硬化形成的作用。而miR-126在脑梗死组、不稳定斑块组、稳定斑块组之间存在显著梯度性的下降,揭示miR-126可能与颈动脉粥样硬化斑块的发展、演变落密切相关,并且有望成为预测脑卒中风险评估的生物标志物,值得后续更大样本或多中心的病例对照研究进行进一步的论证。

