非小细胞肺癌劳拉替尼获得性耐药细胞株的建立及耐药后治疗策略
邱英 周娟 杜豆 马灏川 纪佳朋 张为民,
1 广东药科大学(广州510006);2中国人民解放军南部战区总医院肿瘤科(广州510010)
棘皮动物微管相关蛋白样蛋白4-间变性淋巴瘤激酶(echinoderm microtubule-associated proteinlike 4-anaplastic lymphoma kinase,EML4-ALK)的小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)是EML4-ALK 融合基因阳性晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的标准一线治疗。从2011年第一代ALK-TKI 克唑替尼获得FDA 批准上市到现在已经发展到第三代劳拉替尼。克唑替尼一线治疗EML4-ALK 阳性NSCLC的ORR 为74%,中位PFS 达10.9 个月[1]。二、三代ALK-TKIs 艾乐替尼、劳拉替尼等在克唑替尼耐药及初治人群中均显示出良好的疗效[2-3],但最终都会发生耐药[4-5]。发现并克服ALK-TKIs 耐药是目前EML4-ALK 阳性晚期NSCLC 治疗面临的重要问题,遗憾的是虽然一代ALK-TKI 克唑替尼的耐药机制较明确,第三代ALK-TKI 劳拉替尼的耐药机制未阐明,发现劳拉替尼耐药机制并克服其耐药是临床重大课题。
体外建立耐药细胞用于模拟临床患者的获得性耐药,是研究耐药机制的主要手段之一[6]。目前国内外建立了一代ALK-TKI 克唑替尼和二代ALK-TKI 艾乐替尼耐药细胞系[7-8],以及一线使用三代ALK-TKI 劳拉替尼耐药细胞系[7],但尚无在克唑替尼耐药基础上建立劳拉替尼耐药细胞系的相关研究。为探索二线使用劳拉替尼的耐药机制,本研究选用EML4-ALK 融合基因阳性、对克唑替尼耐药的肺癌细胞SNU-2535,予以逐步递增劳拉替尼剂量法建立获得性耐药细胞株SNU-2535 LR,探讨其耐药机制,并探讨是否存在逆转其耐药的治疗策略及耐药后对不同化疗药物敏感性的差异,为临床劳拉替尼耐药后选择合适的治疗策略提供依据。
1 材料与方法
1.1 细胞与主要实验材料 人NSCLC 原发性克唑替尼耐药细胞株SNU-2535 购自美国Creative bioarray 公司。劳拉替尼、克唑替尼、APR-246 粉末制剂购于美国Selleck 公司,顺铂、紫杉醇、培美曲塞、吉西他滨、多西他赛购自MCE 公司,RPMI-1640 培养基、胎牛血清、胰蛋白酶消化液购自美国Gibco 公司,CCK-8 细胞活性检测试剂盒购自日本Dojindo 公司,二甲基亚砜(DMSO)购自美国MP 公司,ALK 一抗、兔二抗均购自美国CST 公司,β-actin一抗购自美国Affinity 公司,免疫印迹化学发光试剂ECL 购自美国Millipore 公司。
1.2 细胞培养及劳拉替尼耐药细胞株SNU-2535 LR 的建立 细胞常规培养于含10%胎牛血清的RPMI-1640 培养基中,在37 ℃、5%CO2恒温培养箱孵育,根据细胞状态和密度更换培养液或传代。采用逐步递增药物浓度法建立获得性耐药细胞株,取对数生长期的SNU-2535 细胞,以500 nmol/L劳拉替尼为初始浓度处理细胞,24 h 后更换培养液,去除凋亡细胞、细胞碎片以及代谢产物,避免对活细胞造成伤害,待细胞耐受并稳定生长后,对细胞进行1∶2 传代,倍增药物浓度,最终细胞能够耐受16 μmol/L 劳拉替尼,并在终浓度下维持培养1 个月,历时7 个月成功建立了劳拉替尼耐药细胞株,将其命名为SNU-2535 LR。
1.3 CCK-8 法 检测SNU-2535 LR 细胞的劳拉替尼耐药性:取对数生长期的SNU-2535、SNU-2535 LR 细胞,按每孔4 000 个细胞密度接种于96 孔板,培养24 h 后,加入不同浓度的劳拉替尼,对SNU-2535 细胞起始浓度10 μmol/L,依次3 倍稀释共6 个浓度梯度,对SNU-2535 LR 细胞起始浓度100 μmol/L,依次10 倍稀释共6 个浓度梯度,同时设置空白对照组,每组设置5 个复孔,继续培养72 h后,吸去上清,每孔分别加入RPMI-1640 培养基100 μL 和CCK-8 试剂10 μL,继续孵育2 h 后检测450 nm 处OD值,用Graphpad Prism 7.0 软件计算半数抑制浓度IC50和耐药指数(RI),RI=IC50(SNU-2535 LR)/IC50(SNU-2535)。
检测耐药前后细胞对克唑替尼的敏感性:具体操作和计算方法同上,对SNU-2535 细胞克唑替尼起始浓度30 μmol/L,依次3 倍稀释共6 个浓度梯度,对SNU-2535 LR 细胞起始浓度10 μmol/L,依次10 倍稀释共6 个浓度梯度。
检测APR-246 对SNU-2535 LR 细胞耐药性的逆转作用:具体操作和计算方法同上,测P53蛋白激动剂APR-246对SNU-2535 LR细胞增殖的抑制作用时,APR-246 起始浓度为100 μmol/L,依次10 倍稀释共6 个浓度梯度。联合APR-246 和劳拉替尼时,将APR-246 浓度固定在5 μmol/L(小于APR-246 单药IC50值),劳拉替尼起始浓度为100 μmol/L,依次10 倍稀释共5 个浓度梯度,计算出联合IC50值。逆转倍数=IC50(劳拉替尼单药)/IC50(APR-246 与劳拉替尼联用)。
检测SNU-2535、SNU-2535 LR 细胞对不同化药物的敏感性:具体操作和计算方法同上,所有药物依次10 倍稀释共5 个浓度梯度,不同药物对不同细胞选用的药物浓度梯度有所不同,具体分组如下:顺铂组、培美曲塞组、吉西他滨组两株细胞起始浓度分别为1 000、100、10 μmol/L;紫杉醇组SNU-2535 LR 细胞起始浓度为10 μmol/L,SNU-2535细胞起始浓度为100 μmol/L;多西他赛组SNU-2535 LR 细胞起始浓度为1 μmol/L,SNU-2535 细胞起始浓度为100 μmol/L。
1.4 二代测序(NGS)检测细胞ALK及其它相关基因突变 取对数生长期的SNU-2535、SNU-2535 LR细胞消化离心弃上清后,用1 mL PBS 重悬后置于4 ℃冰盒中,送燃石医学公司行NGS 技术检测肺癌相关168 基因突变情况。
1.5 Western Blot分析相关蛋白的表达 SNU-2535与SNU-2535 LR 细胞加入裂解液,置于冰上裂解后提取蛋白并测定浓度,等量上样后行8% SDSPAGE 分离蛋白,转膜,封闭,按适当比例加入相应的一抗(按说明书稀释),4 ℃孵育过夜,TBST 洗膜3 次,再加入相应二抗,室温摇床反应1 h,TBST 洗膜3 次,最后用ECL 显色并采用化学发光成像系统成像。
1.6 统计学方法 以上所有试验重复3 次,应用Graphpad Prism 7.0 软件作图,SPSS 20.0 统计学软件统计数据,数值以均数±标准差表示,两组间比较采用t检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 耐药细胞株SNU-2535 LR 的建立 历时7 个月成功在体外构建劳拉替尼获得性耐药细胞株SNU-2535 LR,用不含药物培养基继续培养洗脱劳拉替尼4 个月后,细胞毒性实验结果提示,随着劳拉替尼浓度的增加,亲本细胞SNU-2535 和耐药细胞SNU-2535 LR 的存活率都逐渐降低,劳拉替尼对SNU-2535 细胞增殖的抑制作用明显强于SNU-2535 LR 细胞,劳拉替尼对他们IC50值分别为(1.362±0.324)μmol/L和(46.433±9.562)μmol/L(P<0.05),RI 为34.092,表明SNU-2535 LR 细胞显示出明显的劳拉替尼耐药特征。见图1A、1B。
2.2 耐药细胞株SNU-2535 LR ALK及其他相关基因突变变化 NGS 检测结果显示,SNU-2535 细胞EML4-ALK 融合基因阳性,且合并ALK p.G1269A点突变(克唑替尼耐药继发突变基因);耐药细胞SNU-2535 LR 较亲本细胞SNU-2535 EML4-ALK丰度(55.45%vs.28.37%)及ALK p.G1269A 丰度(34.46%vs.0)显著降低,新出现TP53 突变,丰度接近100%,未提示ALK 激酶域的继发突变、融合基因扩增。
2.3 耐药细胞株SNU-2535 LR 的EML4-ALK 相关蛋白表达变化 Western Blot 结果显示,与亲本细胞SNU-2535 比较,耐药细胞SNU-2535 LR 的EML4-ALK V1、EML4-ALK V3 蛋白表达下降(P<0.05)。见图2。
2.4 耐药细胞株SNU-2535 LR 对克唑替尼敏感性的变化 CCK-8 检测结果显示,克唑替尼对耐药细胞SNU-2535 LR 的IC50值为(4.726 ± 1.056)μmol/L,与亲本细胞(1.211 ± 0.033)μmol/L 相比,明显升高(P<0.05)。表明相对亲本细胞,耐药细胞不仅对劳拉替尼敏感性下降,对克唑替尼的敏感性也明显下降。见图1C、1D。
2.5 APR-246 对SNU-2535 LR 细胞耐药性的逆转作用 APR-246(5 μmol/L)联合不同浓度的劳拉替尼作用于SNU-2535 LR 细胞,劳拉替尼的IC50值为(9.738 ± 0.548)μmol/L。与未加APR-246 处理时的(46.433 ± 9.562)μmol/L 相比,劳拉替尼对SNU-2535 LR 细胞的IC50 值明显下降(P<0.05),说明联合APR-246 和劳拉替尼可以部分恢复SNU-2535 LR 细胞对劳拉替尼的敏感性,起到逆转耐药作用,计算得耐药逆转倍数为4.768。见图1E、1F。
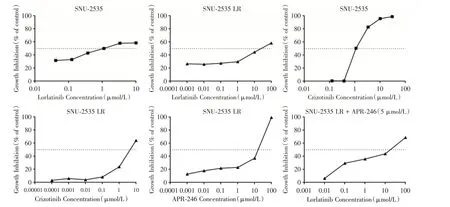
图1 不同抑制剂对相应细胞的生长抑制曲线Fig.1 The growth inhibition curves of different inhibitors in SNU-2535 and SNU-2535 LR cells
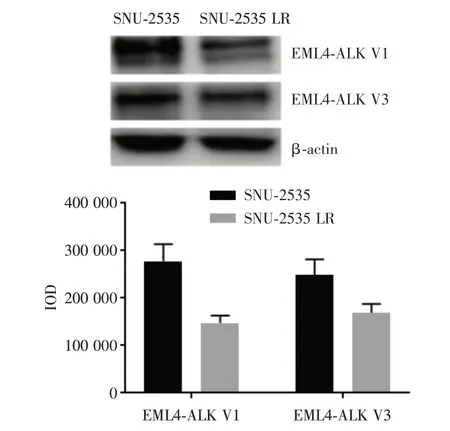
图2 Western Blot 检测SNU-2535、SNU-2535 LR 细胞EML4-ALK 相关蛋白的表达Fig.2 The expressions of EML4-ALK-related proteins inSNU-2535 and SNU-2535 LR cells
2.6 耐药细胞株对不同化疗药物敏感性变化 耐药细胞株SNU-2535 LR 对吉西他滨、多西他赛、紫杉醇敏感性均优于顺铂和培美曲塞(P<0.05),其中多西他赛最为敏感。对比亲本细胞,耐药细胞株SNU-2535 LR 对吉西他滨、多西他赛、紫杉醇的敏感性明显提高(P<0.05),对顺铂的敏感性下降(P<0.05);对培美曲塞敏感性均较差,不可比较。见表1。
表1 SNU-2535 和SNU-2535 LR 细胞对不同化疗药物IC50值Tab.1 The IC50 values of different chemotherapeutic drugs in SNU-2535 and SNU-2535 LR cells ±s
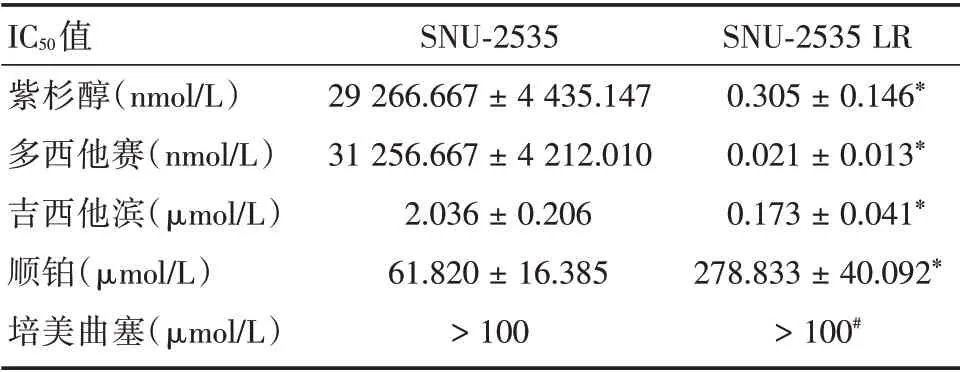
表1 SNU-2535 和SNU-2535 LR 细胞对不同化疗药物IC50值Tab.1 The IC50 values of different chemotherapeutic drugs in SNU-2535 and SNU-2535 LR cells ±s
注:*表示与SNU-2535细胞比,IC50值差异有统计学意义(P<0.05);#P 值无法计算
IC50值紫杉醇(nmol/L)多西他赛(nmol/L)吉西他滨(μmol/L)顺铂(μmol/L)培美曲塞(μmol/L)SNU-2535 29 266.667±4 435.147 31 256.667±4 212.010 2.036±0.206 61.820±16.385>100 SNU-2535 LR 0.305±0.146*0.021±0.013*0.173±0.041*278.833±40.092*>100#
3 讨论
本研究选取NSCLC 克唑替尼原发性耐药细胞SNU-2535,经NGS 检测证实EML4-ALK 融合基因阳性且合并ALK p.G1269A突变,通过药物浓度递增法构建劳拉替尼获得性耐药细胞系SNU-2535 LR,随着药物浓度的提高,细胞对劳拉替尼的敏感性逐渐降低,最终产生了显著的耐药,RI为34.092,提示体外首次在伴G1269A 突变的克唑替尼耐药基础上成功建立劳拉替尼耐药细胞模型。
为进一步对SNU-2535 LR 细胞的耐药机制进行探讨,笔者对耐药前后细胞行NGS 检测发现EML4-ALK 丰度明显降低,ALK p.G1269A 突变消失,未出现ALK 激酶域的二次突变或融合基因扩增等;通过Western Blot 实验证实了SNU-2535 LR细胞EML4-ALK 融合基因相关蛋白EML4-ALK V1、EML4-ALK V3 表达下降;此外细胞毒性实验结果提示SNU-2535 LR 细胞劳拉替尼、克唑替尼敏感性均相对亲本细胞下降。以上结果表明ALK靶点减少可能是第三代ALK-TKI 获得性耐药的主要机制之一,与国外既往报道结果一致。ISOZAKI等[9]通过建立艾乐替尼获得性耐药细胞模型,发现其中一个耐药细胞系EML4-ALK 融合基因消失;YODA 等[5]对临床劳拉替尼耐药后的患者行基因检测,发现部分患者无继发突变,原有ALK 耐药突变位点的消失。这些结果表明ALK 靶点减少导致的获得性耐药继续使用ALK-TKIs 时效果不佳。
有研究提示p53 蛋白激活剂APR-246,能将突变型p53 蛋白重新折叠成野生型构象,从而诱导突变型p53 蛋白细胞凋亡[10]。本研究中耐药细胞系新出现TP53 突变,且丰度较高。所以本研究选用APR-246 尝试逆转SNU-2535 LR 耐药,联用5 μmol/L APR-246 后,劳拉替尼对SNU-2535 LR 的IC50值明显下降,逆转倍数为4.768,提示联合APR-246可逆转耐药。以上结果表明TP53突变可能是第三代ALK-TKIs 获得性耐药的机制之一。GAINOR等[4]对临床二代ALK-TKI 耐药患者进行二次活检发现,56%病理标本出现新的基因改变,其中TP53是最主要的突变基因,但该研究耐药前未对标本进行相应的检测,未能明确TP53 基因突变的产生能否导致耐药。而本研究证实了TP53 基因是劳拉替尼耐药后新出现的最主要突变基因,且联合P53 蛋白激活剂能逆转耐药。
劳拉替尼作为最新一代ALK-TKI,能克服一、二代抑制剂耐药,使肺癌患者从中获益[11],其耐药将使得ALK 靶向治疗陷入困境。针对劳拉替尼耐药后对不同治疗性药物的敏感性如何,目前暂没有临床大样本研究报道,在劳拉替尼获得性耐药株的基础上探索耐药后治疗具有重要意义。本研究提示劳拉替尼耐药后发生TP53 突变时,联用P53 蛋白激活剂APR-246 能逆转耐药,这为临床劳拉替尼耐药合并TP53 突变患者的治疗提供了一个新的方向。此外,本研究还探讨了劳拉替尼耐药后对临床常用化疗药物的敏感性,提示耐药细胞株对吉西他滨、多西他赛、紫杉醇敏感性均优于顺铂和培美曲塞,其中多西他赛最为敏感,而且相对耐药前对吉西他滨、多西他赛、紫杉醇的反应明显增强,可为临床劳拉替尼耐药患者后续化疗方案的选择提供一定的指导。
综上所述,本研究首次成功在克唑替尼耐药基础上建立劳拉替尼耐药细胞模型,并发现EML4-ALK 融合基因丰度下降及TP53 突变可能是其耐药机制之一。此外还发现,P53 蛋白激动剂联合劳拉替尼可为临床劳拉替尼耐药合并TP53 突变患者提供一个新的治疗方向;劳拉替尼耐药后继续化疗时可以尝试选择吉西他滨、多西他赛、紫杉醇。虽然对本研究为临床劳拉替尼耐药患者的后续治疗策略选择提供了理论支撑,但仍需要扩大样本在动物及临床中加以证实。

