干细胞转录因子Sox2和Nanog在非小细胞肺癌中的表达及意义
王永芳 宋姗姗 张春芳 陈昊
徐州医科大学附属连云港市第一人民医院(江苏连云港222002)
肺癌在我国发病率呈持续上升趋势,其病死率在全球范围内已跃居恶性肿瘤之首,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌总数的75% ~80%,腺癌和鳞癌是其最常见的病理亚型,尽管近几十年来NSCLC 的诊断和临床治疗取得了突破性进展,但NSCLC 患者5年总生存率仅约为15%,复发率仍居高不下[1-2]。近年来,肿瘤干细胞理论的提出为肺癌研究开辟了新方向,针对肿瘤干细胞的治疗策略有望成为治疗肺癌的有效手段之一[3]。Sox2 和Nanog 是维持成人和胚胎干细胞自我更新及多向分化潜能必不可少的转录因子,共同位于细胞多能性调控网络的核心位置,调节多能相关基因的表达[4-5]。多项研究[6-10]显示Sox2 和Nanog 在多种肿瘤组织中表达失调,其异常表达与肿瘤细胞的发生发展密切相关。但同时研究两者在NSCLC 中表达的相关性报道较少,本实验采用免疫组化技术联合检测Sox2 和Nanog 蛋 白 在NSCLC 的表达情况,并 分析它们与临床病理参数之间的关系,探讨两者在NSCLC 发生发展过程中起到的作用,为寻求潜在治疗靶点提供实验基础。
1 资料与方法
1.1 一般资料 收集2010年6月至2017年6月在连云港市第一人民医院手术切除的120 例NSCLC标本作为观察组,年龄30~76 岁,中位年龄61 岁;男90 例,女30 例,经两位高年资病理医师依据2015年WHO 肺癌分类及诊断标准复核切片(鳞癌和腺癌各60 例)。肿块直径1.5 ~11 cm,中位直径3.5 cm;临床TNM 分期:Ⅰ期44 例、Ⅱ期36 例、Ⅲ期32 例、Ⅳ期8 例;有淋巴结转移46 例,无淋巴结转移74 例。所有患者均为首次发病且术前未进行化疗、放疗及免疫治疗,同时选取其中30 例患者癌旁组织(距癌组织≤3 cm)及正常肺组织(距癌组织>3 cm)作为对照组。本研究获得连云港市第一人民医院伦理委员会批准,样本提供者均签署知情同意书。
1.2 主要试剂 兔抗人Sox2 单克隆抗体(即用型)购自广州安必平生物科技有限公司,兔抗人Nanog 单克隆抗体(浓缩液)购自Cell Signaling Technology 公司,以1∶400 倍稀释。抗原修复液、过氧化物酶阻断剂、二抗、DAB 显色液、PBS 均购自美国DAKO 公司。
1.3 免疫组化 标本均用4%中性甲醛溶液固定,常规石蜡包埋,4 μm 厚连续切片,HE 染色,光镜下观察。免疫组化采用EnVision 二步法,应用仪器Roche BENCH MARK XT 免疫组化染色仪行免疫组化染色。操作流程严格参照试剂说明书要求,同时用PBS 代替一抗做阴性对照,已知阳性的NSCLC 组织作阳性对照。
1.4 结果判定 采用经典半定量积分法[11]:阳性细胞所占比例和着色强度两因素综合评分方法。选取染色均匀的阳性肿瘤区域,每张切片选取5 个高倍镜(× 200)视野,分别计算其阳性细胞所占比例和着色强度。(1)按阳性细胞所占比例计分:阳性细胞数<6%计0 分,6%~25%计1 分,26%~50%计2 分,51%~75%计3 分,>75%计4 分;(2)按着色强度计分:标本无着色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分。将两项得分结果相乘:0 分为(-),1~4 分为(+),5~7 分为(2+),8 分以上为(3+),—为阴性,+为弱阳性,2+为中阳性,3+为强阳性。
1.5 统计学方法 Excel 收集数据,运用SPSS 16.0软件对数据进行统计学分析,表达强度比较采用多组独立样本秩和检验,组间比较采用χ2检验,两种蛋白之间的相关性采用2×2 配对资料的关联性分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 Sox2 和Nanog 在NSCLC、癌旁及正常肺组织中的表达情况 Sox2 在NSCLC 组织中细胞核着色,以棕黄色颗粒为主,阳性表达率为59.2%(71/120);在癌旁组织中阳性表达率为13.3%(4/30),以淡黄色颗粒为主;在正常肺组织中阳性表达率为6.7%(2/30);NSCLC 组织中Sox2 表达显著高于癌旁组织及正常肺组织(均P<0.01)。见图1、表1。
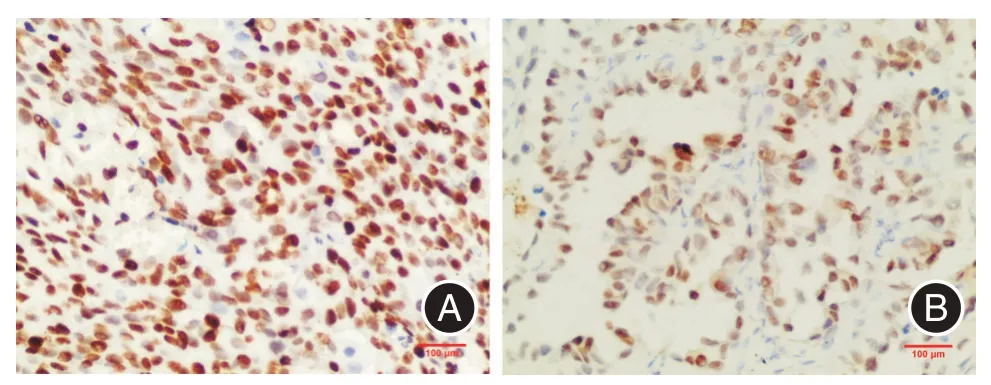
图1 Sox2 在肺鳞癌和腺癌中表达(EnVision 法,×200)Fig.1 The expression of Sox2 in lung squamous cell carcinoma and lung adenocarcinoma
Nanog 在NSCLC 组织中细胞核着色,以棕黄色颗粒为主,同时伴有细胞浆着色,Nanog 阳性表达率为48.3%(58/120);在癌旁组织中阳性表达率为6.7%(2/30),以淡黄色颗粒为主;在正常肺组织中未见阳性表达,三者比较差异有统计学意义(均P<0.01)。见图2、表1。
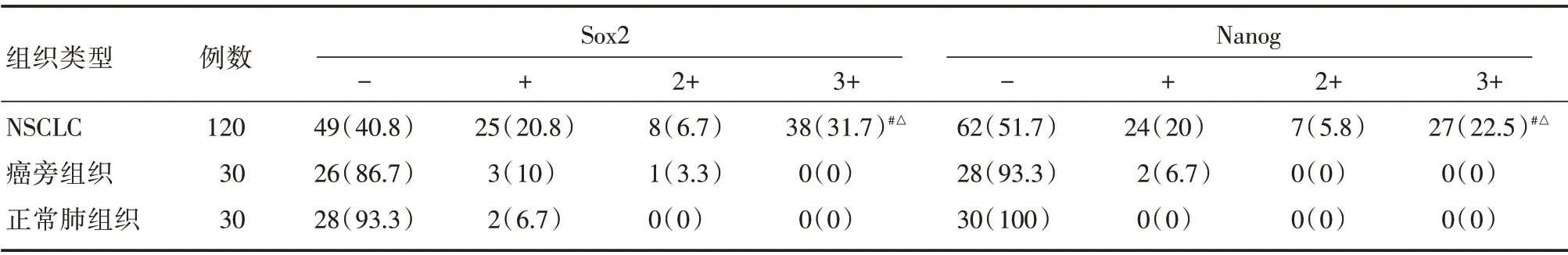
表1 Sox2 和Nanog 在不同病变肺组织中的表达Tab.1 Nanog and Sox2 were expressed in different lung tissues of different lesions例(%)
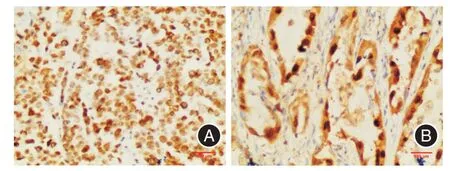
图2 Nanog 在肺鳞癌和腺癌中表达(EnVision 法,×200)Fig.2 The expression of Nanog in lung squamous cell carcinoma and lung adenocarcinoma
2.2 Sox2、Nanog 表达与NSCLC 的临床病理特征关系 Sox2 在肺鳞癌中阳性率为81.7%,在肺腺癌中阳性率为36.7%,差异有统计学意义(P<0.01);Nanog 在肺鳞癌中阳性率为58.3%,在肺腺癌中阳性率为38.3%,差异有统计学意义(P<0.05,表2)。NSCLC 中Sox2 的表达水平与肿瘤大小有关,随着肿瘤体积增大,Sox2 蛋白表达上调(表2);Nanog的表达水平与肿瘤大小、淋巴结转移及临床分期有关,其中Nanog 的表达水平与肿瘤大小呈正相关,临床分期Ⅲ+Ⅳ者高于Ⅰ+Ⅱ者,淋巴结转移者高于无转移者(P<0.05),但两者阳性表达与年龄和性别均无相关性(表2)。
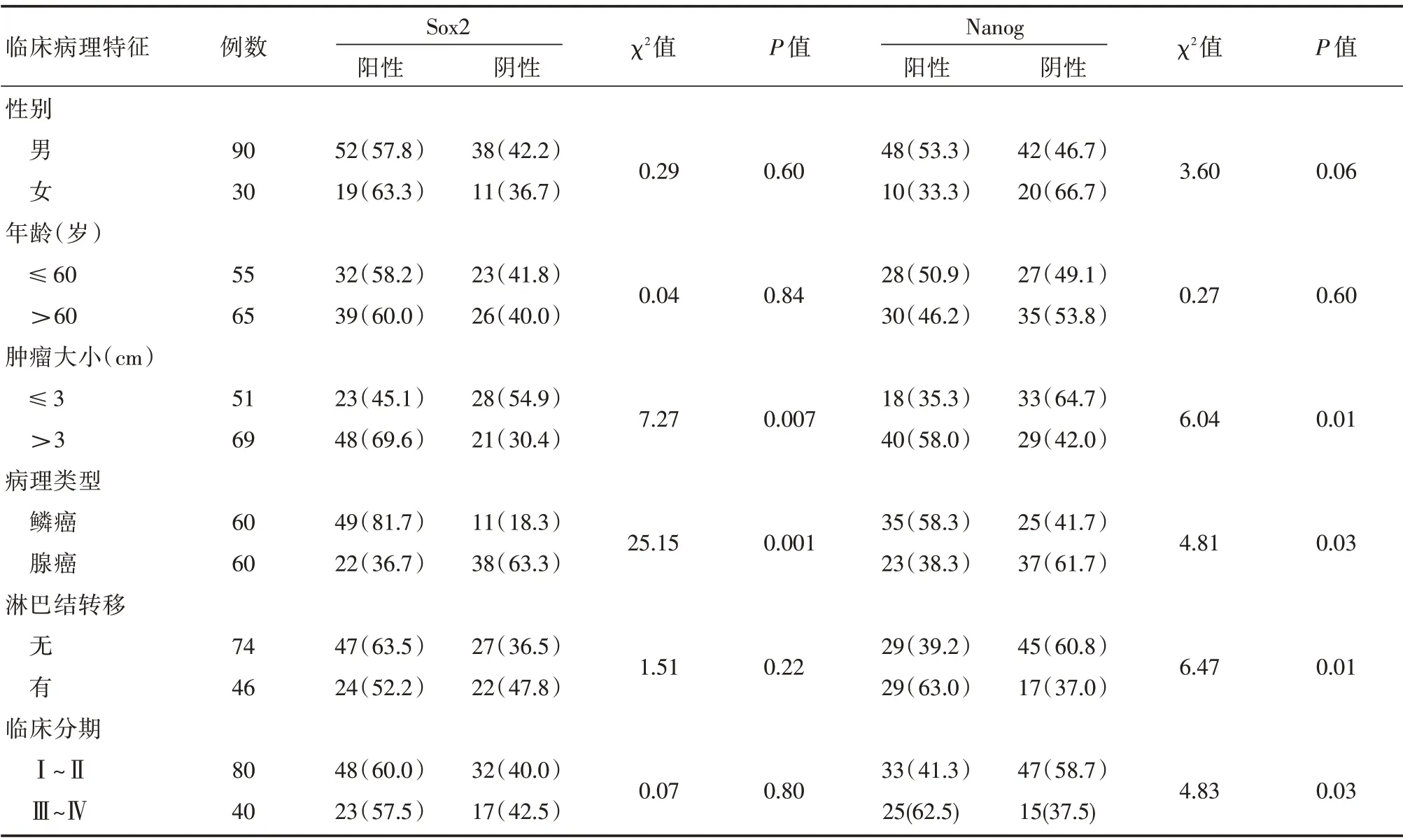
表2 Sox2 和Nanog 蛋白表达与NSCLC 临床病理的关系Tab.2 The correlation between expression of Nanog and Sox2 and clinicopathological characteristics of NSCLC 例(%)
2.3 NSCLC组织中Sox2和Nanog表达的相关性在120 例NSCLC 组织中Sox2 与Nanog 均阳性 者41例(34.2%),均阴性者32 例(26.7%),Sox2 阳性而Nanog 阴性者30 例(25.0%),Nanog 阳性而Sox2 阴性者17 例(14.1%)。2×2 配对资料的关联性分析显示,在NSCLC 中Sox2 与Nanog 表达呈正相关(r=0.227,P<0.05)。见表3。
3 讨论
Sox2 基因是Sox 家族的重要成员之一,位于染色体3q26.3-q27 上,通过与靶基因的HMG 结构域特异性结合,从而维持胚胎干细胞自我更新及分化潜能,且在重新程序化体细胞使之成为多能干细胞过程中发挥重要的作用。胚胎期间的Sox2 保持沉默,而在机体发育过程中,Sox2 被激活参与细胞分裂分化[12]。对肺脏的发育来说,Sox2 是一种重要的基因,多项研究[7,13]均显示Sox2 在肺、食道及头颈鳞癌中过表达。
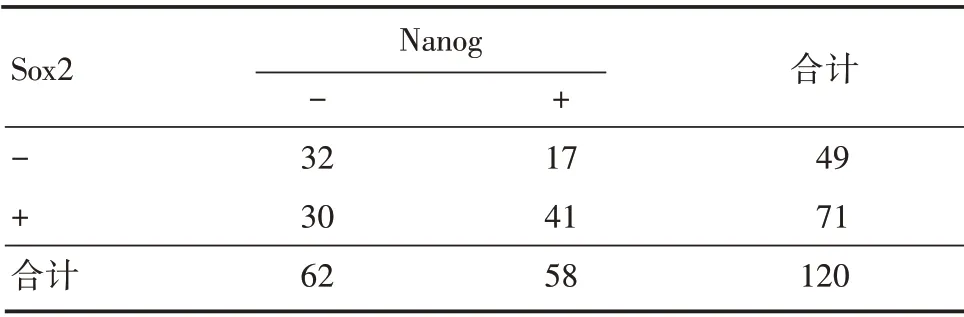
表3 NSCLC 组织中Sox2 和Nanog 表达的相关性分析Tab.3 Expression correlation between Nanog and Sox2 in lung NSCLC tissues 例
专家组通过对178 例肺鳞癌基因图谱测序数据表明Sox2 是与肺癌相关的癌基因,在肺鳞癌的发生发展中具有极其重要的作用[14]。为进一步探讨Sox2 蛋白表达与NSCLC 之间关系,本研究对120 例手术切除标本采用免疫组化检测,结果显示NSCLC、癌旁组织及正常肺组织中Sox2 阳性表达率呈降低趋势,在NSCLC 中的表达率显著高于癌旁组织和正常肺组织(均P<0.01),此外,Sox2 表达与病理类型密切相关,在鳞癌中的表达显著高于腺癌(81.7%vs.36.7%,P<0.01)。这些研究结果与其他学者结论一致,YING 等[11]发现Sox2 在NSCLC 组织中高表达,其表达率为35.4%,显著高于癌旁组织,Sox2 阳性表达率在肺鳞癌为50.0%,肺腺癌中为20.3%。癌症基因组图谱专家的研究揭示,Sox2 基因所在染色体3q26 区域在包括肺鳞癌在内的多种鳞癌中普遍扩增,提示Sox2 基因拷贝数增加可能参与肺鳞癌的恶性进展[14]。SASAKI 等[15]对127 例手术切除的肺非小细胞癌标本研究发现,Sox2 蛋白表达在鳞癌为85.4%,腺癌为45.5%,基因拷贝数增加在鳞癌中为15.4%,而在腺癌中则为3.8%,他们认为Sox2 基因拷贝数增加是引起其在肺鳞癌过表达的常见原因之一,而肺腺癌中Sox2 过表达可能是由转录水平或转录后修饰等其他机制引起。BASS 等[13]对肺和食管鳞癌的研究也表明Sox2 可能与鳞癌鳞状上皮分化有关,它可以诱导鳞癌相关因子p63 和角蛋白6A 的表达并促进癌细胞的增殖。
本实验结果还显示Sox2 阳性表达与肿瘤大小正相关,究其原因较为复杂,CHOU 等[16]的研究认为Sox2 可诱导激活EGFR 和BCL2L1 信号传导通路,形成Sox2-EGFR 反馈环进而促进肺癌细胞生长和增殖,这可能是其促进肿瘤体积增大的原因之一。RUAN等[17]在膀胱癌中研究也发现Sox2表达与肿瘤大小、肿瘤数量和肿瘤分级有关。有研究[18]表明Sox2 在NSCLC 中的高表达可以促进NSCLC 患者淋巴结转移和较晚的临床分期,可能在NSCLC的浸润及转移过程中起重要作用,Sox2 高表达的肿瘤恶性程度更高,预示患者较差的预后,推测其可作为NSCLC 独立的预后因素。本研究中Sox2 阳性表达与淋巴结转移和临床分期未见相关性,可能与本研究收集病例中晚期肿瘤组织标本较少有关,故仍需更大样本量多层次的深入研究。
Nanog 是又一重要的干细胞转录因子,和Sox2一起在早期胚胎发育过程中对维持人体胚胎干细胞多向分化潜能及决定细胞分化命运有重要作用,两者主要通过形成调控环路、激活其靶基因并与其他信号通路协同作用来维持干细胞全能性和自我更新能力。研究表明Nanog 在肺癌球细胞和乳癌CD44+细胞等肿瘤干细胞中表达升高,减少Nanog 的表达可以有效降低肿瘤干细胞比例[19]。
本实验结果显示,Nanog 蛋白在NSCLC 中的阳性表达率为48.3%,显著高于癌旁组织(6.7%),而在正常肺组织中未见阳性表达;本研究还发现Nanog 蛋白的表达与NSCLC 患者某些临床病理特征存在相关性,Nanog 蛋白的阳性表达率与肿瘤体积正相关,淋巴结转移组高于无转移组,临床TNM分期Ⅲ+Ⅳ者组高于Ⅰ+Ⅱ者,表明Nanog 可能参与了NSCLC 的增殖、侵袭及转移等多个过程。在其他肿瘤组织中也有相似的发现,LIU 等[20]发现卵巢癌患者组织中Nanog 在基因和蛋白水平均过表达,与肿瘤低分化显著相关,敲除Nanog 基因后可以抑制卵巢癌细胞增殖、侵袭和迁移。NAGATA等[21]对乳腺癌患者的研究也发现,与Nanog 表达较弱的患者相比,Nanog 强表达的患者的无病生存率和总生存率显着降低,Nanog 的强表达是乳腺癌患者预后不良的指标,Nanog 可刺激乳腺癌细胞的生长和转移。CHANG 等[22]对112 个肺癌大样本的多变量分析结果显示,Nanog 的表达与年龄、吸烟状况和分期等临床参数无相关性,但Nanog 高表达的患者无进展生存期和总生存期缩短。然而也有研究[23]发现Nanog 蛋白可能在肺癌的起始阶段发挥着重要作用,其研究结果显示Nanog 在肺癌中的表达在无淋巴结转移组中的表达高于有淋巴结转移者,而与肿瘤大小未见相关性,但其研究结果也同样表明Nanog 在肺癌中的表达显著高于良性病变和正常肺组织,说明Nanog 参与了肺癌的发生发展。但不同学者的关于Nanog 与临床病理参数关系的结论不尽相同,也进一步表明Nanog 对肺癌的作用可能存在极其复杂的调控机制,受到微环境和其他多种因子共同调控,需要更多样本量、更深层次和更广泛肿瘤类型的深入研究。MA 等[24]新近提出了一种基于反dsDNA 抗体修饰的Fe304 磁铁矿纳米粒子的多色检测方法,可以更加灵敏同时有针对性的快速检测癌症干细胞中Sox2、Oct4 和Nanog,该方法可以产生定量结果,可分析转录因子结合位点的多态性,为系统深入研究Nanog 干细胞转录因子提供了高效的研究平台。此外,本研究还显示Nanog 蛋白的表达与NSCLC的组织类型相关,Nanog 蛋白在肺鳞癌和腺癌中均有表达,但其在鳞癌中的阳性表达率较肺腺癌明显升高(P<0.05)。本实验结果相关分析显示,NSCLC 组织中Sox2 蛋白表达与Nanog 蛋白表达呈正相关,提示Sox2 和Nanog 在NSCLC 的发生发展中可能发挥协同作用。
综上所述,Sox2 和Nanog 在NSCLC 中的表达明显高于癌旁组织,并且两者呈正相关,说明两者共同参与了NSCLC 的发生和进展过程。此外,Sox2 和Nanog 的表达水平肿瘤大小及病理类型有关,在肺鳞癌中表达均显著高于肺腺癌,Nanog 表达水平与肿瘤大小、淋巴结转移及临床分期密切相关,两者相互协同在NSCLC 增殖转移及侵袭中发挥重要作用,有望作为评估NSCLC 进展和生物学行为的重要指标,靶向Sox2 和Nanog 可能是潜在、高效的治疗NSCLC 方法。这些研究结果为临床工作中NSCLC 诊断和评估进展提供了新的思路,但具体机制和应用价值还有待进一步深入研究。

