沉默miR-345联合5-FU对胃癌MGC803细胞增殖能力及凋亡的影响
邱厚匡, 李 博, 马 俊, 徐 敏, 王丽萍, 许 鸣
广东省第二人民医院 1.检验医学部; 2.消化科,广东 广州 510317; 3.佛山市第二人民医院消化科
我们前期实验发现,沉默miR-345的表达可引起胃癌细胞周期进程的停滞而减慢细胞生长速度[1]。进一步研究发现,沉默miR-345表达能抑制5-FU对MGC803细胞侵袭能力,且5-FU浓度为40 μg/ml时此协同作用最大[2]。因此本实验在前期研究成果的基础上,通过抑制胃癌MGC803细胞中miR-345的表达后,观察胃癌MGC803细胞在5-FU作用下增殖能力、细胞周期等变化情况,为我们成体系研究沉默miR-345表达增加5-FU对胃癌化疗敏感性寻求更多依据。
1 材料与方法
1.1 材料胃癌MGC803细胞购自南京凯基生物科技发展有限公司(产品批号:2016007100236.1);Lipofectamine 2000及Trizol购自Invitrogen公司;Real time-PCR检测试剂盒购自Roche公司;miR-345的RT和Real time-PCR引物由Invitrigen公司设计、合成;碘化吡啶(PI)购自美国Sigma公司;细胞凋亡检测仪购自南京凯基公司;Annexin V-FITC细胞凋亡检测试剂盒购自美国BD公司。
1.2 方法
1.2.1 细胞培养:胃癌MGC803细胞培养于质量浓度为100 g/L胎牛血清的DMEM培养基中,细胞融合度为70%~80%时,胰酶消化并传代1次。
1.2.2 实验分组与细胞处理:A组:空白对照组;B组:无义序列组;C组:反义miR-345组;D组:5-FU处理组;E组:反义miR-345+5-FU联合组。未经处理的MGC803细胞为空白对照组;合成错配寡核苷酸序列,利用Lipofectamine 2000脂质体将其转染入MGC803细胞为转染无义序列组;合成miR-345反义寡核苷酸序列,利用Lipofectamine 2000脂质体将其转染入MGC803细胞,为反义miR-345组;40 μg/ml 5-FU单独处理细胞为5-FU处理组;转染反义miR-345后用40 μg/ml 5-FU溶液处理为反义miR-345+5-FU联合组。
1.2.3 反义miR-345寡核苷酸设计合成及转染:从miRNAs靶基因库(http://microrna.sanger.ac.uk/targets/v3)获得miR-345基因序列,设计并合成甲基化miR-345反义序列:5′-UTCAATGTUGAATCCAGCAUAAGCUAGAGUCC-3′,无义序列:5′-UCUACUCUUAGGAGGUUGUUGATGCA-3′。将细胞接种于细胞培养板,Lipofectamine 2000转染试剂转染,在5 min内同稀释的寡核苷酸序列混合,将复合物加入到细胞培养板中继续培养48 h。
1.2.4 实时定量PCR检测miRNA:miR-345正向引物5′-GTCGTATCCAGTGCAGGGTCCGAGG-3′,反向引物5′-TATGCTGCTCGGGACCTGATCCTCA-3′,内参U6正向引物5′-GCAGGGTCCGAGGTATTCGCACTGG-3′,反向引物5′-ACAGTAGGAACGCGTCCCCGGTACG-3′,配制逆转录反应混合液:2×qPCRMix 10 μl,正反向引物(4 μmol/L)各1 μl,ddH2O补足体积为20 μl。所得数据采用将目的基因与内参基因的CT值比较后(△CT)的数值进行各样本间的差异比较。
1.2.5 克隆形成实验测定细胞增殖能力:收集对数生长期细胞,调整细胞悬液浓度为500个/ml,分于6孔板,每孔2 ml,即1 000个/孔,培养14 d。细胞固定:PBS洗3次,加固定液1 ml/孔,放置于摇床上10 min。染色:加结晶紫摇床上放置10 min,后冲洗干净。观察克隆形成情况:大于50个细胞的细胞团计为一个克隆,克隆形成率(%)=(克隆数/1 000)×100%,计算每个孔内形成的克隆数并拍照。
1.2.6 细胞凋亡与周期的测定:取对数生长期细胞消化并计数,加入质量浓度为100 g/L的胎牛血清DMEM培养液将贴壁细胞吹打成细胞悬液,置于2 ml离心管内,离心5 min后弃去上清,PBS溶液洗涤2~3次,避光加入凯基凋亡试剂盒中试剂,染色约20 min后,于流式细胞仪中488 nm激发波长下检测细胞凋亡及细胞周期分布情况。Annexin-V染色阳性,PI染色阴性的细胞为早期凋亡细胞。
2 结果
2.1 建立稳定下调miR-345表达的MGC803细胞荧光显微镜观察显示,转染后的MGC803细胞带有绿色荧光,说明两株细胞转染成功(见图1A)。空白对照组、无义序列组、反义miR-345组的miR-345 mRNA表达水平比较,差异有统计学意义(F=43.205,P<0.001)。反义miR-345组细胞的miR-345 mRNA水平低于空白对照组和无义序列组(P<0.01),而后两组中miR-345 mRNA表达水平差异无统计学意义(P>0.05)(见图1B)。
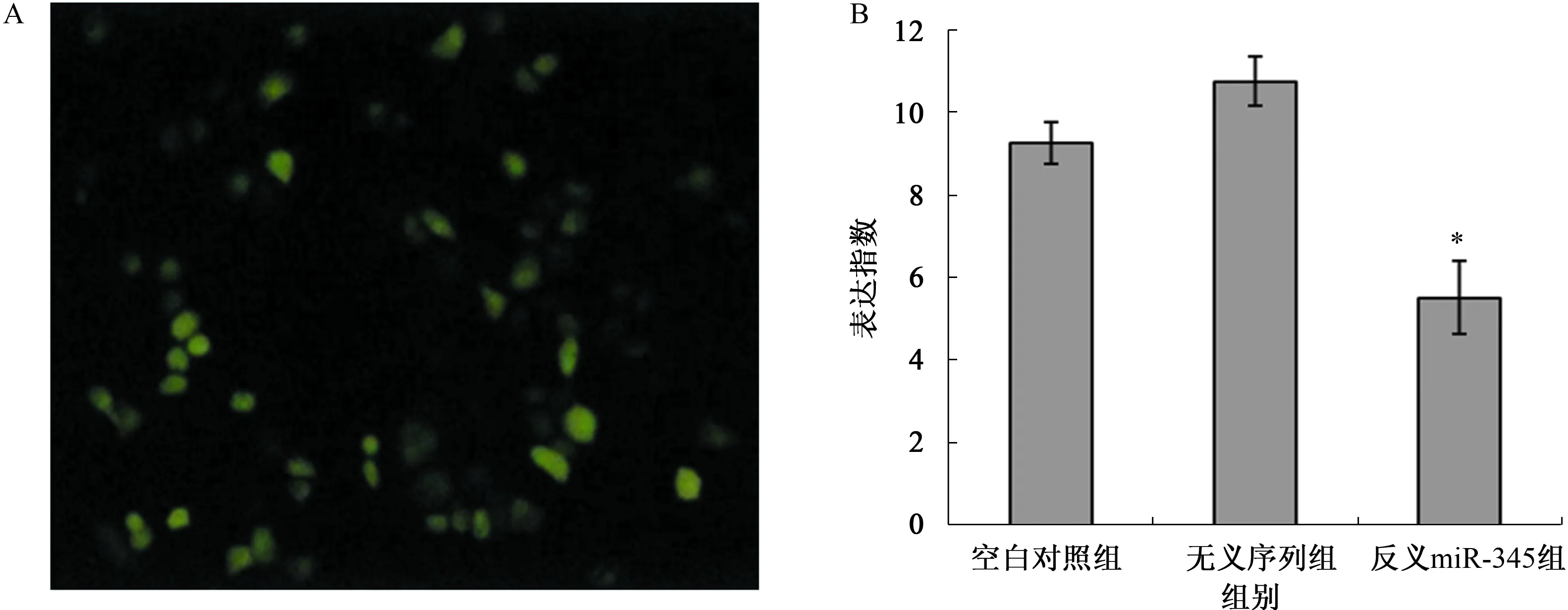
注:与空白对照组和无义序列组相比,*P<0.01。
2.2 沉默miR-345、5-FU对MGC803增殖能力的影响空白对照组、无义序列组、反义miR-345组、5-FU处理组、反义miR-345+5-FU联合组克隆形成率分别为:(33.08±0.98)%、(32.08±0.78)%、(13.11±0.65)%、(7.68±0.34)%、(4.29±0.83)%,联合组较单独5-FU处理组克隆形成率显著降低(P<0.01),联合组细胞增殖能力降低更为明显(见图2)。

图2 各组MGC803细胞克隆形成能力情况 A:空白对照组;B:无义序列组;C:反义miR-345组;D:5-FU处理组;E:反义miR-345+5-FU联合组Fig 2 The cloning ability of MGC803 cells in each group A: control group; B: undefined sequence group; C: miR-345 silence group; D: 5-FU group; E: 5-FU combined with miR-345 silence group
2.3 沉默miR-345、5-FU对MGC803凋亡的影响空白对照组与无义序列组的细胞凋亡率无明显差异,而反义miR-345组、5-FU处理组的细胞凋亡率明显高于空白对照组(P<0.01),说明转染反义miR-345、5-FU均能促进MGC803细胞凋亡;反义miR-345+5-FU联合组细胞凋亡率显著高于反义miR-345组、5-FU处理组(P<0.01),说明联合组比单独处理组对细胞的促凋亡作用更显著(见图3)。

注:与空白对照组相比,*P<0.01;与反义miR-345组相比,**P<0.01;与5-FU处理组相比,##P<0.01。图3 各组MGC803细胞凋亡率情况 A:空白对照组;B:无义序列组;C:反义miR-345组;D:5-FU处理组;E:反义miR-345+5-FU联合组;F:各组MGC803细胞凋亡率比较Fig 3 MGC803 cells apoptosis rate in each group A: control group; B: undefined sequence group; C: miR-345 silence group; D: 5-FU group; E: 5-FU combined with miR-345 silence group; F: comparison of MGC803 cells apoptosis rates in each group
3 讨论
5-FU单药或联合用药是胃癌的一线治疗方案,但因患者易对其产生耐药而使总体有效率降低,如何提高其化疗的敏感性是近年来胃癌治疗研究的热点[3]。
近年来的研究关注到,miRNAs在多种肿瘤中表达异常[4-5]。异常表达的miRNAs在胃癌中可能发挥类似癌基因或抑癌基因的作用,并与肿瘤的分化程度、TNM分期、淋巴结转移等密切相关[6]。
miR-345在多种组织的恶性细胞和正常细胞中表达有差异[7-8]。miR-345在不同肿瘤进程中的表达呈不一样的变化趋势。我们前期研究发现,过量表达的miR-345预示着胃癌患者的生存期更短,其抗胃癌机制与上调肿瘤细胞p21cip1进而抑制Rb蛋白的磷酸化有关[9]。进一步研究发现,miR-345沉默联合5-FU能抑制5-FU对MGC803细胞增殖侵袭能力,当5-FU浓度为40 μg/ml时协同作用最为显著。本实验中我们将反义miR-345转染进入MGC803细胞,建立稳定下调miR-345表达的MGC803细胞。随后的克隆形成实验及流式细胞检测提示miR-345沉默联合5-FU能够明显抑制MGC803细胞增殖能力,促进其凋亡。
我们的实验为进一步研究miR-345参与提高胃癌对5-FU化疗敏感性打下坚实基础。而miR-345通过何种途径增强5-FU化疗敏感是我们下一步的研究方向。

