东山湾海马齿生态浮床原位修复效果研究
杨 芳,杨妙峰,郑盛华,林永青,郑惠东,温 凭,李卫林,罗冬莲
(1.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;2.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361102)
福建省东山湾八尺门海域曾是我国最大的网箱养殖基地,由于过度养殖和水交换条件差,残饵、代谢及排泄物、生物残骸等废物大量积累,近年来养殖区海水中氮、磷浓度超标,在不利的气候条件下经常发生大面积的网箱养鱼死亡事故[1],严重制约养殖业的可持续发展。因此,东山湾受损的养殖生境亟待修复。
生态浮床技术具有投资少、工艺简便、管理方便、生态风险相对较低、景观效果好等优点,在以富营养化为主体的污染水体治理中得到了广泛研究与应用[2]。大多数浮床植物因缺乏耐盐机制而应用于淡水环境的治理(如地表水[3]、城市内河[4]、内湖[5]等),海水环境的浮床植物选择极少,海马齿(Sesuviumportulacastrum)因其良好的耐盐特性,在海水环境修复中具有独特的优越性。
海马齿又名滨水菜、滨苋、海马齿苋、滨马齿苋,属于番杏科(Aizonaceae)海马齿属(Sesuvium),是一种生长在海边沙地及河流入海口两岸滩涂地带的多年生肉质草本盐生植物,在全淡水和全海水环境中均能正常生长,具有耐盐碱、耐高温、耐淹、耐旱、耐强光且抗重金属污染等自然特性[6-7],且分蘖繁殖快、移栽易成活、扩繁可控、对污染物修复能力强,是海水环境理想的修复植物。
海马齿具有较强的环境适应性,其结构、生理、分子生物学和蛋白质组学的耐盐[8-14]和耐重金属[15-21]机制研究已有较多报道。实验室条件下,海马齿对海水的氮[22]、磷[23]、悬浮物[24]、重金属[25]和多环芳烃[26]具有良好的修复能力。在实际应用方面,海马齿能够净化半咸水潟湖[27]和养殖池塘的污水,如罗非鱼养殖水缸[28]、石斑鱼工厂化养殖车间[29]、泥蚶实验池塘[30]、对虾养殖池塘[31]、混养池塘[32-34]等。而将海马齿浮床应用于开放海区进行原位修复的研究还未见报道。
基于此,本文通过构建海马齿生态浮床,在东山湾八尺门网箱养殖海区开展原位生境修复研究,分析海马齿在八尺门海区的生长状况及其对碳、氮、磷等元素的去除能力,旨在减轻网箱养殖自身污染,服务海湾环境保护和海水养殖业健康发展,为海马齿修复技术的推广提供基础资料和参考依据。
1 材料与方法
1.1 试验地点
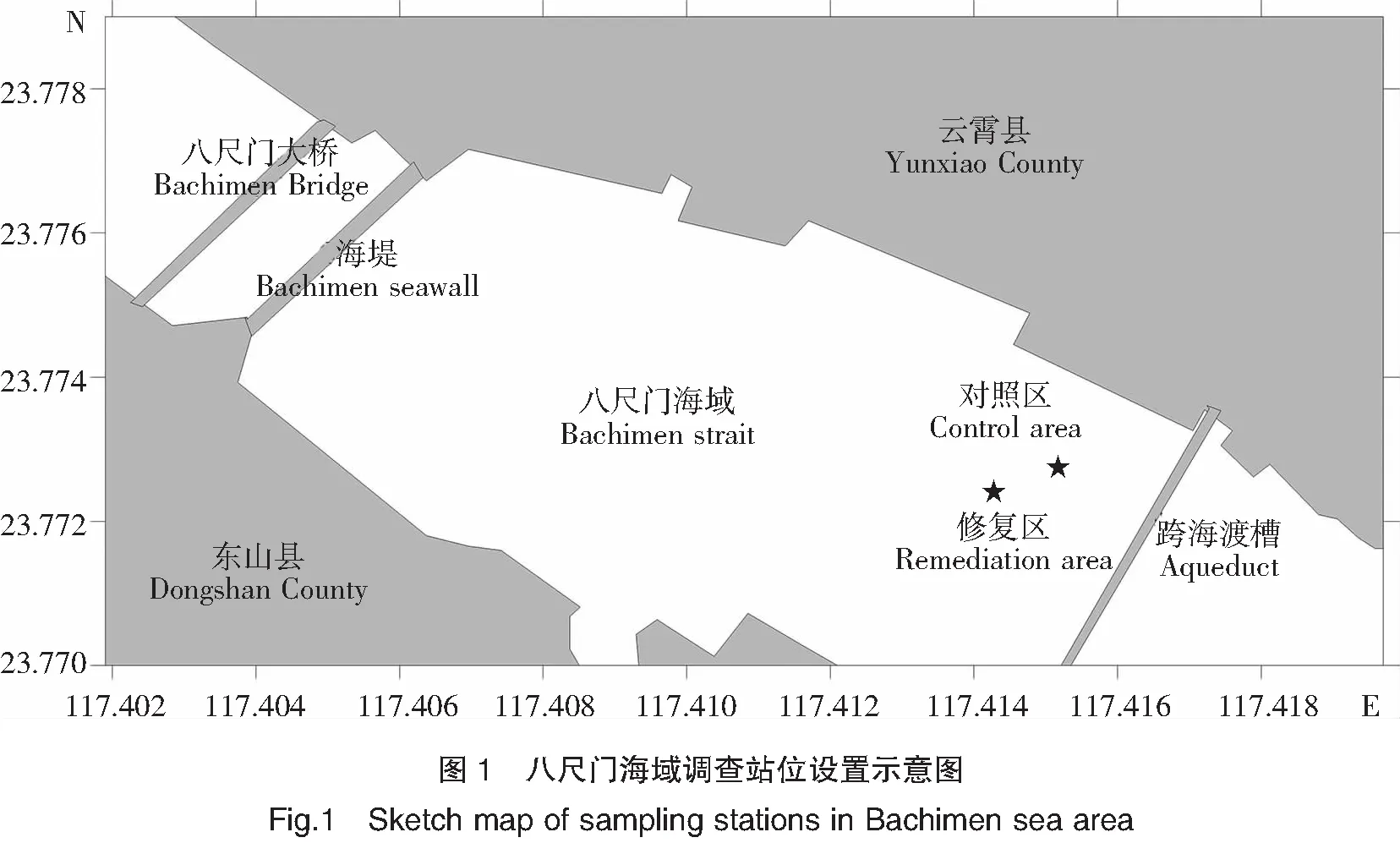
东山湾八尺门,位于福建省漳州市东山县(东山岛)北端,与云霄县陈岱隔海相望。试验地点位于八尺门海堤东侧、跨海渡槽西侧的鱼类网箱养殖海域(图1)。
1.2 试验方法
制作低污染、环保型、高浮力的适用于网箱养殖区的新型生态浮床(单片规格为2.7 m×0.95 m),利用PVC管和泡沫板提供浮力,浮力可达60 kg以上。通过连接绳将多片浮床单体组合后,固定于网箱内。
于2013年5月,在八尺门鱼类网箱养殖海域引种海马齿植株约3 000株,采用扦插的方式将海马齿种苗(株高0.15 ~0.20 m)移植于生态浮床上(株距0.15 m),茎段下部浸没于海水中。
以铺设海马齿浮床的网箱(面积约420 m2)作为修复区,在与潮流垂直(即与跨海渡槽平行)的方向上以无浮床的传统网箱(面积约448 m2)作为对照区。修复区与对照区距离约80 m,均养殖美国红鱼(Sciaenopsocellatus),体重约500 g/尾,每口网箱养殖200尾,采样点如图1所示。修复区和对照区海域东侧由于海堤阻隔,水体交换受阻,淤积严重,水深较小(低潮时仅1.5~2.0 m),悬浮物含量高,透明度低,不利于大型海藻光合作用,而海马齿因有浮床载体支撑,其光合作用不受水体透明度影响。
1.3 测定项目与方法
1.3.1 海马齿生物学及C、N、P含量测定
从海马齿生态浮床定期随机采集海马齿植株30株以上,放入封口袋,带回实验室洗净后测定植株鲜重和C、N、P含量,其中C、N含量用元素分析仪(Elementar Vario EL Ⅲ)进行测定,P含量按照《饲料中总磷的测定》(GB/T 6437-2002)用分光光度法进行测定。
1.3.2 海水水质测定。
于2015年5月(原位修复满2年),分别在浮床修复区(117.414 7°E,23.772 5°N)和对照区(117.415 0°E,23.772 8°N)采集水样进行水质分析。水质采集和样品测定按照《海洋监测规范》(GB 17378.7—2007)和《海洋调查规范》(GB/T 12763-2007)的规定执行。用WTW3430多参数分析仪现场测定水体温度、盐度、pH和溶解氧(DO)。
各化学指标方法:采用重量法测定悬浮物(SS)含量;采用仪器法测定总有机碳(TOC)含量;采用碱性高锰酸钾法测定化学需氧量(COD)含量;采用过硫酸钾氧化法测定总氮(TN)、总磷(TP)含量;采用萘乙二胺分光光度法测定亚硝酸盐氮(NO2-N)含量;采用锌镉还原分光光度法测定硝酸盐氮(NO3-N)含量;采用次溴酸盐分光光度法测定氨氮(NH4-N)含量;采用磷钼兰分光光度法测定活性磷酸盐(PO4-P)含量;采用紫外分光光度法测定石油类(Oil)含量。
去除率的计算公式为:去除率/%=(ρCK-ρp)/ρCK
其中ρCK为对照区海水中各指标的含量,ρp为修复区海水中各指标的含量。
1.4 数据处理
采用Excel 2010软件进行作图。采用SPSS 23统计软件对修复区和对照区的水质数据进行单因素方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 修复植物海马齿的生长状况
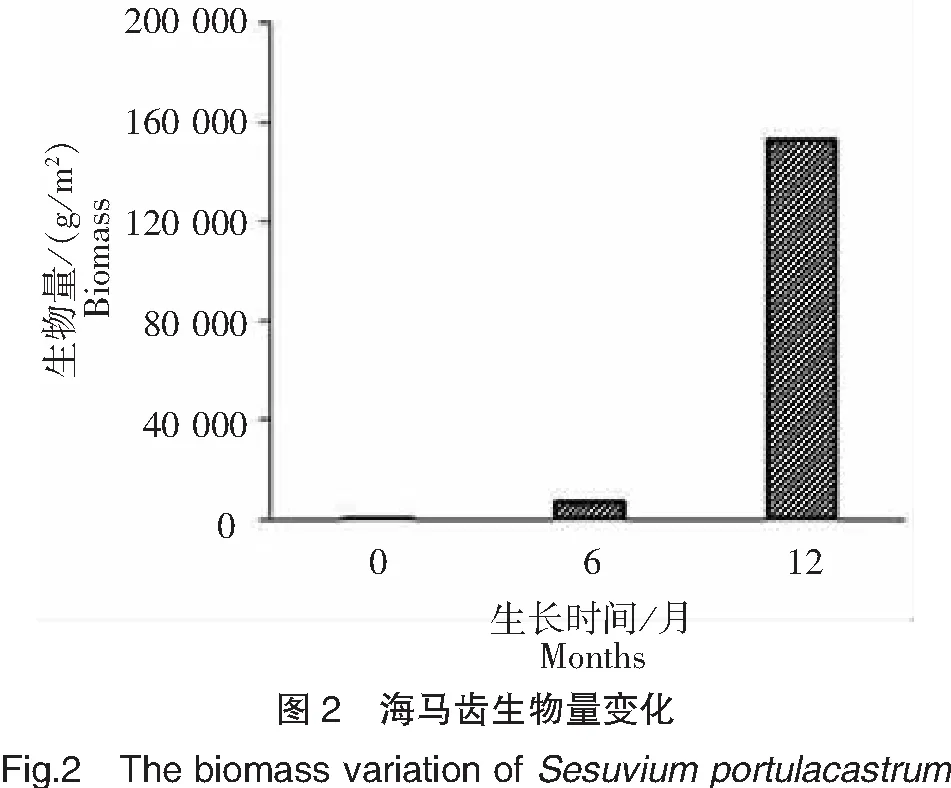
在东山湾八尺门海区合适的水温(5月平均水温25.6℃)、盐度(平均盐度29.5)等环境条件下,海马齿移植成活率为82%。初始平均茎长0.15 m、生物量167.5 g/m2的海马齿生长迅速,扦插后1~2周生出新的根须;1~2个月后长势旺盛,根系渐趋发达;6个月后,海马齿生长可达旺盛期并绽开粉紫色小花,生物量达6 100.0 g/m2,增重35倍。经过一年的生长,海马齿平均茎长1.28 m,平均茎叶重94.2×103g/m2;平均根须长0.52 m,平均根须重58.3×103g/m2;生物量达152.5×103g/m2,增重909倍。养殖区海面上海马齿生态浮床郁郁葱葱,具有良好的景观效益。
2.2 海马齿的C、N、P储量
经测定,海马齿C、N、P元素占干重的百分含量分别为34.19%、2.48%、0.15%;根据生物量测定结果换算,海马齿C、N、P储量如表1所示。经过6个月的生长,海马齿的C、N、P储量增加了35倍;经过一年的生长,C、N、P的储量比初始时增加了909倍,其中茎叶的贡献率占61.8%,根须的贡献率占38.2%。此外,海马齿通过其发达的根系形成巨大的网状结构,可过滤、吸附大量悬浮物质,这部分颗粒物中的C、N、P亦可通过植物收获从养殖生境中移除。

表1 海马齿的C、N、P储量
2.3 海马齿生态浮床对海水水质的原位修复效果
2.3.1 海马齿生态浮床对N、P的去除率
经过两年的原位修复,海马齿浮床修复区海水中各种形态的N、P含量均显著低于对照区(P<0.05),各物质去除率按从高到低的顺序如图3所示。

1)TN、TP、PO4-P
海马齿浮床对TN、TP的去除率分别为11.7%、1.8%。虽然海马齿对TP的去除率较低,但对PO4-P的去除率为9.2%。植物组织及根际微生物吸收、根系滞留、根际周围硝化反硝化作用是植物去除TN的主要途径[35]。养殖水体中磷的去除,一方面以磷酸盐沉降并固结在基质上的形式[36],另一方面通过植物吸收和微生物活动来完成,可溶性磷被植物吸收后从水体中去除,有机物大分子先经过胞外酶(如碱性磷酸酶)的水解作用转化为低分子量化合物后被微生物利用。海马齿根际效应明显,可显著增加根际微生物数量和提高碱性磷酸酶活性[22],加速有机污染物的吸收、转化和降解过程。
2)DIN
浮床对溶解态无机氮(DIN)的去除率达16.7%,其中,海马齿对NH4-N和NO3-N的去除率最高,分别达19.9%和16.4%,对NO2-N的去除效果一般,仅为1.8%。海水中DIN的存在形式主要为氨氮、亚硝态氮和硝态氮,对鱼类产生毒害作用的氮形态主要为游离氨和亚硝态氮盐。当水中的氨氮和亚硝态氮积累到一定程度时,会对鱼类产生毒害作用。而铵态氮和硝态氮是植物生长发育过程中的主要氮源,硝态氮在植物的生长发育周期中发挥着重要作用[37]。除被植物吸收外,铵氮的去除还能通过功能菌的硝化作用合成硝态氮和亚硝态氮,也可少量通过化学平衡转化为氨气挥发到大气中;亚硝态氮和硝态氮则通过反硝化作用转化为氮气和一氧化二氮。
因此,海马齿生态浮床系统可降低水中的NH4-N、NO3-N和PO4-P含量,在一定程度上减轻网箱养殖海区的营养负荷。
2.3.2 海马齿生态浮床对海水其他水质参数的修复效果
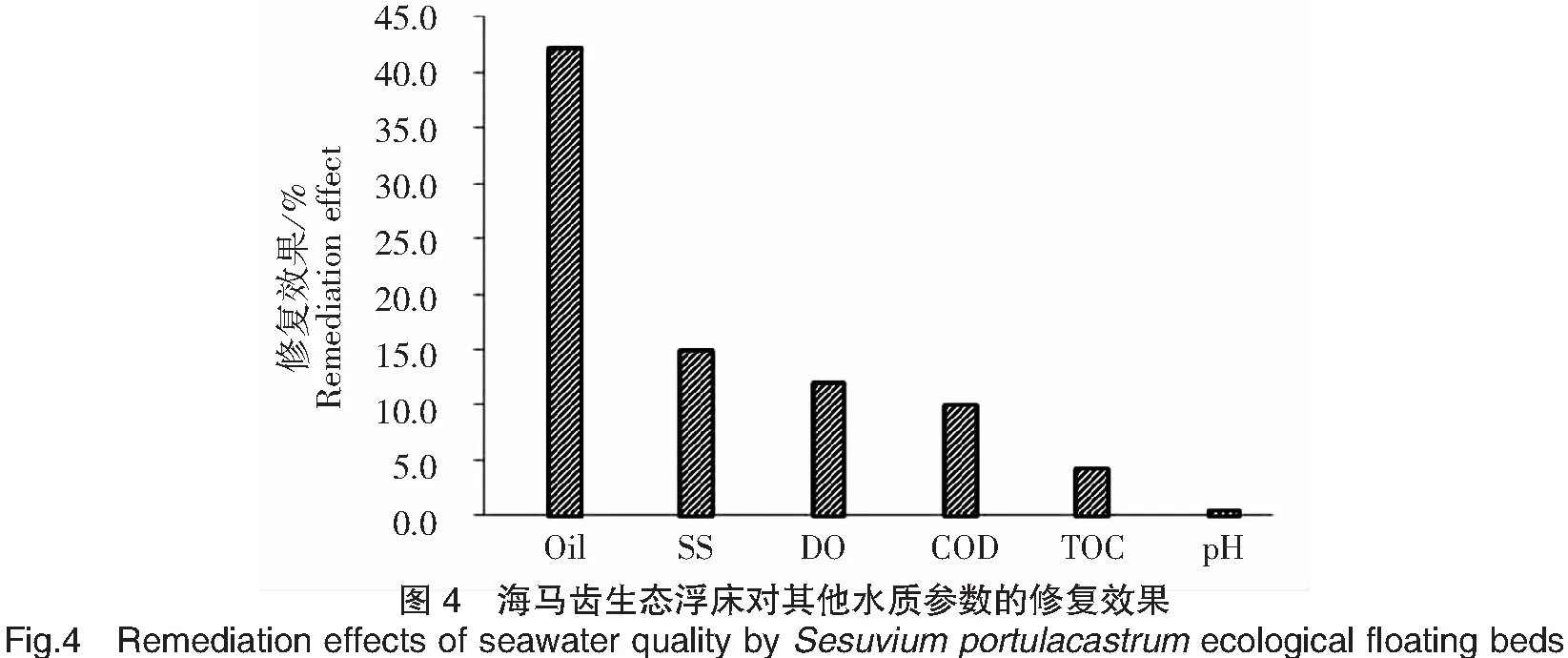
经过两年的原位修复,海马齿浮床修复区海水中的DO、pH均显著高于对照区(P<0.05),Oil、SS、COD、TOC的含量均显著低于对照区(P<0.05),各水质指标净化效果按从高到低的顺序如图4所示。
1)DO
海马齿浮床修复区的DO比对照区高11.9%。水体DO含量与温度、植物根际放氧量、微生物降解有机物消耗的氧以及微生物呼吸作用耗氧量[38]紧密相关。海马齿通过茎叶和根系的气体传输和释放作用,将光合作用产生的氧气或大气中的氧气输送到根区,可提高水体的溶解氧含量,改变根区的氧化还原状况,促进污染物的快速分解或转化。
2)COD
海马齿浮床修复区的COD比对照区低10.0%。COD是检测水质的重要指标,反映水体受有机污染、还原性物质污染的程度[39]。植物对COD的降解主要依靠根区微生物的活动来完成,降解过程受水体温度、DO、水体微生物种类及数量等因素影响,通常以水体中DO<0.20、0.20~1.0和>1.0 mg/L为控制条件,分别发生厌氧、缺氧和好氧降解反应[40]。修复区海水中DO始终大于1.0 mg/L,因此海马齿浮床系统对COD的去除主要为好氧降解作用。
3)TOC
海马齿浮床修复区的TOC比对照区低4.2%。TOC能较全面地反映海水中有机物的污染程度。碳进入海洋主要有两种途径,一种通过海气界面的交换,一种来自陆源、石油开发、工业生产及养殖的排放[41]。通过海马齿浮床系统修复作用,可减少有机物耗氧量和厌氧微生物繁衍的机会,在一定程度上减缓水质恶化进程。
4)pH
与对照区相比,浮床修复区的pH高0.5%。水体pH值变化与植物呼吸作用和根际吸收各种酸碱离子有关[42]。水体pH反映水的最基本性质,可调控水体的弱酸、弱碱的离解程度,降低氯化物、氨、硫化氢等的毒性,防止底泥重金属的释放[43]。由于海水具有缓冲能力,pH变化范围不大。
5)SS
修复区海马齿浮床对SS的去除率为14.9%。高悬浮颗粒物浓度会导致水体混浊度升高,透明度下降,附着在生物体表面的悬浮颗粒物激增,影响水中大型海藻等水生生物正常生长[44]。同时,大量悬浮颗粒物沉积水底,易导致水体发臭,航道阻塞。由于根系形成的密集网膜的物理阻挡,以及植物根系及根际生物的吸附和促沉降作用[45],海马齿根系对海水中的悬浮颗粒物具有较好的清除效果,能使水体悬浮颗粒物浓度提前达到稳定水平[24]。
6)Oil
海马齿浮床对修复区水中Oil的去除率为42.3%。海水环境中石油类来自工业废水(原油开采、加工、运输以及各种炼制油的使用)和生活污水的污染。石油类中所含的芳烃类虽较烷烃类少,但其毒性要大得多。海马齿具有快速、高效地降低海水中菲浓度的能力,植物与微生物共同发挥着重要的作用,但植物积累不是海马齿修复海水菲污染的主要机制,大多数菲可能通过植物代谢或植物挥发途径离开植株[26]。
综上,海马齿生态浮床可提高修复区海水中的DO,并降低海水中的Oil、SS、COD、N、P含量,在一定程度上改善八尺门修复区海水水质。
3 讨论
3.1 海马齿的生长及C、N、P含量
海马齿具有良好的耐盐特性,在盐胁迫下,植株生长旺盛,叶片大而肥厚[46]。在八尺门修复区海水平均盐度29.5的条件下,海马齿能较好生长并完成其生活史,生长旺盛时生物量迅速增加,经过一年的生长可增重909倍。
植物的C、N、P储量主要取决于生物量和C含量。C是构成有机体的基本元素,是整个生物圈物质和能量循环的主体。N是植物生长、发育和繁殖需要的基本物质,在植物生命活动中具有重要作用;N是组成蛋白质的主要元素,占蛋白质总量的16%~18%,而蛋白质是植物体内叶绿素、核酸、植物激素等组成部分。P是构成植物体的重要组成元素,对促进植物的生长发育和生理代谢具有重要作用。一般,P在植物体分布情况为幼嫩器官大于衰老器官、叶片大于根系、根系大于茎杆。海马齿在生长过程中,通过光合作用固定空气中的CO2,并且吸收水中的N、P,随着海马齿生物量的增加,其体内的C、N、P含量不断积累。袁星等[34]研究也显示,随着时间推移,海马齿的C、N、P储量逐渐变大,且与生物量正向相关。
八尺门修复区海马齿对C、N、P储量,均高于已报道的研究结果,原因可能是东山湾八尺门海区的环境条件如温度、盐度、光照、营养物质、空间等更适合海马齿的生长。袁星等[34]报道试验池塘11月浮床区海马齿C储量为39.56 g/m2,N储量为0.77 g/m2,P储量为0.21 g/m2。张志英等[27]报道,浮床种植海马齿对高污染湖泊的水质修复效果明显,氮、磷的月移除量分别可达1.11 g/m2和0.19 g/m2,换算成一周年,则氮、磷的移除量分别为13.32 g/m2和2.28 g/m2。
3.2 海马齿生态浮床原位修复效果
因开放海区海水的流动性和影响因素的复杂性,浮床对TOC、NO2-N和TP的去除效果不理想,本文海马齿生态浮床对养殖生境各项水质指标的去除率,均低于海水养殖池塘和模拟系统的净化效果。据应锐等[47]报道,在海水养殖池塘水体中,4.8 g/L的海马齿种植密度对水质的改善作用最佳,在处理12 d后,对COD、无机磷、铵氮和总氮的去除率分别达到49.0%、20.8%、98.5%和55.9%。窦碧霞等[28]研究发现,在海马齿与罗非鱼养殖水缸模拟系统中,经过2个月的生长,总氮移除率为11%~25%,总磷移除率为41%~68%。李志凌等[29]报道珍珠龙胆石斑鱼与海马齿混养的水泥池中,水体悬浮物浓度较石斑鱼单养下降40.90%,COD下降29.79%。
海马齿生态浮床是基于植物修复原理,通过浮床设施将海马齿移植到可承受其重量的人工载体材料上,海马齿的枝叶生长在空气中,根生长在水里,利用海马齿和根际微生物的协同作用来修复生境。
在海马齿的吸收转化和根际微生物中参与C、N、P等元素的生物地球化学循环的功能菌群的作用下,八尺门养殖海域修复区的NH4-N、NO3-N、COD、PO4-P的去除率分别为19.9%、16.4%、10.0%和9.2%,海水水质得到一定程度的改善。海马齿发达的根系,是水中悬浮物和微生物的良好载体,可增加水体透明度,修复区的海马齿浮床对悬浮物的去除率达14.9%,但在实验室模拟条件下,去除率可达90%以上[24];海马齿通过茎叶和根系的气体传输和释放作用将氧气输送到根区,修复区水体溶氧量比对照区高11.9%;海马齿通过吸收氮、磷等元素来满足其生长需要,经过一周年的生长,海马齿通过自身生长对C、N、P的固定量分别为5 214.0、378.5、22.9 g/m2,通过收获可避免二次污染,真正从源头上减轻网箱养殖海区的营养负荷。收获后的海马齿可作为偶食蔬菜、饲料或药用植物[48-50],其植株富含萜、烯以及挥发性油类物质,临床证明其对发烧、坏血病等病症有很好的疗效[51],因此海马齿具有良好的开发利用前景,有望为其原位修复技术的推广提供经济效益。

