肺原发性肝样腺癌临床病理特征研究
王小拍 刘寿生 杨耀湘 李秀博 杨 静 杜 洪
1 广州市第一人民医院病理科,华南理工大学附属第二医院 (广州 510180) 2 中山大学肿瘤防治中心综合科、华南肿瘤学国家重点实验室、肿瘤医学协同创新中心 (广州 510060)
肝样腺癌(hepatoid adenocarcinoma,HAC)是一种发生于肝外、类似肝细胞癌特征的腺癌。Metzgeroth[1]等发现此肿瘤最常见部位是胃(63%),其他如卵巢(10%)、子宫(4%)和肺(5%)等部位较少见。肺是肝样腺癌发生最罕见的部位之一,目前有关HAL细胞的起源、发生的分子机制及治疗、预后等尚未明确。现对我院收治的1例肺肝样腺癌进行研究分析,并回顾文献对其临床病理特征、免疫表型、诊断及鉴别诊断、基因表达及预后等进行探讨。
1 资料与方法
1.1 研究资料
患者,48岁,男,因反复咳嗽伴劳力性气促1月余步行入院,我院胸部CT示: 双肺散在片状高密度影,双肺多处支气管壁增厚,密度增高,纵膈及右肺门淋巴结肿大。实验室检查: AFP、糖类抗原-724、非小细胞肺癌抗原-211、CA-125及CA-199这些肿瘤标记物均明显升高。B超示肝脏、胆、脾、胃、肾等未见异常。
1.2 方法
1.2.1 免疫组化:采用 EnVision二步法,抗体均购买于广州市安必平医药科技有限公司。所标记抗体分别为AFP、Hepatocyte、Arginase-1、P40、CK5/6、P63、 TTF-1、ALK、CgA、Syn、CD56、PGP9.5和NapsinA。
1.2.2 基因检测:所用的DNA提取试剂及检测试剂均购自厦门艾德生物医药科技股份有限公司。具体方法病理医师进行组织病理学评估,确保至少含有200个肿瘤细胞,用FFPE样品DNA分离试剂盒(离心柱型)提取石蜡切片组织中基因组DNA,操作按产品说明书进行。对提取的DNA进行质量检测,测定DNA纯度及DNA含量。使用人类EGFR、ALK/ROS1、KRAS、BRAF基因突变检测试剂盒按照说明书进行基因突变分析。
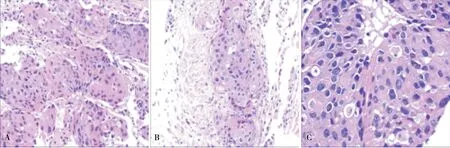
图1 肿瘤细胞形态A 肿瘤细胞呈巢团状排列,肿瘤间质少(200×);B 肿瘤细胞呈腺泡状排列,灶区可见腺腔(200×) C 肿瘤细胞异型性明显,癌细胞核大、深染不规划,胞浆丰富、嗜酸性,可见病理性核分裂像(400×)
2 结 果
2.1 镜检
镜下癌细胞呈实性片巢状或腺泡状排列,灶区可见腺腔结构,癌细胞核大深染不规则,胞浆丰富嗜酸,可见小核仁及病理性核分裂像,似肝细胞癌,无鳞状细胞癌分化区域。癌细胞间质少,部分区域中间见小片状坏死、局部可见血窦样间质(图1)。
2.2 免疫组化
癌细胞AFP少部分胞浆强阳性,Hepatocyte大部分膜强阳性,Arginase-1核弱阳性(图2),P40、CK5/6、P63、 TTF-1、ALK、CgA、Syn、CD56、PGP9.5和NapsinA均阴性。
2.3 基因检测
ARMS-PCR法均未检测到EGFR(外显子18、19、20、21)、ALK(EML4-ALK)/ROS1 (SLC34A2-ROS1,CD74-ROS1,SDC4-ROS1,EZR-ROS1,TPM3-ROS1,LRIG3-ROS1,GOPC-ROS1)、KRAS (外显子2、3、4)和 BRAF(V600E)基因突变。
2.4 随访: 随访3个月后失联。
3 讨 论
HAC是一种原发于肝外的具有肝细胞癌形态特征及免疫表型的腺癌。自1990年Ishikura等[2]首先提出HAL,目前英文文献不超过30例,中文报道约5篇。我们从组织起源、临床病理特点、免疫表型、基因突变、诊断及治疗等方面对HAL进行详细讨论,以提高对该少见肿瘤的认识。
3.1 组织起源
目前多数学者认为胚胎发育过程中由于分化过程的失常,肺等组织器官发生的某些腺癌可能向肝细胞方向分化[3]。这类腺癌可产生正常肝细胞及肝细胞癌的一些产物, 如α-抗胰蛋白酶(AAT)、铁蛋白、AFP等[4]。
3.2 临床特点
回顾相关文献(表1),HAL大部分有吸烟史,中位年龄约为60岁,男性居多,所报道的病例中只有3例为女性[5-7],男女比例约为10:1。发病部位以肺上叶居多,左右肺无明显差别。肿瘤体积一般较大,最大径可达14 cm,且多在5.0 cm以上。HAL临床症状与其他肺癌相似,可表现为咳嗽咳痰、咯血,严重者可以出现呼吸困难。大部分病例血清AFP可升高,最高可达19 000 ng/mL,可能与肿瘤活动相关,AFP在肿物切除后往往下降[8]。
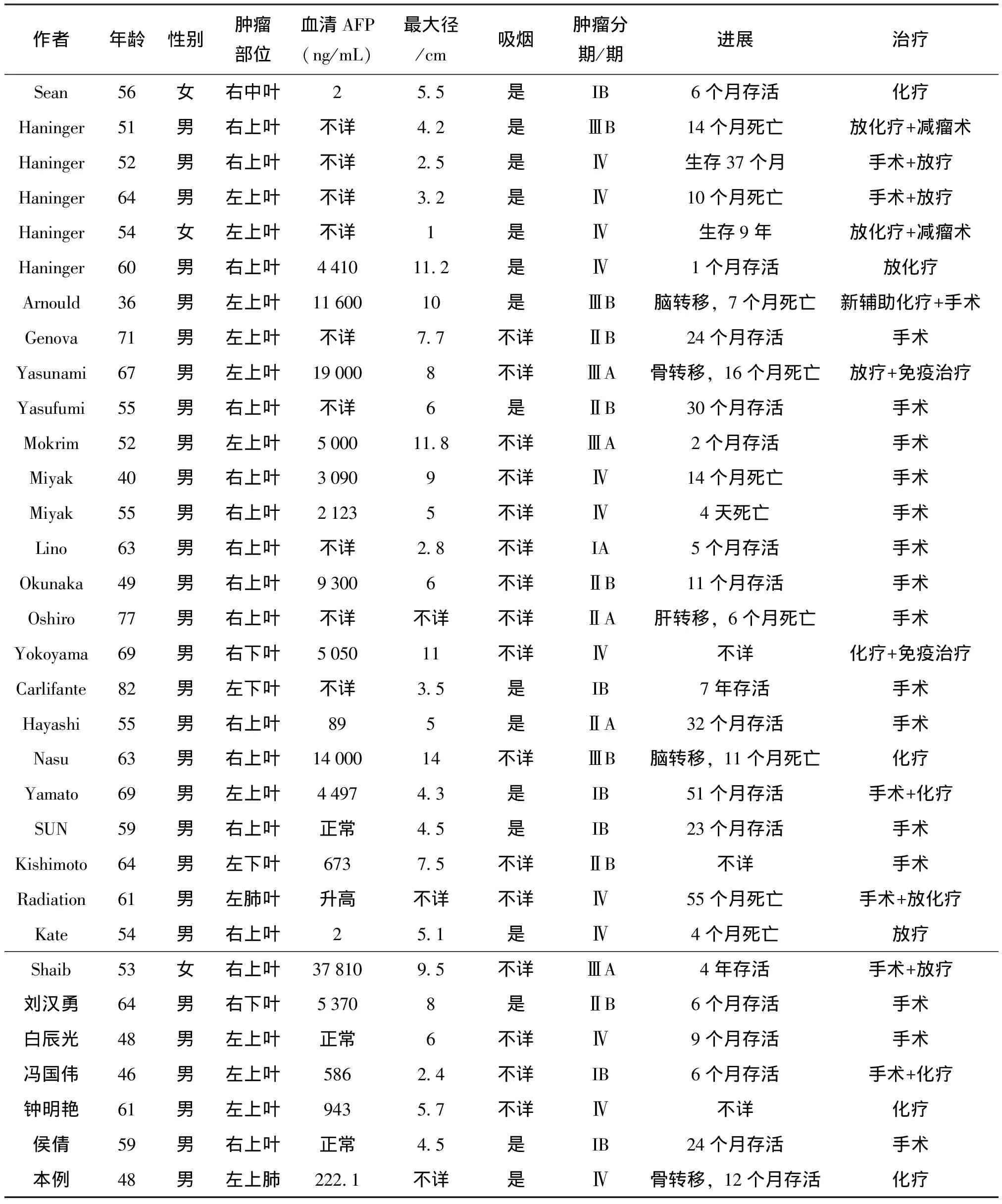
表1 回顾文献报道的肺肝样腺癌临床病理资料总结
3.3 病理形态学特点
镜下肿瘤细胞可分为肝样分化区和非肝样区,肝样分化区呈巢团状或筛孔状排列,癌细胞体积较大,胞界清楚,胞质丰富、嗜酸或透明,核大深染不规则,可见小核仁。间质可出现较多血窦,并可出现坏死[9]。非肝样分化区可见腺样、乳头状或实片状,有些病例癌细胞见脂肪变性、胆汁分泌、印戒样细胞或神经内分泌分化[5]。本例镜下形态主要为肝样分化区,灶区可见小腺腔,无其他特殊类型的分化。
3.4 免疫组化
AFP升高或免疫组化表达有助于HAL的诊断,但少部分HAL不表达AFP;Heptocyte 在多数肝样腺癌中都有不同程度表达,是一个比较有价值的标记物[10]。Arginase-1在正常和肝细胞癌中均表达,相比较Heptocyte而言,是诊断肝细胞癌更敏感和更特异的指标。Haninger[5]等报道了5例HAL TTF-1均阳性,1例NapsinA阳性,因此TTF-1或NapsinA阳性不能排除HAL的可能。本研究中瘤细胞AFP、Heptocyte及Arginase-1均阳性,TTF-1、NapsinA均阴性,与文献报道部分结果类似。
3.5 诊断与鉴别诊断
2013年Haninger[5]等提出HAL的诊断标准:①AFP或其他肝细胞分化标记物可以为阴性;②癌细胞可以是单纯肝样腺癌或伴有腺泡或乳头状、印戒细胞或神经内分泌癌等分化;③具有肝细胞癌形态特点但AFP不升高的腺癌称为AFP阴性的HAL。因此HAL的诊断主要依赖形态学特征,同时需结合影像排除转移的可能及免疫组化AFP、Heptocyte等检测结果综合判断。
鉴别诊断:①首先是区分是原发还是转移,原发性肝细胞癌: 一般有肝炎病史,影像提示肝内有肿物;肝细胞癌一般不出现乳头状结构,也不会伴有神经内分泌及肠型分化;②肺普通类型腺癌: 当HAL伴有腺样分化或低分化腺癌呈实体状排列时需鉴别,免疫组化一般不表达AFP、Hepatocyte及Arginase-1等。③低分化鳞癌: 免疫组化标记P40、P63及CK5/6阳性。④肺大细胞癌: 本例免疫组化腺鳞标记均为阴性,最初考虑为大细胞癌或低分化腺癌,后面结合血清AFP升高及免疫组化AFP、Hepatocyte等指标阳性做出HAL的诊断。⑤生殖细胞肿瘤: 如卵黄囊瘤血清AFP可升高,本例形态上未出现卵黄囊瘤样结构等,影像学检查生殖系统亦未见肿瘤,免疫组化亦可帮助排除。
本例镜下癌细胞呈实性片巢状排列,胞浆丰富嗜酸,似肝细胞样,血清AFP升高,免疫组化结果AFP、Heptocyte及Arginase-1均阳性,患者无肝炎病史,除肺以外肝脏等其他器官未见肿物,因此符合HAL的诊断。
3.6 基因突变分析
目前对HAL的基因改变情况,鲜有报道。Sean[11]等报道1例HAL发生ALK基因断裂重排;Gavrancic[12]等报道1例HAL为EGFR野生型。本例运用ARMS法均未检测到EGFR、ALK/ROS1、KRAS 和 BRAF基因突变。
3.7 治疗与预后
文献报道中(表1)HAL以手术治疗为主,部分结合放化疗或免疫治疗。HAL易发生转移及广泛静脉侵犯,其治疗方法也同普通的肺腺癌不同[13]。文献中1例HAL中发现ALK基因断裂重排,使用克唑替尼治疗,六个月后肿瘤进展而停止使用[11]。1例EGFR野生型HAL,运用卡铂/紫杉醇+索拉菲尼的化疗及总剂量30 Gy的放疗方案,2个疗程后部分缓解,3个月后发生进展,病人从诊断到接受治疗过程中存活了11个月[12]。最新文献报道,即使HAL不表达PD-L1,抗PD-L1 Durvalumab治疗也有一定的反应[14]。因病例数较少,HAL基因表达谱及靶向治疗效果如何有待进一步探讨。
回顾文献中大部分死亡的病例分期较晚,主要为Ⅲ和Ⅳ期患者,易转移到脑、骨及肝,还有少见的1例转移到扁桃体[15]。其中有10例患者在诊断后4天~55个月后死亡,但也有存活4年和9年的病例[5-6],且这两名患者均为女性病人,性别差异是否是预后的影响因素可能需进一步探讨。还有研究者报道AFP升高的HAL预后较差[8]。本例患者放弃了后续治疗,随访3个月后失访。
综上所述, HAL是一种较罕见的特殊亚型肺腺癌,有其独特的临床病理特点,诊断的前提首先要排除转移,同时结合形态上肿瘤细胞具有肝样分化,大部分患者血清AFP值升高,免疫组化指标AFP、Heptocyte等阳性。目前WHO尚未对该肿瘤明确分型,治疗方式和预后亦尚未完全统一。目前治疗方式仍以手术为主,辅以放化疗,靶向及免疫治疗效果尚未明确。总结相关文献提示HAL临床进展相对较快,预后相对较差,临床及病理医师对该肿瘤应给予高度重视。本研究中首次对HAL进行EGFR、ALK/ROS1、KRAS 和 BRAF基因检测,均未发现突变,随着分子检测和免疫治疗的发展,个体化的精准治疗可能也是未来探索研究的方向。

