二甲双胍对2型糖尿病大鼠胆汁酸代谢FXR-MAFG-CYP8B1信号通路的影响
李萌思雨,胡晓文,徐业秋,胡晓琳,张春雪,逄曙光,
(1 济南大学 山东省医学科学院医学与生命科学学院,济南250013;2 山东大学附属济南市中心医院)
2型糖尿病(T2DM)主要表现为糖脂代谢紊乱,胆汁酸(BA)作为糖脂代谢的重要信号分子,其主要通过BA受体(FXR)介导的多种信号通路发挥重要的生理作用[1]。BA既是肝脏胆固醇分解代谢的主要途径,又能促进肠道膳食脂肪的吸收。BA激活FXR后,可抑制甾醇调节元件结合蛋白的表达,进而改变脂类代谢相关基因的表达;能够诱导过氧化物酶体增殖物激活受体α的表达,进而促进脂肪酸氧化[2];还能够降低磷酸烯醇式丙酮酸羧激酶和葡萄糖-6-磷酸酶的表达,从而抑制糖异生[3]。胆固醇通过经典途径和替代途径合成BA。经典途径是BA合成的主要途径,合成大约等量的胆酸(CA)和脱氧胆酸(CDCA);胆固醇7α羟化酶(CYP7A1)是经典途径的限速酶,而胆固醇12α羟化酶(CYP8B1)可以催化CDCA向CA转化[4]。最近研究表明,V-Maf肌肉腱膜纤维肉瘤癌基因同源物G(MAFG)是FXR的靶标,是BA合成和代谢的关键转录抑制因子[5]。研究显示MAFG降低肝脏中CYP8B1的转录水平[5,6]。由此可见,FXR-MAFG-CYP8B1信号通路在BA代谢中具有重要作用。研究发现,糖尿病大鼠的BA池增大,而胰岛素治疗能够降低BA池的大小、抑制CYP7A1、CYP8B1活性,并改变BA的组成[7]。二甲双胍可以降糖降脂,该作用是否通过影响BA代谢发挥作用尚未可知。2017年12月~2018年10月,我们观察了二甲双胍对T2DM大鼠FXR-MAFG-CYP8B1信号通路的影响,从胆汁代谢通路探讨其治疗糖尿病的机制。
1 材料与方法
1.1 实验动物与主要试剂 60只雄性Wistar大鼠,8周龄,体质量200~250 g,购自北京维通利华实验动物技术有限公司;将动物于(23±2)℃、12 h光照/黑暗循环环境下常规喂养,实验操作符合实验动物伦理委员会要求。FXR抗体购自Biorbyp公司;CYP8B1、MAFG抗体购自Abcam公司;PVDF膜(0.2 mm)、ECL检测试剂盒购自Millipore公司;链脲佐菌素(STZ)购自Sigma公司;盐酸二甲双胍购自中美上海施贵宝制药有限公司;CA ELISA试剂盒购自上海通蔚生物有限公司;TRIzol、RNA抽屉试剂、反转录反应和实时荧光定量PCR反应试剂盒购自TaKaRa公司。血糖仪、Cobas8000自动生化分析仪购自罗氏公司;胰岛素ELISA试剂盒购自Mercodia公司。
1.2 实验方法
1.2.1 动物分组与造模干预 将60只大鼠适应性喂养1周后,随机分为3组各20只。对照组喂食标准饮食(6%脂肪,64%碳水化合物,23%蛋白质),模型组、干扰组喂食高脂饮食(25%脂肪,48%碳水化合物,20%蛋白质)。喂养10周后,模型组、干扰组腹腔注射小剂量STZ 30 mg/kg诱导T2DM模型,对照组腹腔注射等量生理盐水。STZ注射后72 h,模型组、干扰组用血糖仪测量空腹血糖(FBG)≥11.1 mmol/L,成功建立T2DM模型。干预组给予二甲双胍500 mg/(kg·d)灌胃,其余两组给予等量生理盐水灌胃,连续干预12周。
1.2.2 一般情况观察及标本收集 每天早晨观察大鼠精神状态,记录并计算32周龄时与入组时食物摄入量、水摄入量和体质量变化。在32周龄时禁食过夜,眶后静脉丛取血,分离血清后-80 ℃冰箱保存;脱颈处死后剖腹取出肝组织,置于液氮中冷冻。
1.2.3 血清糖脂代谢指标及BA检测 取静脉血清,使用Cobas8000自动生化分析仪检测总胆固醇(TC)、总甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、BA,用血糖仪测FBG,用ELISA试剂盒检测空腹胰岛素(FINS)。胰岛素抵抗指数(HOMA-IR)=[FBG(mmol/L)×FINS(μU/mL)]/22.5。
1.2.4 肝组织FXR、MAFG、CYP8B1 mRNA检测 采用实时荧光定量PCR法。使用TRIzol试剂提取肝脏总RNA,在紫外分光光度计下读取A260/A280值。用TaKaRa两步法反转录试剂盒将RNA样品反转录为cDNA,按照PCR反应液配比说明书配成20 μL反应体系。反应条件:预变性95 ℃ 30 s;PCR反应95 ℃ 5 s,60 ℃ 34 s,共40个循环;解离95 ℃ 5 s,60 ℃ 1 min,95 ℃ 15 s。反应中所用引物序列:FXR正向5′-AAGTGACCTCCACGACCAAG-3′,反向5′-TGGCATTCTCTGTTTGCTGT-3′;MAFG正向5′-CCCAATAAAGGAAACAAGGCC-3′,反向5′-GCACCGACATGGTCACCA-3′;CYP8B1正向5′-TCCATATGTCCCGGCAGGTTCTTT-3′,反向5′-TGTCAGGGTCCACCAGTTCAAAGT-3′;β-actin正向5′-GGAGATTACTGCCCTGGCTCCTA -3′,反向5′-GACTCATCGTACTCCTGCTTGCTG-3′。每组设3个复孔,以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。
1.2.5 肝组织FXR、MAFG、CYP8B1蛋白检测 采用Western blotting法。制备大鼠肝脏匀浆,4 ℃下以10 000 r/min离心10 min;收集上清液,BCA测定总蛋白质浓度。加入4×上样缓冲液(蛋白质与蛋白质上样缓冲液比例为4∶1),将混合物在100 ℃水中煮沸8 min。将等量蛋白质加载至12% SDS-PAGE上,再转移到PVDF膜上。将膜在PBST/5%脱脂奶粉中封闭,4 ℃下与针对FXR、MAFG、CYP8B1、β-actin的一抗孵育过夜。用磷酸盐缓冲液和0.05% Tween-20(PBST)洗涤后,将与HRP缀合的二抗于室温下孵育4 min。去除二抗后,使用ECL试剂盒洗涤印迹,在自动凝胶成像分析系统上成像。以Image J图像处理软件计算目的蛋白与内参光密度比值,以此表示目的蛋白的相对表达量。
1.2.6 肝组织CA检测 采用ELISA法。称取1 g肝组织样品,加入9 g PBS(pH 7.2~7.4)并搅匀。以2 000~3 000 r/min离心20 min,收集上清液。将一部分包装进行测试,其余部分冷冻备用。用ELISA试剂盒检测CA,按说明书操作。

2 结果
2.1 各组大鼠一般状况比较 实验过程中,对照组一般状态好,饮食、饮水、体质量无明显改变;模型组消瘦,毛色杂乱,精神萎靡,饮食、饮水量增加;干扰组给予二甲双胍干预后症状较模型组好转。与对照组比较,模型组和干扰组体质量减轻,饮食和饮水增加(P均<0.05);与模型组比较,干扰组二甲双胍治疗后体质量、饮食和饮水均减少(P均<0.05)。见表1。
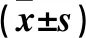
表1 各组大鼠体质量、饮食、饮水变化
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
2.2 各组血清糖脂代谢指标及BA水平比较 与对照组比较,模型组FBG、FINS、HOMA-IR、TC、TG、LDL-C、BA水平均升高而HDL-C水平降低(P均<0.05)。与模型组比较,干扰组FBG、FINS、HOMA-IR、TC、TG、LDL-C、BA水平均降低而HDL-C水平升高(P均<0.05)。见表2。
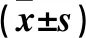
表2 各组血清糖脂代谢指标及BA水平比较
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
2.3 各组肝组织FXR、MAFG、CYP8B1 mRNA及蛋白表达比较 与对照组比较,模型组肝组织FXR、MAFG表达下调而CYP8B1表达上调(P均<0.05);与模型组比较,干扰组肝组织FXR、MAFG表达上调而CYP8B1表达下调(P均<0.05)。见表3。
2.4 各组肝组织CA比较 对照组、模型组、干扰组肝组织CA分别为(442.58±86.18)、(1 208.90±127.21)、(620.98±35.48)ng/mL,模型组>干扰组>对照组(P均<0.05)。
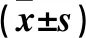
表3 各组肝组织FXR、MAFG、CYP8B1表达比较
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05。
3 讨论
T2DM是与血脂异常和胰岛素抵抗相关的炎性疾病。在本研究中,我们通过给予高脂饮食喂养和小剂量STZ注射建立了T2DM大鼠模型。据报道,高脂饮食喂养引起胰岛素抵抗,STZ对胰岛β细胞有毒性作用。当注射大剂量STZ时,可破坏大多数胰岛β细胞以诱导T1DM模型;而注射小剂量STZ可用于制备T2DM模型,表现出血糖升高及胰岛素抵抗[8]。本研究结果表明,干预组T2DM大鼠经二甲双胍治疗后体质量减轻且饮食、饮水量均减少,同时FBG、FINS、HOMA-IR、TC、TG、LDL-C水平均降低而HDL-C水平升高,临床症状、糖脂代谢、胰岛素抵抗均得到改善;此外,干预组经二甲双胍干预后BA也明显下降。因此,我们推测二甲双胍改善糖脂代谢的作用可能与影响BA代谢有关。
在肝内由胆固醇直接合成的BA称为初级BA,初级BA进入肠道由肠道菌群催化合成次级BA[9]。肝脏产生的BA进入肠道后,95%会被肠道重吸收,这些重吸收的BA随门静脉再次进入肝脏,肝脏再将其与新合成的BA一起进入肠道,即“肝肠循环”。经典途径是BA合成的主要途径,该过程主要依靠CYP7A1来发挥作用。生理浓度的BA结合并激活FXR,FXR通过诱导小异二聚体伴侣(SHP)下调CYP7A1的表达[5],从而负反馈抑制BA合成。本研究结果显示,与对照组比较,模型组肝组织中FXR表达减少,与相关研究结果一致[10]。T2DM大鼠FXR表达降低的具体机制尚不清楚,可能与糖尿病大鼠BA池的改变有关。CDCA是最有效的FXR激活配体,糖尿病大鼠BA库中CA和脱氧胆酸(DCA)增加而CDCA减少[11],对FXR激活作用降低。MAFG作为FXR激活介导的转录阻遏物[6],当糖尿病大鼠FXR表达降低时,MAFG表达也降低,同时MAFG抑制其下游基因的表达。在BA合成途径中,CYP8B1负责CA合成[7]。研究发现,在STZ诱导的糖尿病大鼠中,CYP8B1表达升高[12]。这是由于MAFG在糖尿病大鼠中表达降低,减弱了对CYP8B1的抑制作用使得CYP8B1表达增加,致使糖尿病大鼠CA升高。与我们的实验结果相一致,即模型组CA浓度高于对照组。
本研究结果显示,二甲双胍治疗后干扰组大鼠FXR和MAFG表达增加而CYP8B1表达降低。这表明二甲双胍可以通过活化腺苷酸活化蛋白激酶(AMPK),使得FXR磷酸化[13],受FXR激活的MAFG表达增加,对CYP8B1的抑制作用增强,因而CYP8B1表达降低。丙酮酸激酶(PEPCK)和葡萄糖6磷酸酶(G-6-PASE)是参与糖异生的限速酶。研究表明,FXR抑制PEPCK和G-6-PASE的活性,阻碍糖异生过程,从而改善葡萄糖耐量[14]。固醇调节元件结合蛋白(SREBP-1c)是调节胆固醇代谢和甘油三酯合成的关键酶。研究发现,FXR诱导SHP的表达后,与肝X受体(LXR)结合后抑制SREBP-1c的表达,进而降低胆固醇和甘油三酯合成[15]。此外,MAFG作为FXR的下游因子发挥其共调节作用,参与FXR的降低糖脂作用以调节体内糖脂平衡[5,6]。
BA合成途径的直接产物主要是CA和CDCA,它们的相对量之间的平衡决定了BA池的总体疏水性[16]。CA和CDCA之间平衡的主要调节剂是CYP8B1,CYP8B1确定了12α-羟基化BA和非12α-羟基化BA的相对量。CA是肝组织中含量最丰富的12α-羟基化BA。Kim等[14]研究表明,人胰岛素抵抗与血清12α-羟基化BA水平升高有关。Kaur等[7]发现,CA的缺乏导致CYP8B1缺陷小鼠的胰岛素抵抗改善。本研究结果显示,干预组肝组织中CA表达减少,HOMA-IR降低,胰岛素抵抗明显改善。这是由于二甲双胍抑制CYP8B1表达后降低CA表达,促进血清12α-羟基化BA表达,从而改善了胰岛素敏感性[18];同时,CA的减少也降低了胆汁中胆汁盐的疏水性,降低胆固醇的溶解度[19],从而减少胆固醇的吸收。因此,我们认为二甲双胍可以通过调节FXR-MAFG-CYP8B1信号通路来干扰BA代谢,从而改善糖脂代谢和胰岛素敏感性,这对进一步探索二甲双胍的新药物靶点具有重要意义。

