K282合金的高温氧化行为研究
孙德山,肖 旋,王常帅,周兰章
(1.沈阳理工大学 材料科学与工程学院,沈阳 110159;2.中国科学院金属研究所,沈阳 110016)
当今,火力发电量约占我国总发电量的70%,大规模的火力发电带来了巨大的环境和能源问题[1]。应对环境和能源问题,提高燃煤发电的效率,节能减排,已成为各国共识[2]。为此,世界各国相继将700℃超超临界燃煤发电技术列为重点研究项目。700℃超超临界机组要求其服役部件700℃/105h持久强度不小于100MPa,同时具有良好的烟气侧抗煤灰腐蚀性能及蒸汽侧抗氧化性能等[3-4]。
汽缸和阀壳是汽轮机中重要的高温承压部件,因具有尺寸大、几何形状复杂等特点,一般选用铸件[5]。目前,大型高温合金铸件制造技术在国内基本属于空白,国外虽然进行了较多研究[6],但技术还不成熟,铸件性能数据均未公布。Haynes282合金是一种具有优良的加工性能、焊接性能、耐腐蚀性能和抗氧化性能的镍基高温合金,作为700℃超超临界机组候选材料之一[7-8],为满足高性能阀体铸件要求,本课题组在Haynes282的成分之上研发一种新型铸造合金—K282合金。作为超超临界机组阀体材料,要求有良好的抗高温氧化性能[9]。本文对K282合金氧化行为展开研究,通过对比研究铸造K282合金在不同温度下的氧化行为,分析合金元素及氧化产物在氧化过程中的作用,并探讨合金的氧化机理,为合金的工程应用提供实验基础与理论依据。
1 实验方法
在真空感应炉中熔炼、重熔、熔模浇注 K282合金试棒(成分见表1)。将铸造试样线切割并用磨床打磨,制成 10mm×10mm×3mm 的尺寸,再经 2000#SiC 水砂纸打磨,测量试样尺寸,用丙酮和酒精清洗后,干燥,放在密封袋内备用。每组试样选3个,将试样置于预烧至恒重的Al2O3坩埚内,试样与坩埚壁保持线(点)接触,将坩埚和试样一起称重;然后将试样与坩埚放入箱式电炉(控温精度为±2℃)中进行700℃、800℃和900℃恒温氧化实验。氧化一定时间(1h,3h,5h,10h,25h,50h,100h,150h,200h)后,冷却1.5h。使用DTA-100电子天平(感量0.1mg)称重,最终实验值为三个试样的平均值。选取典型的试样(1h,100h,200h),利用配有EDS能谱的TESCAN MAIA3型场发射扫描电镜进行组织形貌观察和成分分析,Rigaku D/MAX 2500型X射线衍射仪进行氧化物的物相分析。

表1 K282合金成分 wt%
2 试验结果与讨论
图1为K282合金在 700℃、800℃和900℃静态空气中的恒温氧化动力学曲线。
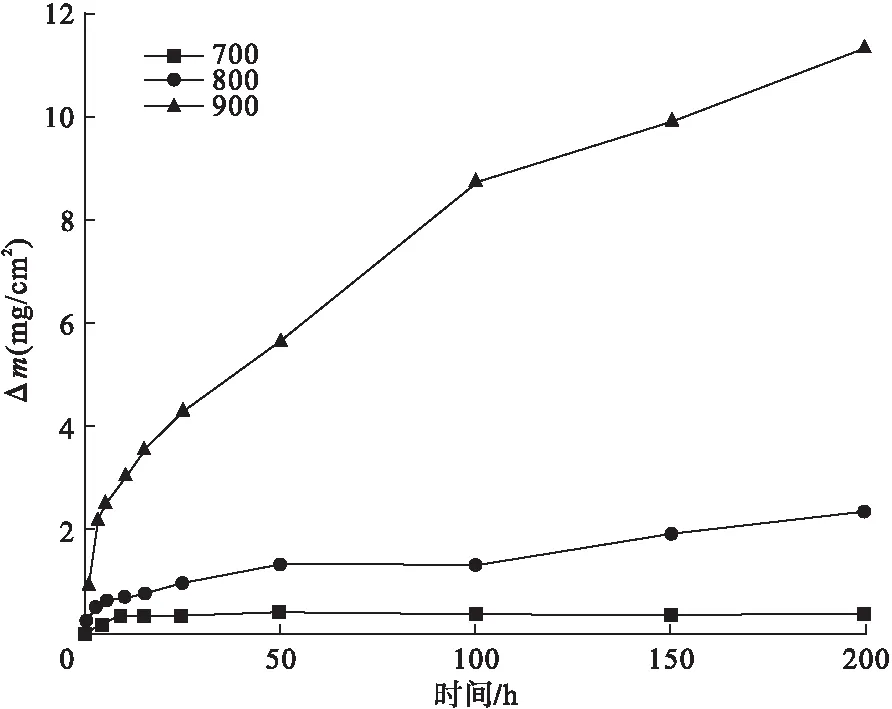
图1 恒温氧化增重曲线
从图1中可以看出,700℃氧化,仅在初期增重较快,后期氧化增重速率下降,增重量变化十分缓慢,不符合抛物线规律。800℃和900℃曲线近似于抛物线;800℃时增重总体水平较低,初期有较快的增重,而后期增重速率较缓。900℃时氧化初期迅速增重,后期氧化增重速率变缓,但与800℃氧化增重曲线相比,仍保持较高的增重速率。总体来看,温度越高增重越明显。
在氧化动力学研究中,一般根据公式(1)所描述的抛物线规律对氧化数据进行拟合[10]。
(Δm)2=kpt
(1)
式中:Δm为单位面积的氧化增重,mg/cm2;kp为抛物线速率常数(氧化速率常数),mg2/cm4/h;t为氧化时间,h。图2为K282合金在800℃和900℃静态空气中的恒温氧化(Δm)2与t拟合曲线。由图2a可知,在氧化初期,800℃拟合曲线与实际值吻合较好,而到氧化后期与实际值有所偏离,但趋势上一致,说明800℃合金氧化规律也为抛物线规律。由图2b可知,900℃拟合曲线与实际数值吻合程度较高,证明900℃氧化规律为抛物线规律。
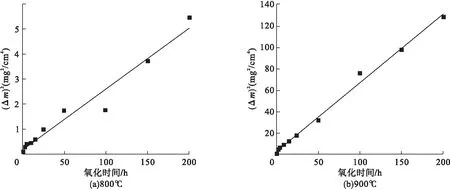
图2 不同温度下(Δm)2与t拟合曲线
图3为高温氧化产物XRD谱线。图3a为700℃氧化200h时氧化产物的XRD谱线,此时样品表面形成的氧化物为Cr2O3,氧化产物单一;Cr2O3在高温下很稳定,而且在其中金属离子的自扩散系数非常小,在众多氧化物中是一种具有较强的抗氧化性能的氧化物[11]。由图3b和3c可知,800℃和900℃氧化1h时氧化产物为Cr2O3;100h后氧化产物为Al2O3、Cr2O3和TiO2;900℃氧化200h时TiO2和Cr2O3的峰值接近,而800℃氧化时TiO2的峰值较Cr2O3的峰值比低很多,说明900℃氧化膜中TiO2的含量较高。与图3a相比,800℃和900℃下不再仅是Cr元素发生氧化反应,Ti和Al也参与到氧化反应中,形成TiO2和Al2O3。Al2O3和Cr2O3类似,也是一种抗氧化性能较好的氧化物,而TiO2是易发生氧化失稳的氧化物(及易从抛物线规律向直线规律转变)。

图3 不同温度和时间氧化产物的XRD谱线
高温氧化过程中,吸附在样品表面的氧气在高温作用下与金属元素发生反应,在短时间内迅速形成一层氧化膜,之后在氧化膜两侧,氧原子和金属原子发生电离形成氧离子和金属离子,并在氧化膜中向相反方向扩散,在界面处形成氧化物[12]。形成氧化膜后氧化反应的发生主要由三个过程控制。
(1)大气气氛中的氧扩散到氧化层表面并发生物理吸附。
(2)氧分子在氧化层表面变成氧负离子,进入氧化层,同时基体中的金属原子在基体与氧化层的界面上发生电离,形成金属离子,最后在大气与氧化膜或氧化膜和基体的界面出发生反应。
M2++O2-= MO
(2)
(3)一定流量的金属阳离子和氧负离子在氧化膜中迁移,保证反应(2)的持续进行。整个氧化过程的速度取决于三个过程中最慢的那个过程。
本实验在大气气氛下高温环境中进行,过程(1)和(2)能够迅速完成,反应速度主要取决于过程(3)。700℃氧化过程中,在开始阶段,形成一层致密的Cr2O3氧化层,此后,由于700℃时氧化层中金属离子和氧离子扩散量很少,导致短时间内反应非常缓慢,因此700℃氧化反应后期增重非常缓慢。在800℃和900℃氧化过程,Ti和Al元素加入氧化中,致氧化增重明显。
图4为700℃氧化后表面形貌。

图4 700℃高温氧化后表面形貌
700℃暴露1h,在表面有少量块状突起,表面较为平坦(图4a);暴露100h表面被小片层铺满(图4b);200h后表面形成更突起的小块(图4c)。这种现象的形成原因是:1h时尚未形成一层致密的氧化膜;100h后,表面已经形成一层致密氧化膜,金属离子在氧化膜中扩散速度很小;200h时仅在表面形成少量小颗粒状氧化物。
图5为800℃氧化后表面形貌。800℃下暴露1h(图5a),表面已能看到有明显小块状突起;100h后氧化物颗粒尺寸明显增大,且表面变得粗糙(图5b);氧化200h后(图5c),表面形貌中氧化物颗粒形状与图5b相同,颗粒尺寸有所增大。800℃氧化时,100h时氧化物形状有明显变化。

图5 800℃氧化后表面形貌
图6为900℃氧化后表面形貌。

图6 900℃氧化后表面形貌
由图6a可知,900℃暴露1h后,表面由大量小片状氧化物组成,片状的大小和数量明显多于图4a和图5a。由图6b可知,在100h后,表面形貌发生突变,有两种不同形状的氧化颗粒组成,形状呈大小不同的块状(以h1和h2表示),成分见表2。由图6c可知,200h后,表面氧化物颗粒形状无明显变化。900℃下100h后表面主要有大小两种颗粒,大颗粒中,Ti含量高达48.3%,说明大颗粒中主要由TiO2组成;而小颗粒中,Cr含量高达63.7%,主要是由Cr2O3组成。表面形貌发生突变主要是由TiO2生长造成的。

表2 900℃100h氧化物成分 wt%
图7为700℃氧化200h截面图。

图7 700℃氧化200h截面图
由图7可以看出,表面的最外层明显有较薄的一层氧化膜,接近1μm,基体中未发现有氧化物;结合图3a结果可知,氧化膜仅由Cr2O3组成。700℃时O2-在由Cr2O3组成的氧化膜中扩散速度非常慢,难以进入基体中形成内氧化。700℃时氧化膜较薄,截面图放大倍数较高,无法得到准确的能谱面扫描结果,且氧化膜组成单一,因此仅展示截面SEM形貌图片。
图8为800℃氧化200h截面及元素面分布图。由图8a可以看出,氧化层十分致密,与基体界面处存在基体的小突起,这有利于提高氧化膜和基体之间的结合力;基体中存在氧化物颗粒。由图8b可知,氧化膜中存在的Ni元素很少。由图8c和图8f可知,氧化膜中主要存在两种金属元素Cr和Ti,且两种元素分布均匀。由图8d和图8e可知,在界面处有少量Al富集,同时基体中有块状Al和O元素富集区;结合图3b结果可知,氧化膜主要为TiO2和Cr2O3,界面处有少量Al2O3,同时基体中存在少量的Al2O3氧化物颗粒。800℃氧化增重主要由金属离子扩散控制,大量金属离子(Cr3+和Ti4+)扩散到氧化膜表面生成氧化物;O2-在TiO2和Cr2O3组成的氧化膜中扩散速度较快,进入基体中形成氧化物。

图8 800℃氧化200h截面及元素面分布图
图9为900℃氧化200h截面及元素面分布图。

图9 900℃氧化200h截面及元素面分布
由图9a可知,氧化膜厚度达5μm,靠近氧化膜的基体中存在大量的氧化物。氧化膜中,主要富集两种元素Ti和Cr,Ti元素在氧化膜外表面富集,Cr均匀存在于氧化膜内部(图9c和图9f);基体中有大量条状Al和O元素富集区(图9e)。表面聚集的Ti形成大颗粒TiO2,氧化膜内部主要是Cr2O3和少量TiO2,基体中存在大量的Al2O3。900℃氧化后期,增重由金属离子和氧离子共同控制,大量的金属离子扩散到氧化膜表面,生成氧化物TiO2和Cr2O3,同时Ti4+扩散速度大于Cr4+离子,在表面形成大颗粒TiO2和小颗粒Cr2O3,O2-进入基体中形成Al2O3,造成氧化增重。
3 结论
(1)700℃氧化规律近似抛物线,氧化初期速度较快,然后增重速率减小,总增重趋于稳定。800℃和900℃下氧化规律符合抛物线规律。不同温度下,氧化速率均随时间增加而减小,但氧化初期速率随着温度增加而增加。
(2)700℃氧化层为致密的Cr2O3氧化膜;800℃氧化膜为Cr2O3和少量TiO2;900℃氧化层为TiO2和Cr2O3,且800℃以上发生内氧化。随着温度升高,更多种类的元素参与到氧化过程中。
(3)氧化增重速率由金属离子和氧离子在氧化膜中的扩散速度决定,温度越高扩散速度越快,氧化增重速度越快。

