CD81联合CD10及CD34在流式细胞术监测儿童B-ALL微小残留病变中的应用价值
方宗宇,马莉,周骏,张宇,吴青青
(1贵州医科大学微生物与免疫学教研室,贵阳 550004;2贵州医科大学附属医院)
研究表明,骨髓中的微小残留病变(MRD)是儿童和成人急性B淋巴细胞白血病(B-ALL)临床诊断结果的有力预测因子[1~3]。在诱导或巩固治疗结束时,MRD>0.01%提示短期或长期复发风险增高[4,5]。流式细胞术(FCM)是临床最常用的检测MRD方法[6,7]。CD81是一种具有多种生物学活性的四次跨膜蛋白分子,与CD19形成CD19-CD21-CD81多分子复合物,参与B细胞的信号转导,对B细胞的发育和体液反应至关重要[8,9]。有研究[10]报道,在一系列急性前体B细胞白血病(pre-B-ALL)病例中,CD81表达异常减弱。其他研究[11]亦发现,CD81在B-ALL MRD阳性病例中异常表达。提示CD81在区分B-ALL细胞和正常B细胞中可能有重要作用。而CD81联合CD10和CD34在儿童B-ALL MRD检测中的应用鲜见报道。2017年8月~2018年4月,我们采用FCM检测一系列患有B-ALL MRD的儿童,探讨CD81联合CD10和CD34在儿童B-ALL MRD监测中的应用价值。
1 资料与方法
1.1 临床资料 选取贵州医科大学附属第一医院儿童血液科2017年8月~2018年4月送检的27例B-ALL MRD阳性患儿骨髓标本。标本来源患者男12例、女15例,年龄1~15岁,中位年龄4岁。B-ALL诊断基于细胞形态学、免疫学、细胞遗传学和分子生物学(MICM)诊断模式,患儿均接受中国儿童白血病组(CCLG)-ALL-2008方案治疗[12]。另取同时期10例患有血液系统疾病但已完全缓解患儿的骨髓标本(均含有正常增生的各阶段B系细胞)作为对照,其中男5例、女5例,年龄2~13岁,中位年龄6.5岁。本研究经贵州医科大学附属医院伦理委员会批准,并获得每位患儿法定监护人的知情同意。
1.2 MRD筛查 使用两个抗体组合对MRD进行筛查,第一管抗体组合为CD34-FITC/CD10-PE/CD45-Percp/CD19-APC/CD20-PE-Cy7/CD38-APC-Cy7,第二管抗体组合为CD81-FITC /CD10-PE/CD45-Percp /CD34-APC/CD19-PE-Cy。除CD38购自美国Biolegend公司外,其他抗体均购自美国BD公司。27例B-ALL MRD阳性患儿标本中第一管均表现出异常表达,在此基础上用第二个抗体组合对CD81联合CD10和CD34进行分析。异常细胞群中细胞抗原表达>20%,且二维点图中集中出现超过10个异常细胞,定义MRD阳性[13]。
1.3 样品处理和细胞染色 取EDTA抗凝的骨髓标本(包括对照)制备单细胞悬液,每管样品细胞数约为1×106;加入单克隆抗体进行标记,置于室温下避光孵育15 min;加入FACS溶血素(BD,美国)约3.0 mL,再次室温下避光孵育15 min以溶解红细胞。用PBS洗涤细胞2次,离心弃上清。最后,加入PBS 500 μL 混匀,使用美国BD公司的FACSCantoⅡ流式细胞仪对细胞进行上样检测,至少获取3×105个活细胞。并通过FACSDiva软件分析细胞群的抗原表达。为使结果具有可比性,在所有标本中使用相同荧光染料缀合的单克隆抗体。电压和补偿按照仪器使用说明每周调节1次。
1.4 CD81、CD10及CD34在正常B系前体细胞和成熟B细胞中的表达检测 采用流式细胞仪检测对照骨髓样品中的CD19阳性B淋巴细胞。首先基于前向角散射高度(FSC-H)与前向角散射面积(FSC-A)设门(P1)以去除粘连的细胞;然后通过FSC-A和侧向角散射面积(SSC-A)(P2)除去死细胞和细胞碎片;最后,通过低至中等SSC并且CD19+(P3)圈出B系细胞。利用CD10和CD34在各期正常B细胞中表达不同,建立CD81/CD10和CD81/CD34的正常表达模式图。P3中B细胞通过CD34/CD10可分为三个发育阶段:早期前体B细胞(P4门),前体B细胞(P5门),成熟B细胞(P6门)。
1.5 CD81、CD10及CD34在儿童B-ALL细胞中的表达检测 基于CD81/CD10和CD81/CD34的正常表达模式图,如Lucio等[14]描述的一样,我们定义落在正常骨髓B细胞区域之外的细胞为异常肿瘤细胞,进而观察CD81联合CD10和CD34在儿童B-ALL残留细胞中的异常表达模式。
1.6 B-ALL MRD阳性患儿中CD81检出率测算 我们以第一个抗体组合(CD34 /CD10 /CD45 /CD19 /CD20 /CD38)检出异常为标准选择出27例MRD阳性患儿,其骨髓标本再用流式细胞术检测第二个抗体组合CD81 /CD10 /CD45 /CD34/CD19 的表达情况,其中检出率为第二个抗体组合中的出现异常表达模式的病例占第一个抗体组合(共27例)的比例。
2 结果
2.1 CD81、CD10及CD34在正常B系前体细胞和成熟B细胞中的表达 见图1。在B细胞发育过程中,早期前体B细胞表达 CD10+/CD34+/CD81+(P4门);前体B细胞表达CD10+/CD34-/CD81+(P5门);而成熟B细胞表达CD10-/CD34-/CD81dim(P6门)。正常未成熟的B祖细胞显示出明亮的CD81表达。结果与Muzzafar等[15]描述一致。正常前体B细胞在CD10/CD81和CD34/CD81双参数点图上形成紧密重叠的细胞群落,易与白血病细胞区分开。
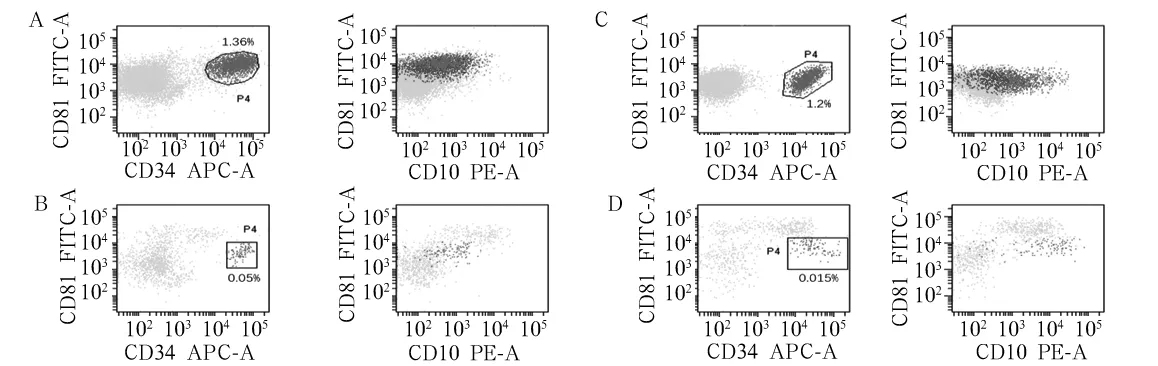
2.2 CD81、CD10及CD34在儿童B-ALL细胞中的表达 CD81、CD10及CD34异常表达模式见图2,CD34/CD81双参数点图中只有一种异常的表达模式CD34+/CD81dim(图2B,P4门);CD10/CD81点图中可出现两种异常的表达模式,CD10+/CD81dim和CD10-/CD81+(图2C和D,P4门)。在B-ALL MRD阳性标本中,CD19+/CD34+或CD19+/CD10+白血病细胞显示CD81表达减低(图2A-C,P4和P5门)的比例分别占55.6%(15/27)和37.1%(10/27),另外在3例MRD阳性病例中,CD81阳性细胞显示CD10丢失(图2D,P4门),而CD81联合CD10及CD34能检测出高达81.5%(22/27)的阳性病例。观察组有2例在诱导化疗后15 d和33 d连续检测到MRD阳性,他们在化疗15 d时表达的异常模式为CD34+/CD81dim,在33 d时2例残留白血病细胞持续表达CD34+/CD81dim(图3)。
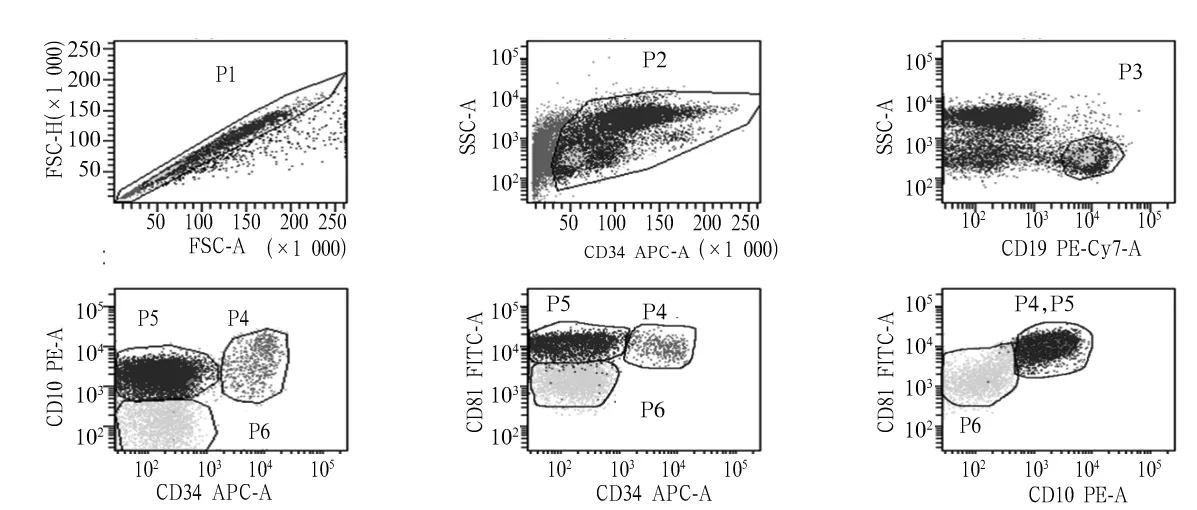
注:早期前体B细胞和前体B细胞的CD81均显示出明亮表达,而成熟B细胞则弱表达CD81(即CD8dim)。
图1 设门策略及正常B细胞发育过程中CD81表达模式
3 讨论
FCM利用白血病细胞表面抗原,即白血病相关免疫表型(LAIP)识别异常细胞[14,16]。应用FCM对B-ALL进行MRD评估,能准确、敏感地将白血病细胞从再生淋巴细胞中分离出来[17]。用FCM检测MRD会受化疗或骨髓移植治疗后骨髓中增生的正常前体细胞影响,因此儿童B-ALL的MRD监测依赖于白血病细胞和正常发育B祖细胞中抗原的差异表达。Barrena等[18]首先描述了正常B细胞 成熟过程中的CD81表达,并检测了多种B系肿瘤中的CD81表达情况,他们在早期CD34+/ CD10+和晚期CD34-/CD10+B系前体细胞中均一地高表达CD81。CD81在其研究中的12例pre-B-ALL病例中有9例(75%)异常表达降低。本研究再次印证了上述结果,CD10+或CD34+的残留白血病细胞中CD81异常弱表达比例占70.4%(19/27)。

注:A残留白血病细胞异常表达CD10+/CD81dim和CD34+/CD81dim;B残留白血病细胞仅异常表达CD34+/CD81dim;C残留白血病细胞仅异常表达CD10+/CD81dim;D残留白血病细胞仅异常表达CD10-/CD81+。
图2 CD81/CD10、CD81/CD34在B-ALL MRD中异常表达模式
注:A和C分别为两个患者诱导化疗后15 d时异常表达CD34+/CD81dim,B和D为相应患者在诱导化疗后33 d时的CD34+/CD81dim异常表达,百分数为异常白血病细胞占有核细胞的百分比。
图3 2例患儿诱导化疗后15 d和33 d时的CD81表达
Tsitsikov等[10]发现,使用CD45、CD19、CD34、CD10、CD20、CD38、CD58和CD81的组合,在86例B-ALL MRD阳性病例中可检测到85例异常,正常B细胞在CD38/CD81和CD58/CD81点图上形成紧密的细胞群,从而使多数异常B淋巴白血病细胞与正常B细胞较好地分离。Muzzafar等[15]认为,CD81特别适用于pre-B-ALL中MRD的流式细胞术检测,因为在多数情况下,白血病细胞会落在B细胞CD81表达的正常范围外,在缺乏正常骨髓细胞的区域中形成群落。因此尽管存在大量正常B细胞群,少量的白血病细胞亦可被识别。本实验中我们发现,正常B系细胞在CD10/CD81联合CD34/CD81两个双参数点图亦形成紧密的群落,使异常的B淋巴细胞易于区分。
本研究结果显示,CD10/CD81单独使用时对儿童B-ALL MRD的检出率为48.2%(13/27),但对于CD81异常弱表达,而CD10丢失的肿瘤细胞可能会漏检;CD34/CD81单独使用检出率为55.6%(15/27),而对于CD81异常弱表达,而CD34丢失的肿瘤细胞亦可能会漏检;这可能是由于B淋巴白血病细胞的异质性导致较早期的细胞可能丢失CD10或CD34,从而异常减弱的B肿瘤细胞与正常成熟B淋巴细胞在CD81/CD10或CD81/CD34二维点图上重叠,无法区分出肿瘤细胞。而CD81联合CD34和CD10可在高达81.5%(22/27)的MRD阳性病例中显示异常表达。可见,CD81与CD10及CD34联用可提高儿童B-ALL MRD的检出率。
在白血病细胞上特异表达,且在化疗后残留肿瘤细胞上稳定表达的标志物是用于监测MRD的良好指标。本研究中有2例患儿在化疗后15和33 d时MRD持续阳性,其白血病细胞持续表达CD34+/CD81dim,其中1例还持续异常表达CD10+/CD81dim。Muzzafar等[15]发现,91%的病例中,CD81在化疗后1个或更多个后续时间点持续保持异常弱表达。可见CD81异常弱表达在B-ALL的MRD监测中较稳定可靠。
综上所述,CD81联合CD10、CD34用于监测儿童B-ALL MRD有较高的阳性率,且在2例MRD持续阳性的患儿中,于不同时间点呈现相同模式的弱表达,提示CD81在儿童B-ALL MRD监测中是一个敏感、稳定且特异的指标。

