新疆某牛场不同日龄犊牛粪源大肠杆菌耐药性分析
哈力亚尔·吾布力 ,迪力穆拉提·玉苏普 ,米克热木·沙衣布扎提 ,买占海 ,苏占强 ,刘英玉 ,张晓红,姚 刚,夏利宁,张小莺,吾买尔江·牙合甫,赛福丁·阿不拉
(1.新疆农业大学动物医学学院,新疆乌鲁木齐830052 ;2.新疆医科大学,新疆乌鲁木齐 830054)
食品安全目前是每个人最关注的热点问题之一,日常生活中绝对离不开畜产品,包括鸡、鸭、牛、羊肉等。随着畜产品的发展,畜产品中出现的问题越来越多,2017 年3 月15 日“315 国际消费者权益日”报道少数养殖场在动物饲料中添加抗生素类等不符合食品安全的药物,而这种行为的背后存在着巨大的食品安全隐患-抗生素耐药性,某些抗生素在家畜养殖过程中虽能起到促生长促增肉作用,但产生的耐药性作用无法挽回,最终通过食物链引起人类产生抗生素耐药性。
大肠埃希氏菌(Escherichia coli.,E.coli)通常被称为大肠杆菌,属于大肠杆菌科、埃希氏菌属,是动物肠道发现的共生细菌和机会性病原体[1]。牛大肠杆菌病是由致病性大肠杆菌引起患牛的急性传染病[2]。主要表现肠炎、肠毒血症等多种临床症状。不同时期感染所表现的临床症状不同,所以该病可分为犊牛黄痢、犊牛白痢和牛水肿病3 种[3]。为控制大肠杆菌引起的疾病多采用抗菌药物进行治疗,但由于滥用抗菌药物导致的细菌耐药性成为全球性问题,被世界卫生组织定义为21 世纪最大的公共卫生安全问题之一[4-5]。由耐药性致病菌引起动物感染的疾病治疗变得更加困难,造成经济负担。人类的细菌性疾病多也采用抗生素进行治疗,而人与动物的抗菌药物种类在一定程度是相似的,很多抗生素使用只是剂量大小的差异。目前有证据表明,动物在使用抗生素药物产生的耐药性,可经传递进入人体,造成人类病原菌耐药现象的出现,对人类疾病治疗产生不良影响[6-7]。
本试验通过对新疆某牛场犊牛不同生长期的牛粪源大肠杆菌进行临床常用抗菌药物的耐药性调查,掌握不同犊牛不同生长期牛携带大肠杆菌的耐药情况;监测牛群大肠杆菌耐药性的发展变化动态,有利于掌握动物源耐药菌的扩散,获取耐药性数据,指导养殖场合理临床用药提供科学数据。
1 材料与方法
1.1 样品采集 2016 年12 月在新疆某肉牛场出生1 -3 月不同日龄犊牛进行样品采集,利用肛拭子在直肠采集新鲜犊牛源粪200 份。
1.2 试验药品及培养基 麦康凯培养基、伊红美蓝培养基、营养肉汤、琼脂、Mueller -Hinton(MH)、乳糖、蛋白胨、溴甲酚紫水溶液、氢氧化钠等,均购自北京奥博星生物技术有限公司;药敏片阿莫西林(AMC)、阿莫西林/克拉维酸钾(APC)、环丙沙星(CIP)、恩诺沙星(ENR)、诺氟沙星(NOR)、氨苄西林(AMP)、庆大霉素(GEN)、阿米卡星(AMI)等,均购自杭州微生物试剂有限公司。
1.3 试验方法 采集样品营养肉汤37 ℃培养24 h,伊红美蓝琼脂分离大肠菌株,中心暗蓝黑色并有绿色金属闪光的菌落;挑取单菌在麦康凯琼脂37 ℃培养24 h,培养形成红色菌落;提取纯化好的单菌落,进行革兰染色鉴定;配制乳糖复发酵培养基(1 L:蛋白胨20 g、乳糖10 g、0.04%溴甲酚紫水溶液25 mL、用1 mol/L NaOH 调pH 值7.2~7.4,115 ℃高压灭菌15 min)观察产气;同时将单菌落接到30%甘油30 mL(H2O 70 mL,甘油30 mL,121 ℃高压灭菌15 min) -20 ℃中保存。
细菌药敏试验采用WHO 推荐的Kirby-Bauer法,测定大肠杆菌对3 类抗菌药物,共8 种药物的敏感性。依据美国临床试验室标准化委员会(NCCLS)有关标准,每次测定均以质控菌为对照,只有当质控菌株的抑菌圈直径在允许范围内测试菌株结果才有效。每次试验重复3 次,大肠杆菌标准质控菌株为ATCC 25922(新疆农业大学动物医学院苏战强副教授提供)。结果判定按照NCCLS(2005 年版)进行。按抗菌药物敏感性试验扩散法标准判定各菌株的敏感度,对所分离的细菌进行药敏试验。以敏感(Sensitivity)、中介(Intermediate)、耐药(Resistant)3 种形式对抑菌圈大小作出判定。测试各种药敏纸片对大肠杆菌标准菌株ATCC 25922 产生的抑菌圈大小,观察抑菌圈直径是否在要求范围内,判断药敏片是否合格。具体判断标准见表1。

表1 药敏试验判定标准
2 结果与分析
2.1 细菌的分离鉴定 1 -3 月不同日龄犊牛粪源大肠杆菌分离率为100%。样品伊红美蓝分离大肠菌株,中心暗蓝黑色并有绿色金属闪光的菌落;麦康凯琼脂培养形成红色菌落;纯化单菌落,革兰染色显示阴性小杆菌;乳糖复发酵培养基产气。
2.2 犊牛粪源大肠杆菌耐药性分析 200 株犊牛粪源大肠杆菌对8 种临床常用抗菌药物的耐药结果见图1。由图1 可知,0 -90 日龄200 株犊牛源大肠杆菌主要对阿米卡星(52.5%)1 种抗菌药耐药性超过50%,环丙沙星(30.5%)、诺氟沙星(29%)、恩诺沙星(29%)、庆大霉素(35.5)、阿莫西林(16%)、阿莫西林克拉维酸钾(16.5%)7 种抗菌药耐药性较低,氨苄西林(3.5%)1 种抗菌药耐药性最低。

图1 200 株犊牛粪源大肠杆菌耐药率分析/%
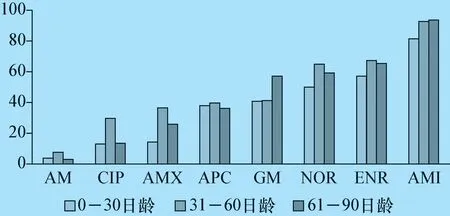
图2 不同日龄犊牛粪源大肠杆菌耐药率分析/%
2.3 不同日龄犊牛粪源大肠杆菌耐药性分析 0 -30 日龄犊牛粪源大肠杆菌对8 种临床常用抗菌药物的耐药结果显示,氨苄西林(3.03%)、环丙沙星(13.6%)、阿莫西林(26%)和阿莫西林克拉维酸钾(36.6%)4 种抗菌药物敏感,而庆大霉素(57.14%)、诺氟沙星(59.3%)、恩诺沙星(64.5%)和阿米卡星(93.75%)逐渐出现敏感性降低,耐药性增强现象。31-60 日龄犊牛粪源大肠杆菌对8 种临床常用抗菌药物的耐药结果显示氨苄西林(37%)、阿莫西林克拉维酸钾(13%)、阿莫西林(14.2%)和诺氟沙星(37.9%)、环丙沙星(40.7%)5 种抗菌药敏感率较高,恩诺沙星(50%)、庆大霉素(57.1%)、阿米卡星(81.4%)逐渐出现敏感性降低,耐药性增强现象。31 -60 日龄犊牛粪源大肠杆菌对8 种临床常用抗菌药物的耐药结果显示阿米卡星(7.65%)、庆大霉素(29.75%)、恩诺沙星(36.65%)、诺氟沙星(39.75%)和环丙沙星(41.34%)5种抗菌药敏感率较高,而阿莫西林(65%)、阿莫西林克拉维酸钾(67.3%)和氨苄西林(92.7%)3 种抗菌药逐渐出现敏感性降低,耐药性增强现象。整体分析犊牛日龄与耐药率成正比关系,耐药趋势为阿米卡星>恩诺沙星>诺氟沙星>庆大霉素>阿莫西林克拉维酸钾>阿莫西林>环丙沙星>氨苄西林。
3 讨论
大肠杆菌是多种动物传染性治病的病原菌,可在肠道大量繁殖,对抗生素的过度使用和滥用,使动物体内大肠杆菌的耐药性越来越严重,未被分解的抗生素和耐药菌随粪便排出体外污染食品、水源、环境并引起人类感染[8]。大肠杆菌耐药性广泛,在动物疾病的防治过程中慎用阿莫西林、恩诺沙星、诺氟沙星及环丙沙星。抗生素药物使用前须利用药敏试验来选择敏感性较强的药物进行使用,此外也可与其他抗菌药物联合使用来进行动物疾病防治。这样在增加疗效的的同时,也可以减少细菌耐药性。动物源细菌耐药性的迅速出现,不仅使原有的抗菌药物失去作用,导致动物疾病难以控制,而且这些耐药菌很有可能通过污染环境、食品或人与动物的接触传播给人,对人类的健康带来更大的伤害。
兽医临床治疗中氨基糖苷类为碱性抗菌药,对需氧革兰阴性杆菌、结核杆菌和金黄色葡萄球菌作用强。结果显示200 株粪源大肠杆菌对氨基糖苷类抗菌药耐药性较严重,其中阿米卡星耐药性达到52.5%,超过50%检测株数,此外庆大霉素耐药性达到35.5%,导致此现象原因可能是犊牛在幼龄期消化系统未发育完全,冬季环境因素易导致犊牛消化不良,多数犊牛出现腹泻病理,庆大霉素在兽医临床中主要用于下泻,消化功能紊乱,因此庆大霉素大量使用导致耐药性高。此外庆大霉素对幼畜/新生幼儿产生肾毒性和不可逆的耳毒性,建议限用或禁用[9-11]。
氟喹诺酮类是杀菌性抗菌药,目前兽医领域使用药物种类10 余种,对革兰阳性菌、革兰阴性菌、衣原体、支原体作用更强[12]。结果显示,环丙沙星(30.5%)、诺氟沙星(29%)、恩诺沙星(31.5%)3种抗菌药耐水平均在30%(29%~31.5%),说明该场牛源大肠杆菌对氟喹诺酮类抗菌药可能存在交叉耐药。沙星类抗菌药物广泛应用到牛、猪和禽类等动物的肺部感染、泌尿生殖系统感染及支原体引起的疾病。冬季容易造成细菌、支原体引起肺炎或成群感染。因此治疗阶段沙星类药物和TMP 进行配合使用,增强沙星类药物的抗菌疗效,与磺胺、对氨基苯甲酸配合使用有协同作用,提高疗效,避免单类抗菌药重复使用造成耐药性上升[13]。
β-内酰胺类抗菌药对革兰阳性菌、革兰阴性菌、厌氧菌类等作用强,结果显示氨苄西林、阿莫西林、阿莫西林克拉维酸钾3 种抗菌药耐药性均低于20%,其中氨苄西林耐药性仅为3.5%。β-内酰胺类抗菌药耐药率最低,但日常治疗过程中建议采取联合用药方式就诊。从不同日龄犊牛源大肠杆菌耐药率分析,犊牛日龄与耐药率成正比关系,耐药趋势为阿米卡星>恩诺沙星>诺氟沙星>庆大霉素> 阿莫西林克拉维酸钾> 阿莫西林> 环丙沙星>氨苄西林。该场耐药性日益严重,这种产生的原因可能是由于滥用和不合理使用抗菌药物导致耐药性通染色体或其他在细菌间传播,致使正常大肠杆菌对药物环境的适应性逐渐增强,耐药基因在细菌间相互传递和蔓延,因此导致多重耐现象的发生,使联合用药药效降低影响动物疾病的防治,养殖户成本增加。

