c-di-AMP
——细菌中第二信使的研究进展
金 华, 马春骥, 韩 杨, 罗海霞, 李 敏* , 郝秀静*
(1.宁夏大学 西部特色生物资源保护与利用教育部重点实验室, 宁夏 银川 750021;2.宁夏大学 生命科学学院, 宁夏 银川 750021)
环二腺苷酸(cyclic diadenylate monophosphate,c-di-AMP)是在细菌中新发现的广泛存在的一类重要的第二信使。目前在枯草芽胞杆菌、金黄色葡萄球菌、肺炎链球菌以及单核细胞增生李斯特菌等[1-5]常见的致病菌中都检测到了c-di-AMP。近年来,c-di-AMP在细菌中的功能渐渐明朗,它参与细菌的生长、生物被膜的形成、细胞壁的代谢平衡、脂肪酸的合成、钾离子转运等生命过程,同时与DNA的完整性以及细菌的致病毒力等[6-7]方面也相关。然而,厚壁菌在缺乏c-di-AMP的条件下不能生长,但c-di-AMP的过多积累影响细菌的生长,因此c-di-AMP也被认为是一种毒素[8]。此外,c-di-AMP在宿主细胞与病原菌互作过程中激活固有免疫方面也发挥着重要作用。
1 c-di-AMP的合成与降解
c-di-AMP 在细菌中的代谢受c-di-AMP合成酶(也称为二腺苷酸环化酶)和降解酶(磷酸二酯酶)的精密调控。目前认为c-di-AMP是由两分子的ATP或者两分子的ADP经环化酶 (diadenylatecyclase,DAC) 作用后形成一种环状分子,可被磷酸二酯酶(phosphodiesterase,PDE) 分解为一个线性分子pApA 或者两分子的AMP,如图1所示。
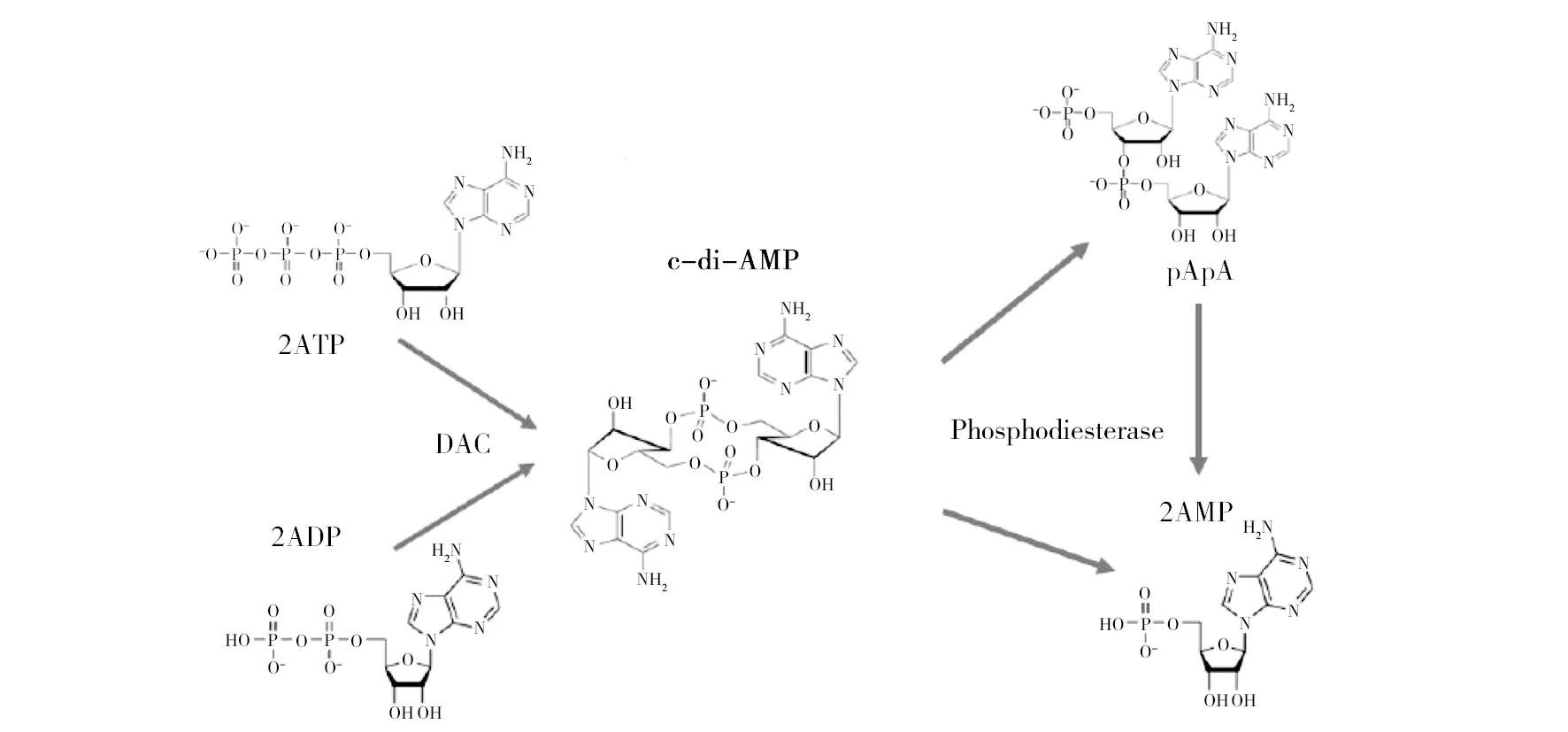
图1 c-di-AMP的合成与分解[9]
1.1 c-di-AMP的合成酶
枯草芽胞杆菌的DisA 是发现的第一个c-di-AMP 合成酶,它含有具有催化活性的DAC结构域,在许多细菌和古细菌中均发现了含有DAC结构域的蛋白质,该类蛋白的DAC结构域中均存在RHR(Arg-His-Arg)和DGA(Asp-Gly-Ala)两个氨基酸保守基序[10-11]。目前含有DAC结构域的蛋白质主要有DisA、CdaS、CdaM和 CdaA[12]四种类型。CdaA和CdaS 的氨基酸同源性较高,达到40%,而DisA与CdaA和CdaS的同源性仅为19%[12-13]。大多数细菌中只含有一种类型的DAC结构域,但是在梭菌属中含有CdaA和DisA两种类型的DAC结构域,在枯草芽胞杆菌中含有DisA、CdaA和CdaS三种类型的DAC结构域。
目前,关于c-di-AMP合成酶催化合成c-di-AMP的机制研究较多的是枯草芽胞杆菌中的DisA[14]。研究发现DisA在胞子的形成中还是调节DNA修复机制的一种重要关卡蛋白。在枯草芽胞杆菌中DisA与一种DNA修复蛋白RadA共同编码操纵子,DisA通过扫描DNA并检测到损伤的DNA后,发出终止胞子形成信号,DisA与RadA修复DNA损伤后,重新启动胞子形成途径[12]。CdaA(也称为DacA)是在金黄色葡萄球菌、肺炎链球菌、化脓隐秘杆菌和单核细胞增生李斯特菌等多种细菌中发现的具有DAC结构域的一种c-di-AMP环化酶[15-16],CdaA已被证明参与维持细胞壁稳态以及控制钾离子通道的作用[13,17,18]。在金黄色葡萄球菌中,发现DacA的活性受磷酸葡糖胺变位酶glmM基因的控制,GlmM可抑制DacA合成c-di-AMP,而GlmM自身的活性不受DacA的影响[19-20]。CdaS仅在产生胞子的芽胞杆菌属和梭菌属中发现,并且只在胞子萌发期间表达[21]。CdaM是首次在肺炎支原体中被发现的具有DAC结构域的c-di-AMP环化酶,并且与枯草芽胞杆菌中的CdaS的DAC结构域相近,在对肺炎支原体CdaM的缺失突变体进行筛选时,未得到相应的突变体,说明c-di-AMP对肺炎支原体的存活至关重要[22]。
本课题组在绵羊肺炎支原体Y98株中首次发现了c-di-AMP,经生物信息学分析与异源表达,初步确定了绵羊肺炎支原体中合成c-di-AMP的酶DisaM。该酶共有203个氨基酸,含有一个DAC结构域,蛋白大小为18 kD,与其他细菌的c-di-AMP合成酶不同的是,它只含有一个跨膜结构域。该蛋白虽然也含有保守的RHR(Arg-His-Arg)和DGA(Asp-Gly-Ala)基序,但是整体序列与已报道的c-di-AMP 合成酶序列同源性很低。
1.2 c-di-AMP的降解酶
c-di-AMP的降解酶(磷酸二酯酶,PDE)最早是在枯草芽胞杆菌中发现的,随后在金黄色葡萄球菌、单核细胞增生李斯特菌和链球菌中也发现了PDE[23]。PDE水解c-di-AMP,生成线性的磷酸腺苷(pApA)分子或两分子的AMP[24]。已发现能够降解c-di-AMP的PDE有三类:PgpH、GdpP和Pde2[23,25]。在不同的细菌种类中含有不同的PDE,但是在单核细胞增生李斯特菌中含有GdpP和PgpH两种磷酸二酯酶,在链球菌和葡萄球菌中也含有两种磷酸二酯酶,分别是GdpP和Pde2[23]。
在PDE中,主要包含DHH/DHHA1(DHH代表Asp-His-His)和HD两种类型的结构域。GdpP是含有DHH/DHHA1的结构域蛋白[23,25],该蛋白包含有两个跨膜螺旋结构,一个PAS感受结构域,一个高度异化的GGDEF结构域,一个DHH结构域以及DHH伴随结构域DHHA1结构域(如图2所示)。GdpP中的DHH/DHHA1结构域将c-di-AMP水解成pApA[25]。GdpP中的PAS结构域还可与血红素结合,血红素抑制其磷酸酯酶活性[26]。Pde2是在肺炎链球菌中发现的含有DHH/DHHA1结构域的蛋白,该蛋白不仅可以水解c-di-AMP,还可以水解其分解产物pApA,最终生成AMP[27-28]。Pde2对胞内pApA和c-di-AMP的稳态发挥重要作用[29-30]。PgpH是在单核细胞增生李斯特菌中发现的含有HD结构域的蛋白,后续研究发现在其他细菌中也广泛分布[23,31]。PgpH在其C-末端具有催化作用的HD结构域,可将c-di-AMP降解为5′-pApA,PgpH除HD结构域外,还具有N-末端的细胞外结构域和7个跨膜螺旋结构[31]。

图2 GdpP、Pde2和PgpH的结构示意图
2 c-di-AMP在细菌中的结合蛋白
c-di-AMP在信号通路中的不同作用取决于其与靶分子的结合,因此研究细菌中c-di-AMP的结合分子以及其结构和功能对于揭示c-di-AMP的机制至关重要[32]。最常见的方法是使用c-di-AMP亲和柱从细菌细胞质提取物中分离结合蛋白,并进行质谱分析。目前,已发现c-di-AMP的结合蛋白包括酶、转运蛋白和转录调节因子等几类,它们通过与c-di-AMP结合进行变构调节(见表1)。此外,c-di-AMP还可与RNA核糖开关结合,共同调控细菌的生理活动[33-34]。

表1 在细菌中c-di-AMP的结合蛋白
3 c-di-AMP激活宿主细胞通路的受体蛋白
c-di-AMP在真核宿主细胞抗感染的固有免疫中发挥着重要作用。病原菌进入到宿主细胞后,释放c-di-AMP,与真核宿主细胞中的受体结合并激活相应的信号通路。到目前为止,已鉴定出宿主细胞中c-di-AMP的主要受体有STING、DDX41、RECON和ERAdP四种。
3.1 STING
STING(也称为MYPS、MITA、ERIS或TMM173)是一种位于内质网膜上的蛋白质,是将核酸的上游细胞溶质与下游细胞因子连接起来的膜上衔接蛋白[41]。c-di-AMP与Sting结合,激活TBK1介导的干扰素调节因子IRF3的磷酸化,被磷酸化的IRF3进入细胞核诱导I型IFN的产生[42]。此外,由cGAS酶合成的2′5′-cGAMP是真核细胞细胞质中DNA的主要传感器之一,也可以激活STING信号通路[43]。
3.2 DDX41
Parvatiyar等[44]发现了DDX41是由ddx41基因编码的RNA解旋酶,能够作为模式识别受体(Pattern Recognition Receptor, PRR)识别宿主细胞内的细菌和病毒所产生的病原相关模式分子(Pathogen Associated Molecular Pattern, PAMPs),从而激活STING依赖的天然免疫应答过程。DDX41作为PRR可以识别c-di-GMP和c-di-AMP,结合STING激活TBK1、NF-κB和IRF3相关天然免疫信号通路[45-47]。在人或小鼠细胞中通过shRNA敲减DDX41的表达会导致固有免疫相关基因表达减弱,使由c-di-GMP和c-di-AMP[48-49]引发的STING-TBK1-IRF3的信号通路受阻。在同一途径中,RNA解旋酶DDX41也结合c-di-AMP和DNA,协同激活STING[44]。
3.3 RECON
2017年Mcfarland等[50]用免疫磁珠的方法分离到了细菌CDNs在真核宿主细胞中的一种新的受体-氧化还原酶(RECON也称为AKR1C13),进一步研究表明,RECON主要存在于肝组织中,与STING相反,该蛋白仅结合c-di-AMP和3′3′-cGAMP,不结合c-di-GMP或2′3′-cGAMP。c-di-AMP与RECON结合,抑制其酶活性,RECON酶活性的丧失,增加了NF-κB的活性,进而激活炎症因子的表达,降低细菌的存活率。
3.4 ERAdP
c-di-AMP除了与DDX41和STING结合促进I型IFN的产生外,还通过其更具特异性的ER衔接蛋白识别并激活NF-κB信号通路[51-52]。由于ERAdP在NK细胞中介导泛素-结合酶Ubc13激活NF-κB信号通路[53],Xia等[54]在2018年发现了ERAdP与c-di-AMP具有较高的亲和力,c-di-AMP与ERAdP的C末端结构域结合,导致ERAdP二聚化,激活TAK1激酶,活化转录因子NF-κB诱导促炎细胞因子的产生。进一步研究表明,敲除Cnep1r1fl/flLyz2-Cre 小鼠的ERAdP和TAK1,易感染单核细胞增生李斯特菌,说明ERAdP介导的促炎细胞因子的产生对控制细菌的感染至关重要[54]。
4 展 望
细菌能准确感知周围环境条件的变化并进行回应,其第二信使分子在此过程中起重要的信号转导作用,自2008 年Romling发现c-di-AMP 以来,已在多种细菌中发现,并引发越来越多的关注。c-di-AMP的水平升降可导致一系列细菌表型发生改变,调控一系列重要的细胞进程。c-di-AMP对病原菌的致病力具有一定的调控能力,可以作为药物筛选的靶标,在防止致病菌的感染方面有一定的应用潜能。c-di-AMP能够激发机体固有免疫应答,已有报道将其作为佐剂应用于黏膜以及全身免疫[55-57]。

病原菌感染细胞,通过释放c-di-AMP与胞内的STING、DDX41、RECON和ERAdP等受体结合,激活固有免疫反应,但是相关的分子机制还需要进一步深入解析。此外,真核宿主细胞中新的受体分子及相关效应蛋白有待进一步研究发现。然而,鉴于多种致病菌中c-di-AMP的发现及其对致病作用的影响,深入研究c-di-AMP在细胞中的信号通路尤为关键,对这些问题的阐释, 将有利于解析病原菌逃逸宿主固有免疫的机制, 为有效控制和治疗感染相关的疾病提供新策略和新思路。

