卡伍尔氏链霉菌NA4突变株ΔbafAI的次级代谢产物研究
张晓瑛, 潘华奇, 张 盈, 石逸冰, 3, 鲍秀艳, 胡江春*
(1.中国科学院 沈阳应用生态研究所, 辽宁 沈阳 110016; 2.中国科学院大学, 北京 100049;3.沈阳药科大学, 辽宁 沈阳 110016)
海洋链霉菌由于其独特的生理和代谢功能,成为海洋微生物活性天然产物的重要来源[1]。研究发现,海洋链霉菌能够产生丰富的次级代谢产物,包括生物碱、聚酮、氯代物和聚醚类等,其中67%的海洋链霉菌代谢产物显示具有抗寄生虫、抗癌、抑菌、抗疟等生物活性[1-2]。可见海洋链霉菌是发现抗生素和药物先导化合物的重要来源。随着越来越多的链霉菌基因组被测序,发现它们蕴含大量次级代谢产物合成基因簇,然而在常规实验室培养条件下,大多数的基因簇是沉默或者低表达的。激活这些沉默或者低表达的基因簇,促使其产物增强表达成为深入挖掘次级代谢产物的主要策略。阻断菌株主要代谢产物调控基因和合成基因,促使沉默基因簇或者低表达基因簇代谢产物的表达,已成为挖掘代谢产物的重要方式[3-4]。Becerril等[5]用阿泊拉霉素抗性基因,替换了Streptomycesargillaceus的adpAa基因,阻断adpAa基因表达,激活了杀菌素基因簇;余贞等[6]通过阻断变铅青链霉菌的负调控基因nsdA,激活了变铅青链霉菌中沉默放线紫红素生物合成基因簇的表达;Song等[7]用阿普拉霉素抗性基因替换了天蓝色链霉菌中的Gcs(sco7221 ORF),产生isogermicidins A-C 三个新型天然产物。卡伍尔氏链霉菌NA4由本课题组从中国南海深海沉积物中分离,前期研究从NA4中分离得到两个主要抗真菌活性的化合物bafilomycins B1和C1,产量分别为23.45 mg/L和6.60 mg/L[8]。进一步基因组挖掘发现,NA4不但能合成已鉴定的bafilomycins,而且具有合成lantipeptide AmfS、alkylresorcinol、frontalamide、desferrioxamine_B、nonactin、ectoine、isorenieratene、rabelomycin、lassopeptide SRO15-2005及其他未知结构类型化合物的潜能[9]。为了改变NA4菌株的代谢流,随机激活其他类型的次级代谢产物,课题组前期通过PCR-targeting技术构建了阻断NA4主产物bafilomycins的突变菌株ΔbafAI[10]。本研究旨在研究突变菌株ΔbafAI随机激活或促使产量显著提高的次级代谢产物,并对随机激活的代谢产物进行分离和鉴定。
1 材料与方法
1.1 材料
1.1.1 菌株 卡伍尔氏链霉菌(Streptomycescavourensis) NA4,bafilomycins合成阻断突变菌株ΔbafAI;指示真菌:立枯丝核病菌(Rhizoctoniasolani)、番茄灰霉病菌(Botrytiscinerea)、黄瓜枯萎病菌(Fusariumoxysporumf.sp.cucumerinum)、白色念珠菌(Candidaalbicans);指示细菌:大肠埃希菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽胞杆菌(Bacillussubtilis)、大黄欧文氏菌(Erwiniacarotovora)和丁香假单胞菌(Pseudomonassyringae),以上菌株均由本实验室保藏。
1.1.2 培养基 ① SFM培养基:黄豆饼粉20 g(水中煮沸40 min,无需过滤),甘露醇20 g,自来水1 L,琼脂条20 g;② R5培养基:蔗糖103 g,K2SO40.25 g,MgCl2·6 H2O 10.12 g,葡萄糖10 g,酪氨酸0.1 g,酵母提取物5 g,K2HPO40.5 g,1倍微量元素液1 mL,蒸馏水1 L,pH 7.2~7.4;(1倍微量元素液成分:FeSO4·7 H2O 0.1 g,MnCl2·4 H2O 0.1 g,ZnSO4·7 H2O 0.1 g,蒸馏水1 L);③ TSB培养基:胰蛋白胨15 g,大豆蛋白胨5 g,NaCl 5 g,蒸馏水1 L,pH 7.2~7.4;④ PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,自然pH;⑤ 沙氏培养基:蛋白胨10 g,葡萄糖40 g,琼脂20 g,蒸馏水1 L。
1.1.3 仪器与试剂 超净操作台(BCN-1360B,北京东联哈尔仪器制造有限公司);立氏压力蒸汽灭菌锅(YSQ-LS-50S11,上海博讯实业有限公司医疗设备厂);数控超声波清洗器(KQ3200DB,昆山市超声仪器有限公司);旋转蒸发仪(RE52-99 上海亚荣生化仪器厂);恒温摇床(DHZ-C,大仓市实验仪器有限公司);高效液相色谱仪(Ultimate-3000,美国赛默飞世尔科技公司);核磁共振仪(AV-600,Bruker);Sephadex LH20(美国GE公司);静电场轨道阱高分辨质谱(Q Exactive MS,美国赛默飞世尔科技公司);色谱甲醇(国药化学试剂有限公司);氘代试剂(美国剑桥CIL产品)。
1.2 方法
1.2.1 菌株培养和发酵 在SFM培养基平板划线突变菌株ΔbafAI(添加终浓度50 μg/mL的阿普拉霉素和50 μg/mL的甲氧苄氨嘧啶)和野生菌株NA4,置于28 ℃恒温培养箱,培养72 h,然后用挖块法接种于装有50 mL R5培养基的锥形瓶,置于28 ℃恒温摇床,180 r/min振荡培养72 h后用作种子液,将种子液转接到含有1 L R5培养基的锥形瓶,置于28 ℃恒温摇床,180 r/min振荡培养168 h,发酵总体积为30 L。
1.2.2 发酵粗提物制备 将发酵液4 000 r/min离心20 min,每升上清液加大孔吸附树脂HP20 60 mL,置于28 ℃恒温摇床,180 r/min振荡2 h,收集树脂,用无水甲醇洗脱3次,收集到的萃取物减压浓缩干燥得到发酵粗提物30.29 g。
1.2.3 化合物分离纯化和结构鉴定 将发酵粗提物用硅胶快速柱色谱法初步纯化,用二氯甲烷∶甲醇(体积比,100∶ 0、100∶2、100∶4、100∶7、100∶10、100∶15、100∶30、100∶50和0∶100)梯度洗脱。100∶2洗脱得到的馏分利用Sephadex LH20凝胶柱色谱分离,流动相为等体积的二氯甲烷和甲醇,分成Fr.A和Fr.B;将Fr.A利用半制备HPLC(30% MeOH)分离,得到化合物① 26 mg,② 21.6 mg,③ 48.9 mg,④ 7.9 mg。100∶4洗脱得到的馏分利用58%甲醇制备,得到化合物a 1.3 mg。100∶7洗脱得到的馏分首先利用ODS柱进行分离,得到45%甲醇洗脱馏分Fr.C;然后将馏分Fr.C利用半制备HPLC(48% MeOH)分离,再利用Sephadex LH20凝胶柱色谱纯化,流动相为等体积二氯甲烷和甲醇,得到化合物⑤2.4 mg。100∶10 MeOH洗脱得到的馏分利用半制备HPLC(25% MeOH)分离,得到化合物⑥6.1 mg。将分离得到的化合物通过NMR和Q Exactive MS进行结构鉴定。
1.2.4 化合物抗菌活性测定 ① 抗丝状真菌活性测定∶在PDA平板中央接种黄瓜枯萎病菌和番茄灰霉病菌,待病原菌生长至菌落直径4 cm时,在滤纸片加10 μL待测样(甲醇溶解,浓度1 mg/mL),挥干甲醇后对称放置在病原真菌四周,立枯丝核菌生长速度快,可以和滤纸片同时放置,滤纸片的直径为8 mm,10 μL无水甲醇作为阴性对照,10 μL 1 mg/mL的布雷菲德菌素为阳性对照,置于28 ℃恒温培养箱,培养24 h(立枯丝核病菌),48 h(黄瓜枯萎病菌和番茄灰霉病菌),用游标卡尺测量抑菌圈直径大小。② 抗细菌和酵母样真菌活性测定∶取活化好的指示菌平板,用接种环刮取一环菌体,制成菌体浓度为107~108cfu/mL的菌悬液(细菌培养基为TSB培养基,白色念珠菌培养基为沙氏培养基),将菌液稀释100倍,浓度变为105~106cfu/mL。实验在96孔板上进行,设10个浓度梯度,每个梯度设3个重复。在96孔板的第一列中加入20 μL甲醇溶解的1 mg/mL的待测样品,在无菌操作台挥干甲醇,在96孔板的第一孔加入200 μL培养基,混匀后从第一孔中取100 μL至第二孔,加等量培养基混匀,再取100 μL至下一孔,依次操作,倍比稀释,最后一孔混匀后弃去100 μL,在每孔中加入100 μL稀释的菌悬液,使每孔体积保持在200 μL。此时第1孔至第10孔的浓度依次为100、50、25、12.5、6.25、3.125、1.562 5、0.781 3、0.390 6、0.195 3 μg/mL,阴性对照分别为含菌培养基和不含菌培养基,阳性对照为氯霉素(抗细菌活性)和布雷菲德菌素(抗白色念珠菌活性)。将上述96孔板置于37 ℃恒温培养箱,12 h后肉眼观察,待测样品最低浓度孔无浑浊出现者,即为受试菌的最低抑制浓度。
1.2.5 ABTS自由基清除活性测定[11]将配好的ABTS·+溶液用0.01 mol/L磷酸盐缓冲液稀释,约稀释22倍,稀释后避光放置30 min,用紫外分光光度计测定吸光度值,吸光度值(0.7±0.02)为合格,可以使用。吸取稀释的供试品溶液各100 μL和ABTS·+溶液100 L至96孔板中,混匀,室温暗处反应6 min,734 nm处测定吸光度,每个供试品重复测定3次,阳性对照为维生素C,阴性对照为100 μL的无水乙醇。ABTS·+清除率计算公式如下:清除率%=(1-Asamp/Acont)×100%,其中Asamp代表供试品溶液的吸光度值,Acont代表阴性对照溶液的吸光度值,通过SPSS软件进一步计算EC50值(μmol/L)。
2 结果与分析
2.1 突变菌株ΔbafAI代谢粗提物HPLC-DAD分析
将突变菌株和野生菌株代谢产物进行HPLC-DAD分析,结果发现突变菌株ΔbafAI的代谢产物与野生株代谢产物相比,在保留时间9.0~17.0 min和30.0~33.0 min明显不同。在突变株ΔbafAI中,保留时间在30.0~33.0 min的bafilomycins消失,而保留时间9.0~17.0 min许多色谱峰(化合物1~6和a)则显著增强(图1)。推测在阻断NA4主产物bafilomycins合成基因后,突变菌株代谢流发生改变,使原低表达代谢物转变为高表达,产量显著增加。

图1 突变菌株ΔbafAI和野生菌株NA4发酵液代谢产物图谱(UV: 200~400 nm)
2.2 化合物结构鉴定
从NA4突变菌株ΔbafAI的次级代谢产物中共分离得到6个随机激活的单体化合物(图2),结构鉴定如下:
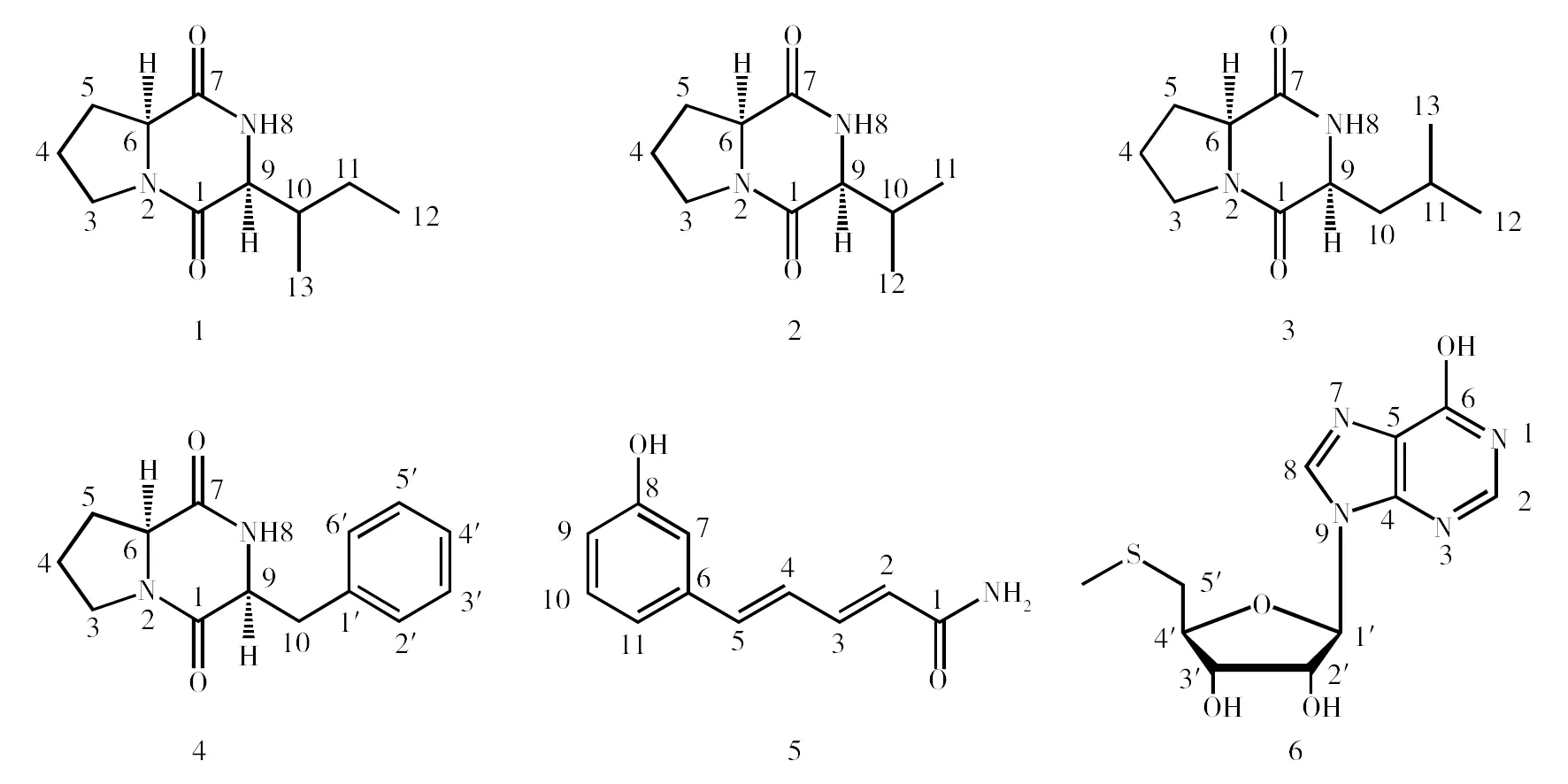
图2 突变菌株ΔbafAI中分离的化合物结构
2.1.1 化合物1 无色晶体(甲醇);HPLC-DAD检测最大吸收波长为210 nm,HR-ESI-MS给出m/z:211.144 5[M+H]+,确定其相对分子质量为210.136 7,推导其分子式为C11H18N2O2。进一步根据1H-NMR和13C-NMR数据鉴定化合物1为环(L-异亮氨酸-L-脯氨酸)[12-13]。具体信号如下:1H-NMR(DMSO-d6,600 MHz)δH:7.96(1H,s,H-8),4.10(1H,t,J=7.0 Hz,H-6),3.94(1H,s,H-9),3.37(2H,m,H-3),2.12(1H,m,H-5a),2.01(1H,m,H-10),1.81(3H,m,H-4,5b),1.30(2H,m,H-11),0.97(3H,d,J=7.1 Hz,H-13),0.81(3H,t,J=7.4 Hz,H-12);13C-NMR(DMSO-d6,150 MHz)δC:170.1(C-7),165.3(C-1),59.2(C-6),58.2(C-9),44.7(C-3),34.9(C-10),27.9(C-5),23.9(C-11),22.1(C-4),15.0(C-13),12.3(C-12)。
2.2.2 化合物2 无色晶体(甲醇);HPLC-DAD检测最大吸收波长为210 nm,HR-ESI-MS给出m/z:197.129 1[M+H]+,确定其相对分子质量为196.121 3,推导其分子式为C10H16N2O2。进一步根据1H-NMR和13C-NMR数据鉴定化合物2为环(L-缬氨酸-L-脯氨酸)[12-13]。具体信号如下:1H-NMR(DMSO-d6,600 MHz)δH:7.96(1H,s,H-8),4.11(1H,t,J=7.3 Hz,H-6),3.90(1H,s,H-9),3.37(2H,m,H-3),2.33(1H,m,H-5),1.81(2H,m,H-4),1.78(1H,m,H-10),1.00(3H,d,J=7.2 Hz,H-11),0.83(3H,d,J=6.8 Hz,H-12);13C-NMR(DMSO-d6,150 MHz)δC:170.3(C-7),165.2(C-1),59.5(C-6),58.3(C-9),44.6(C-3),27.9(C-5),27.7(C-10),22.1(C-4),18.4(C-11),16.4(C-12)。
2.2.3 化合物3 无色晶体(甲醇);HPLC-DAD检测最大吸收波长210 nm,HR-ESI-MS给出m/z:211.144 5[M+H]+,确定其相对分子质量为210.136 7,推导其分子式为C11H18N2O2。进一步根据1H-NMR和13C-NMR数据鉴定化合物3为环(L-脯氨酸-L-亮氨酸)[12-3]。具体信号如下:1H-NMR(DMSO-d6,600 MHz)δH:8.00(1H,s,H-8),4.18(1H,t,J=8.0 Hz,H-6),3.99(1H,t,J=6.2 Hz,H-9),3.35(2H,m,H-3),2.10(1H,m,H-5a),1.83(5H,m,H-4,5b,10),1.33(1H,m,H-11),0.85(6H,t,J=6.0 Hz,H-12,13);13C-NMR(DMSO-d6,150 MHz)δC:170.4(C-7),166.6(C-1),58.5(C-6),52.6(C-9),44.9(C-3),37.8(C-10),27.4(C-5),24.1(C-11),22.8(C-12),22.5(C-4),21.9(C-13)。
2.2.4 化合物4 无色油状(甲醇);HPLC-DAD检测最大吸收波长210 nm,HR-ESI-MS给出m/z:245.129 0[M+H]+,确定其相对分子质量为244.121 2,推导其分子式为C14H16N2O2。进一步根据1H-NMR和13C-NMR数据鉴定化合物4为环(L-脯氨酸-L-苯丙氨酸)[13]。具体信号如下:1H-NMR(DMSO-d6,600 MHz)δH:8.00(1H,s,H-8),7.23(5H,m,H-2′-6′),4.33(1H,t,J=4.92 Hz,H-9),4.06(1H,t,J=8.88 Hz,H-6),3.38(1H,m,H-3),3.26(1H,m,H-3),3.06(1H,dd,J=14.2,5.3 Hz,H-10),3.01(1H,dd,J=14.2,2.8 Hz,H-10),2.00(1H,m,H-5),1.71(2H,m,H-4),1.40(1H,m,H-5);13C-NMR(DMSO-d6,150 MHz)δC:169.1(C-7),165.1(C-1),137.3(C-1′),129.8(C-2′,6′),128.0(C-3′,5′),126.3(C-4′),58.4(C-6),55.7(C-9),44.6(C-3),35.3(C-10),27.8(C-5),21.9(C-4)。
2.2.5 化合物5 无色针状物(甲醇);HPLC-DAD检测最大吸收波长307 nm,HR-ESI-MS给出m/z:221.081 4[M+Na]+和190.086 7[M+H]+,确定其分子量为189.078 9,推导其分子式为C11H11NO2。进一步根据1H-NMR和13C-NMR数据鉴定化合物5为(2E, 4E)-5-(3-羟苯基)-戊-2, 4-二烯酰胺[14]。具体信号如下:1H-NMR(400 MHz,DMSO-d6)δH:9.44(1H,s,-OH),7.46(1H,m,-NH2),7.14(2H,m,J= 5.5,15.0 Hz,H-3,4),6.97(2H,m,H-10,11),6.91(2H,m,H-7,9),6.83(1H,d,J=15.5 Hz,H-5),6.70(1H,m,-NH2),6.10(1H,d,J=15.0 Hz,H-2);13C-NMR(150 MHz,DMSO-d6)δC:166.9(C-1),157.6(C-8),139.6(C-3),138.2(C-5),137.6(C-6),129.7(C-10),126.8(C-4),125.5(C-2),117.9(C-11),115.7(C-9),113.5(C-7)。
2.2.6 化合物6 白色粉末(甲醇);HPLC-DAD检测发现最大吸收波长248 nm,HR-ESI-MS给出m/z:299.061 6[M+H]+,确定其相对分子质量为298.053 8,推导其分子式为C11H14N4O4S。进一步根据1H-NMR和13C-NMR数据鉴定化合物6为5′-脱氧-5′-甲硫肌苷[15]。具体信号如下:1H-NMR(DMSO-d6,600 MHz)δH:8.32(1H,s,H-8),8.07(1H,s,H-2),5.86(1H,d,J=5.8 Hz,H-1′),4.62(1H,m,H-2′),4.09(1H,m,H-3′),4.02(1H,m,H-4′),2.85(1H,dd,J=13.9 Hz,J= 5.9 Hz,H-5′a),2.75(1H,dd,J=13.9 Hz,J=6.9 Hz,H-5′b),2.05(3H,s,-SCH3);13C-NMR(DMSO-d6,150 MHz)δC:156.6(C-4),148.4(C-6),146.0(C-2),139.0(C-8),124.5(C-5),87.3(C-1′),83.9(C-4′),73.1(C-2′),72.5(C-3′),36.0(C-5′),15.6(-SCH3)。
2.3 化合物抗菌活性测定
抗菌活性结果显示化合物1和2对白色念珠菌有抑制作用,最小抑制浓度均为50 μg/mL,比对照布雷菲得菌素的活性低(3.125 μg/mL),6个单体化合物在最大浓度100 μg/mL时对细菌(大肠埃希菌、金黄色葡萄球菌、枯草芽胞杆菌、大黄欧文氏菌和丁香假单胞菌)未检测到活性;在1 mg/mL浓度时病原真菌(立枯丝核病菌、番茄灰霉病菌、黄瓜枯萎病菌和白色念珠菌)也未检测到活性。
2.4 化合物对ABTS自由基的清除活性
采用ABTS方法测试化合物对自由基的清除活性,化合物5浓度5 μmol/L时清除率为(8.63 ± 0.85)%,浓度10 μmol/L时清除率为(14.85 ± 0.41)%,浓度50 μmol/L时清除率为(58.89 ± 3.15)%,浓度100 μmol/L时清除率为(78.05 ± 3.39)%,浓度200 μmol/L时清除率为(80.59 ± 4.90)%。通过SPSS软件计算,化合物5的EC50值为(39.73±2.97) μmol/L,阳性对照维生素C的EC50值为(6.12±0.17) μmol/L。实验结果表明化合物5具有一定的自由基清除活性,但比维生素C的自由基清除活性低。
3 讨 论
本研究对阻断NA4主产物bafilomycins的突变株ΔbafAI随机激活的代谢产物进行分离和鉴定。总共得到6个化合物,均是首次从该菌中分离得到的;化合物1~6均是阻断NA4主产物之后产量提高的化合物;生物活性测定结果发现化合物1和2显示较弱的抗白色念珠菌活性,并首次发现了化合物5的抗氧化活性;图1中的化合物a虽然对大肠埃希菌、枯草芽胞杆菌和立枯丝核菌都显示出较好的抑制作用,但是由于量较少,所以未能进行结构解析。文献调研发现环(L-异亮氨酸-L-脯氨酸)对耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus)有抑制作用[16];环(L-亮氨酸-L-脯氨酸)显示细胞毒活性,能够抑制K562细胞、HL-60细胞、BGC-823细胞和HeLa细胞[17];环(L-缬氨酸-L-脯氨酸)对尖孢镰刀菌(Fusariumoxysporum)、青霉菌(Penicilliumsp.)和前列腺癌细胞LNCaP有抑制作用[18-19];环(L-亮氨酸-L-脯氨酸)和环(L-苯丙氨酸-L-脯氨酸)组合使用对抗万古霉素肠球菌(vancomycin-resistantEnterococci)有较强的抑制作用[20];(2E, 4E)-5-(3-羟苯基)-戊-2, 4-二烯酰胺对结核分枝杆菌有较强的抑制作用[14]。综上文献调研发现环二肽类化合物具有多种抗菌和抗肿瘤活性,可见环二肽类化合物在药物及其相关研究领域中有着巨大的发掘潜力。
挖掘菌种次生代谢产物方法有多种,包括传统OSMAC策略[21],插入强启动子激活正调控基因[22],阻断负调控基因[23],核糖体工程[24],加入小分子物质[25],共培养[26]等方式激活沉默基因簇。本研究尝试了阻断NA4主产物来非特异激活其他次级代谢产物的产生。当阻断NA4主产物合成基因后,突变菌株代谢流发生改变,增加了其他代谢物的积累;同时,去除原主产物后简化了NA4菌株代谢产物分离过程中背景信息干扰,有利于微量化合物分离,提高新的化合物和微量化合物分离的几率,这一策略为微生物代谢产物的分离纯化提供了有益借鉴。本研究也进一步丰富了Streptomycescaverounsis代谢产物成分研究以及生物活性研究,为深入挖掘该菌潜在活性次级代谢产物提供了素材。

