不同抗性大麦品种对叶斑病的生理响应及主成分分析
黄志磊,李葆春,汪军成,姚立蓉,司二静,杨 轲,孟亚雄,马小乐,王化俊
(1.甘肃省干旱生境作物学重点实验室/甘肃省作物遗传改良与种质创新重点实验室,甘肃兰州 730070;2.甘肃农业大学农学院,甘肃兰州 730070;3.甘肃农业大学生命科学技术学院,甘肃兰州 730070)
根据Statista数据显示,截止2016年大麦在全球的种植面积和产量仅次于水稻、玉米和小麦,是第四大禾谷类作物[1],也是我国干旱和半干旱地区、气候偏冷凉地区重要的种植作物。在大麦生长发育过程中,常受各种病菌侵害造成产量损失或者降低品质,大麦叶斑病(Spot blotch)是大麦生长发育过程中常发生病害之一,是由禾旋孢腔菌[Cochliobolussativus,无性世代(Bipolarissorokiniana)]引起的一种真菌性病害。其病原菌可以侵染大麦根部、叶片和幼胚,引起根腐病、叶斑病和黑胚病。该病害在美国、加拿大、南亚、南非和我国内蒙古东部以及东北地区发病严重,发病田块减产幅度一般为20%。内蒙古呼伦贝尔市是我国三大啤酒大麦主产区之一,其大麦种植面积占内蒙古全区大麦面积的70%以上。近年来该地区大麦苗期根腐病及叶斑病危害严重,2012间大麦根腐病及叶斑病大爆发,导致大面积减产,根腐病和叶斑病已成为制约该地区大麦生产的重要病害之一[2]。目前还没有防治该病害的有效方法。国外在大麦抗叶斑病鉴定、抗病遗传资源利用等方面有较深入研究并取得重要进展。Lü等[3]用 14 479 菌株在苗期接种鉴定 205 份大麦种质资源,获得高抗叶斑病材料11份;Gyawali等[4]探究了摩洛哥和印度春大麦苗期和成株期斑点病抗性与全基因组的关联性;Burlakoti等[5]在美国中西部的六棱和二棱大麦育种中利用单核苷酸多态性(SNP)标记与全基因组关联研究的方法确定了相关联的10个抗性数量性状基因座(QTL)。目前,国内外尚未发现对叶斑病完全免疫的大麦品种。我国对玉米、胡麻、花生、香蕉等作物叶斑病的研究已相当深入,但是对于大麦叶斑病菌研究甚少,尤其是就叶斑病菌对大麦生理特性的影响研究。郭焕强等[2]利用21个Bipolarissorokiniana菌株接种鉴定78个具有代表性的大麦主栽生产品种和骨干亲本,并发现蒙啤麦3号的抗叶斑病能力强于蒙啤麦1号。植物的保护反应是复杂的新陈代谢过程,在受到病原物侵染后,抗、感品种之间PAL、PPO、POD、SOD以及其他重要酶类的活性变化有明显差异[6-9]。研究表明,寄主体内的防御酶POD、PAL和SOD活性变化是水稻抗链霉菌JD211的重要原因[10]。Pro、SS和MDA是植物应对逆境胁迫时在细胞中积累的通用渗透调节物质,在遭受胁迫时可以通过在细胞内积累这些物质,以达到降低细胞水势、维持细胞膜两侧渗透势平衡来抵抗逆境胁迫的目的[11]。植物在受病原物侵染时,会产生一些蛋白(pathogensis-related proteins,PR蛋白)以抵御病原菌的进一步侵染,其中CHT和 β-1,3-葡聚糖酶是两类重要的PR蛋白[12]。本研究在前人研究的基础上以大麦品种蒙啤麦1号(感病)与蒙啤麦3号(抗病)为材料,了解在被叶斑病菌侵染后不同抗性品种组织器官中各项生理指标变化,以期为以后大麦抗大斑病的基因挖掘和育种工作提供 参考。
1 材料与方法
1.1 供试材料
供试大麦品种为蒙啤麦1号(感病)与蒙啤麦3号(抗病)。大麦叶斑菌样选用甘肃农业大学麦类试验室甘南Z14484强侵染力菌株。
1.2 试验设计
试验于2018年4-7月在甘肃农业大学人工气候室进行。将土、沙、蛭石以3∶1∶1混合均匀,经121 ℃高压灭菌30 min。大麦种子用5%次氯酸钠溶液消毒30 min,然后用蒸馏水冲洗3次,每次5 min,继续温水浸种半小时。然后在培养皿中发芽,发芽后移栽到直径 7 cm 的小花盆中,在 22 ℃的温室中培养。待幼苗长到三叶期时,接菌植株用蒸馏水清洗叶片表面的蜡质层,最后将配置好的孢子悬浮液喷洒到叶片上,浓度为1×104个·mL-1(含0.25% Tween 20),一天喷施两次,连续接种三天,接种期间温室处于黑暗状态,接种温度为22 ℃,利用加湿器加湿,保持湿度100%;对照则是在相同条件下生长不接菌。于苗期、拔节期和孕穗期8:00采样(基生叶),每个品种的接菌处理和对照均设3次重复,每个重复种4株幼苗。同时,调查大麦对病害的反应型。反应型采用常规九级划分标准:1~3 级为高抗(R),4~5 级为中抗(MR),6~7 级为中感(MS),8~9 级为高感(S),用“+”和“-”表示实际反应型比相应各级标准反应型高或低。
1.3 生理指标测定
SOD活性采用NBT光还原法测定[13],POD活性采用愈创木酚法测定[13],CAT活性采用紫外吸收法测定[13],MDA含量采用硫代巴比妥酸法测定[13],游离脯氨酸(Pro)含量采用茚三酮法测定[13],PPO活性采用邻苯二酚法测定[14],PAL活性采用苯丙氨酸脱氨法测定[14],LOX活性采用亚油酸钠分光光度法测定[14],CHT活性采用二甲氨基苯甲醛法测定[14], β-1,3-葡聚糖酶活性采用3,5-二硝基水杨酸(DNS)法测定[14],SS含量采用蒽酮比色法测定[14]。
1.4 数据统计分析
数据的处理和统计分析分别采用WPS、EXCEL和SPSS软件,采用Duncan's法进行多重比较(α=0.05)。
2 结果与分析
2.1 大麦品种的抗病性差异
接菌后,苗期、拔节期和孕穗期蒙啤麦1号反应型分别为2+、6、8,而蒙啤麦3号分别为1-、1、3,蒙啤麦3号上的菌斑生长速度与大小均弱于蒙啤麦1号(图1),说明蒙啤麦3号对叶斑病抗性较蒙啤麦1号强,这与郭焕强等[15]的结论相符,也表明本研究的选材符合试验要求。
2.2 接菌后大麦叶片抗氧化酶活性的变化
2.2.1 SOD活性变化
接菌后,蒙啤麦1号和蒙啤麦3号苗期和拔节期的叶片SOD活性较对照均显著升高(图2A),其中苗期增幅分别为5.4%和3.8%,拔节期分别为1.2%和11.1%;孕穗期,蒙啤麦1号SOD活性变化不显著,蒙啤麦3号显著升高,增幅为11.6%。
2.2.2 POD活性变化
接菌后,蒙啤麦1号与蒙啤麦3号的POD活性在三个时期较对照均有所提高,其中在拔节和孕穗期达到显著水平(图2B),蒙啤麦1号这两个时期的增幅分别为24.6%和72.4%,而蒙啤麦3号分别为29.9%和152.8%。

图1 接菌后蒙啤麦1号和蒙啤麦3号的表型观察
2.2.3 CAT活性变化
接菌后,蒙啤麦1号与蒙啤麦3号的CAT活性在苗期较对照有所下降,在拔节期和孕穗期较对照均显著升高(拔节期蒙啤麦1号除外)(图2C),拔节期两个品种的CAT增幅分别为10.4%和 52.6%,孕穗期分别为70.1%和65.7%。
2.2.4 PPO活性变化
接菌后,蒙啤麦1号与蒙啤麦3号三个时期的PPO活性较对照均增加(图2D),其中蒙啤麦1号苗期变化不显著,蒙啤麦3号变化显著(增幅为5.3%),在其余两个时期两个品种均变化显著。在拔节期,两个品种的增幅分别为47.0%和86.8%,孕穗期分别为88.7%和183.8%。
2.2.5 LOX活性变化
接菌后,蒙啤麦1号与蒙啤麦3号的LOX活性在三个时期均较对照升高,其中拔节期和孕穗期的接种处理与对照差异均显著,两个品种的增幅在拔节期分别为31.1%和58.4%,孕穗期分别为11.9%和22.6%。

MP1:蒙啤麦1号;MP3:蒙啤麦3号。图柱上的不同字母表示每个时期处理间在0.05水平上差异显著。下图同。
MP1:Mengpimai 1;MP3:Mengpimai 3.Different letters above the columns are significantly different between the treatments at the 0.05 probability level at same stage. The same in other figures.
图2 接菌后蒙啤麦1号和蒙啤麦3号抗氧化酶活性的变化
Fig.2 Activity changes of the antioxidant enzymes of Mengpimai 1 and Mengpimai 3 inoculated leaf spot pathogen
2.3 接菌后大麦叶片Pro、SS和MDA含量的变化
接菌后,蒙啤麦1号和蒙啤麦3号的Pro、SS和MDA含量在三个时期均不同程度增加,而且在大部分情况下,接菌处理与对照的差异均达到显著水平。其中,两个品种的Pro含量增幅在拔节期分别为96.2%和159.2%,在孕穗期分别为 250.2%和280.7%;SS含量的拔节期增幅分别为48.0%和43.4%,孕穗期分别为43.1%和164.7%;MDA含量的苗期增幅分别为10.9%和21.0%,拔节期增幅分别为8.5%和34.2%。
2.4 接菌后大麦叶片抗病相关酶活性的变化
接菌后,两个品种的β-1,3-葡聚糖酶和PAL活性在苗期、拔节期和孕穗期均较对照显著增加(图4A和图4C)。其中,蒙啤麦1号的 β-1,3-葡聚糖酶活性在三个时期的增幅分别为165.4%、161.1%和155.9%,蒙啤麦3号分别为268.9%、243.2%和95.5%;蒙啤麦1号的PAL活性增幅在三个时期分别为141.4%、48.5%和208.1%,蒙啤麦3号分别为14.1%、76.7%和151.9%。两个品种的CHT活性在接菌后变化较小(图4B),只有蒙啤麦1号在拔节期变化显著,增加21.1%。
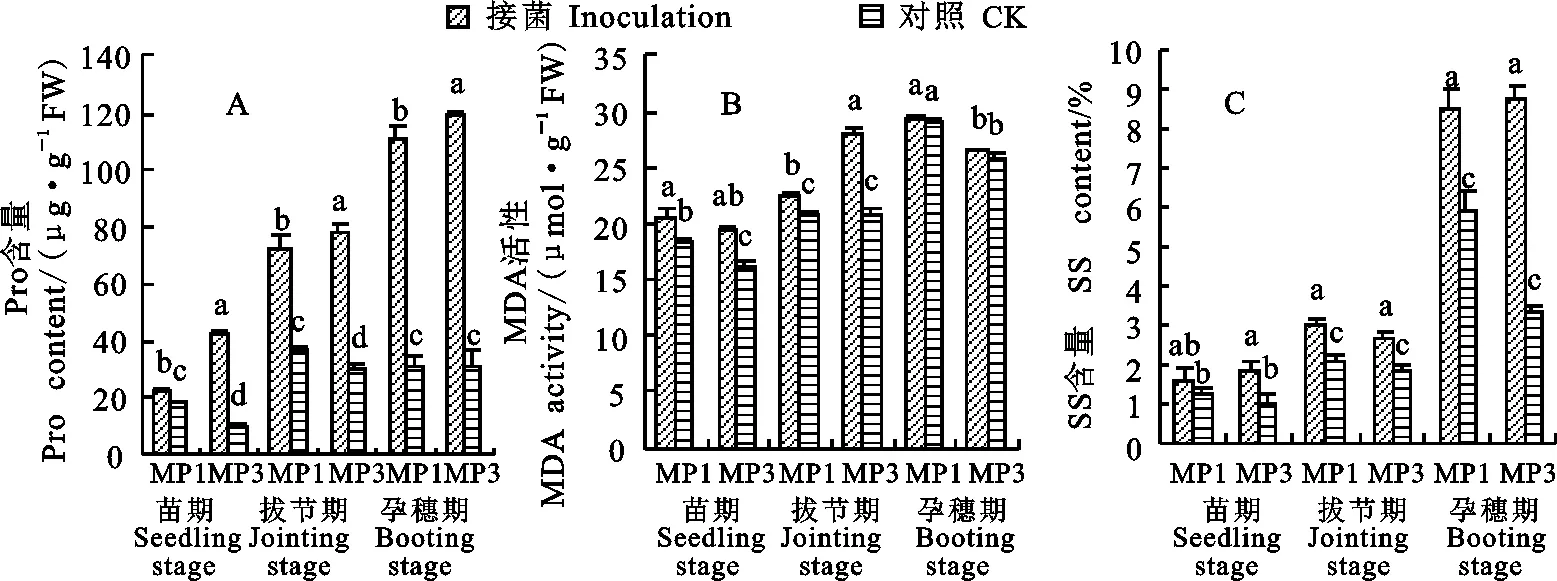
图3 接菌后蒙啤麦1号和蒙啤麦3号Pro、SS和MDA含量的变化
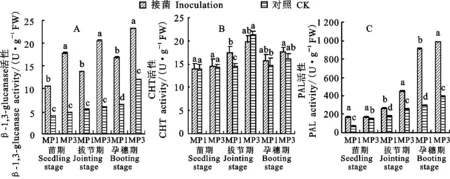
图4 接菌后蒙啤麦1号和蒙啤麦3号其他相关酶的变化
2.5 主成分分析
从以上分析结果可以看出,接菌后两个品种的11个指标在不同时期的变化不同。为了得到更准确结果,本研究对数据进一步进行了主成分分析。结果表明,特征值大于1的主成分有四个,且这四个成分的方差贡献率和达到了 96.313%(表1和图5),说明这四个主成分囊括了11个生理指标所含的绝大部分信息。其中,第一主成分主要包括了SS含量、POD活性和PAL活性的信息,第二主成分主要包括了 β-1,3-葡聚糖酶活性的信息,第三主成分主要包括了LOX活性的信息;第四主成分主要包括了PPO活性的信息。以上信息表明,可选用SS含量、POD活性、PAL活性、 β-1,3-葡聚糖酶活性、LOX活性和PPO活性6个指标来评价大麦的抗叶斑病能力。表2列出了两个品种三个时期11 个生理指标的主成分载荷。

表1 大麦各生理指标对抗病性影响的主成分方差贡献率Table 1 Variance of principal component variance of physiological indices of barley against disease
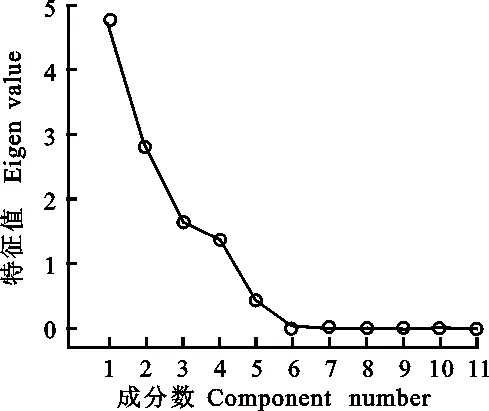
图5 主成分的碎石图
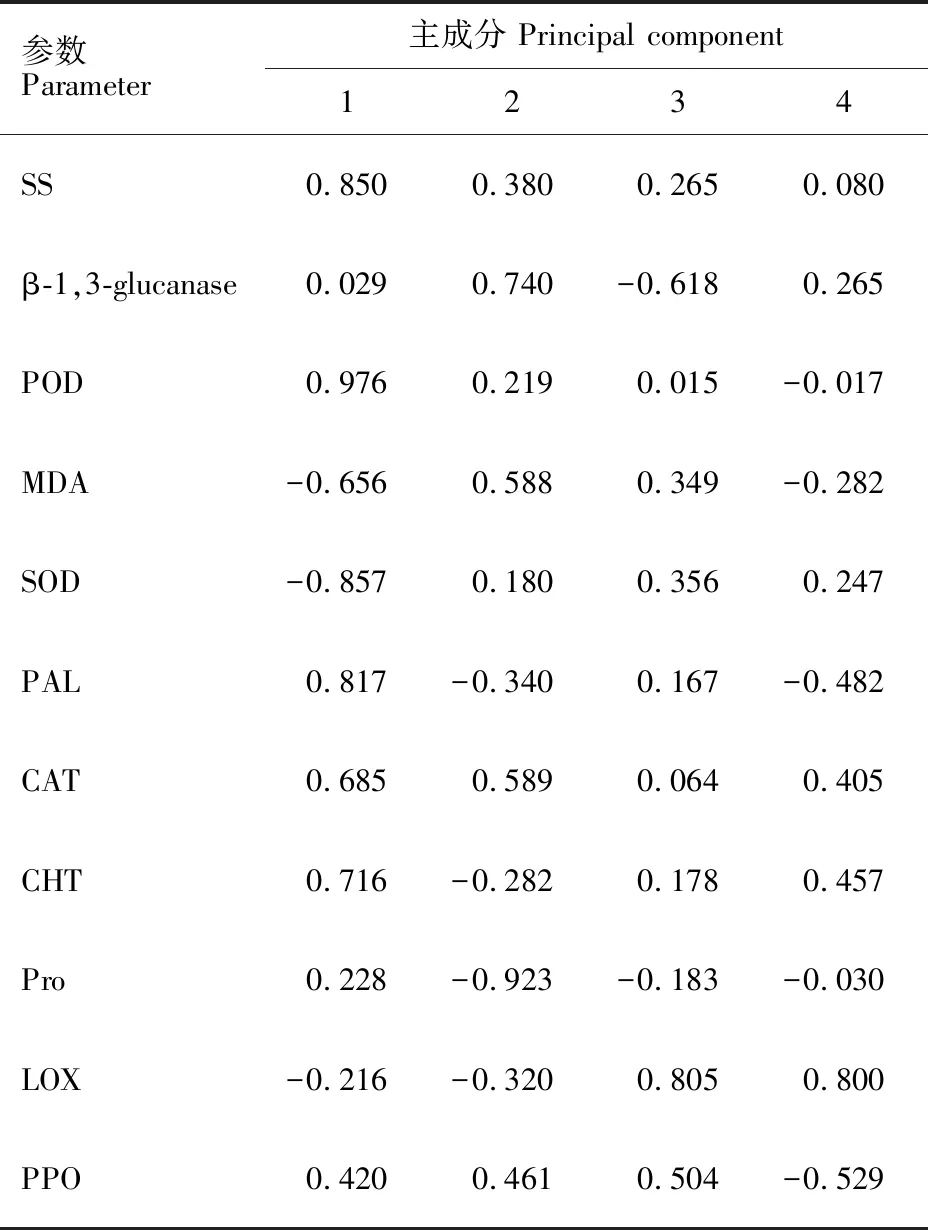
参数Parameter主成分 Principal component1234SS0.8500.3800.2650.080 β-1,3-glucanase0.0290.740-0.6180.265POD0.9760.2190.015-0.017MDA-0.6560.5880.349-0.282SOD-0.8570.1800.3560.247PAL0.817-0.3400.167-0.482CAT0.6850.5890.0640.405CHT0.716-0.2820.1780.457Pro0.228-0.923-0.183-0.030LOX-0.216-0.3200.8050.800PPO0.4200.4610.504-0.529
3 讨 论
植物的抗逆性与其体内的酶类活性和化合物含量关系密切。ROS是植物体内一种重要的信号分子,但它同时也会对植物造成毒害,尤其在逆境中ROS迅速富集。因此,植物在长期适应过程中,为了响应和防御外界不良环境造成的氧化胁迫,植物形成了自己的一套调节及解毒机制,可分为回避机制和清除机制。其中清除机制包括酶促清除,如SOD、CAT、POD等,以及非酶类清除系统,包括细胞色素C、谷胱甘肽、甘露醇、抗坏血酸、不饱和脂肪酸等[19]。本试验中,蒙啤麦1号和蒙啤麦3号在受到叶斑病菌侵害时,所测的氧化还原类酶活性都发生改变。随着胁迫时间的增长,病害加剧,SOD、POD、LOX和PPO活性升高幅度逐渐增加,且抗病品种蒙啤麦3号升高幅度均大于感病品种蒙啤麦1号,这与汪宝卿等[20]的研究结果一致。接菌处理CAT活性较对照先降后升,可能是由于品种自身特性决定的。通过主成分分析,POD、LOX与PPO活性在抗叶斑病方面贡献率最大,可为以后抗、感品种的筛选与鉴定提供参考。
植物在长期的进化过程中发展出了一系列细胞内源通用非生物胁迫应答机制,通过应激代谢反应在细胞内大量积累一些有机小分子化合物和多肽类物质(Pro等)来降低原生质水势,调节逆境胁迫条件下细胞膜两侧渗透势平衡,以有效应对不利环境条件对植物生理代谢系统造成的损害[21]。MDA是膜脂过氧化的分解产物,其含量的高低可反映植物受到损伤的程度。因此植物的Pro、SS和MDA含量也通常被视为衡量不同植物对非生物胁迫耐受能力的关键指标。本研究中,供试材料的Pro、MDA、SS 含量在染菌后均不同程度增加,这与张雯莉等[22]的研究结果相同。通过主成分分析发现,蒙啤麦1号与蒙啤麦3号对叶斑病在渗透调节方面的抵御主要通过SS的积累来实现。
PAL参与木质素与植保素的合成,可以增加细胞壁的厚度,提高组织木质化程度,形成病原菌入侵的物理屏障[23]。高等植物体内广泛存在着 β-1,3-葡聚糖酶和CHT。葡聚糖和几丁质是真菌细胞壁的主要成分,而大多数真菌的菌丝顶端葡聚糖酶和几丁质暴露在表面,能够直接受到 β-1,3-葡聚糖酶和CHT的作用,从而刺激寄主植物的抗病反应,而且CHT和 β-1,3-葡聚糖酶协同作用更能抑制病原菌的侵害[24]。本试验也再次证实了该结论。在所测病害相关酶类中,接菌后PAL和 β-1,3-葡聚糖酶活性均呈上升趋势,其中 β-1,3-葡聚糖酶与PAL的贡献率最高,起主导作用,此结果与龙艳玲等[25]研究结论一致。
麦根腐平脐蠕胞菌(B.sorokiniana)是兼性寄生真菌[26]。大麦抗叶斑病品种蒙啤麦3号、感叶斑病品种蒙啤麦1号在受病菌侵染后各项生理指标均发生变化。从所测11个生理指标综合表现看,抗病品种蒙啤麦3号本身的自我调节能力和抵御机制明显强于感病品种蒙啤麦1号。但是,CAT的苗期活性变化与前人研究不一致,可能是由于大麦在各生育时期的抗性会发生改变造成[27]。如小麦、大麦和燕麦对白粉、锈病以及水稻对白叶枯病等病害的抗性表现,其抗性从苗期开始表达,会持续至整个生育期,但苗期抗性与全生育期抗性也会存在不一致的情况,在苗期表现为感病,但在成株期却具有高水平抗性,或苗期抗病,在成株期却表现为感病[28]。可见,不同抗性品种在不同时期的生理特性存在差异,染菌条件下,POD活性、LOX活性、PPO活性、SS含量、PAL活性与 β-1,3-葡聚糖酶活性可作为筛选抗叶斑病大麦的参考指标。

