儿童颅内幕上胚胎性肿瘤的治疗及预后分析
侯栋梁 房彤 宋丽楠 孙保锦 陈力 杨慧 刘博
2016年世界卫生组织(WHO)对2007年版中枢神经系统(central nervous system,CNS)肿瘤分类进行修订,按照分子遗传学特征相似性的原则,对CNS肿瘤进行重新分类。在2007年版的基础上对大多数CNS 肿瘤增加了分子分型。其中变化最大的是神经上皮起源肿瘤中的胶质瘤和胚胎性肿瘤[1-2]。新版CNS 肿瘤分类中,将胚胎性肿瘤独立分为一个大类,而不再将其作为神经上皮起源肿瘤的亚类。新版CNS 胚胎性肿瘤分类中淘汰了CNS 原始神经外胚层肿瘤(primitive neuroectodermal tumor,PNET)及其亚型室管膜母细胞瘤的命名。PNET 是一种比较少见的小圆细胞恶性肿瘤,可发生于中枢神经系统神经上皮细胞和外周的间叶组织。根据肿瘤发生的部位不同,可分为中枢型(central PNET,cPNET)和外周型(peripheral PNET,pPNET)两种[3-4]。2007年版CNS肿瘤分类中,原命名为cPNET的肿瘤,在新版分类中根据C19MC 基因有无扩增或融合,将cPNET 部分并入有多层菊型团的胚胎性肿瘤,另一部分则升级为CNS胚胎性肿瘤或CNS胚胎性肿瘤,NOS。由于该类颅内肿瘤发病率较低,大宗病例报道少见,因此对该类疾病的认识不足,目前对其临床特点、治疗方案以及疗效缺乏认识。本研究回顾性分析了首都医科大学附属北京世纪坛医院放疗科2011年5月至2018年12月收治的27 例年龄18 岁以下行术后放疗的儿童颅内幕上胚胎性肿瘤的患儿资料,对其临床特点和治疗效果进行分析,现报道如下。
1 材料与方法
1.1 临床资料
2011年5月至2018年12月首都医科大学附属北京世纪坛医院放疗科收治的27 例年龄18 岁以下行术后放疗的儿童颅内幕上胚胎性肿瘤患儿,其中男性17例,女性10例;中位年龄7(3~16)岁(表1)。术后病理按2007年第4版CNS 肿瘤分类的命名均确诊为PNET,复阅病理,按2016年CNS 肿瘤分类命名均确诊为胚胎性肿瘤。肿瘤位置位于大脑半球22 例,位于脑室内5 例。术中肿瘤全切12 例,次全切15例。患儿放疗前均行全脊髓增强MR 确定无脊髓内播散。患儿术后1个月内行全脑全脊髓放疗,全脑全脊髓放疗结束后行瘤床区加量放疗。其中22例患儿放疗结束后行化疗。
1.2 放疗方法及照射剂量
患儿取俯卧位,采用额颏枕和体部垫板,全脑照射采用左右两侧野等中心对穿照射,下界在第4颈椎下缘水平,上界开放至颅骨外3 cm,每照射10 Gy,全脑照射野在y轴方向上、下各缩小1 cm。脊髓照射野采用俯卧位,电子线垂直照射,根据脊髓长度分上下两段,两段中间间隔1 cm,上界为全脑射野的下界,下界在骶4 下缘水平,两侧外界在椎弓根的外缘,男性患儿骶骨区域采用铲形野垂直照射,女性患儿为保护卵巢骶骨区域采用等中心两侧水平对穿照射。脊髓野每照射10 Gy向头侧移动1 cm,并保持与全脑照射野有1 cm间隙。放疗剂量每周5次,1.7~1.8 Gy/次,全脑全脊髓照射27.0~30.6 Gy后缩野至瘤床区,加量照射至55.8~60.0 Gy。
1.3 随访
患儿放疗结束后每3个月(2年以内)或每6个月(2~5年)复查颅脑±全脊髓MRI。采用门诊随访及电话随访,随访时间从手术之日开始计算,随访截止日期为2019年1月15日。
2 结果
2.1 治疗完成情况
27例患儿均完成术后全脑全脊髓放疗。全脑全脊髓放疗剂量为27.0~30.6 Gy,瘤床区加量照射至55.8~60.0 Gy。22例患儿放疗结束后行化疗,化疗方案为伊立替康+长春新碱+依托泊苷+奈达铂。
2.2 随访及预后
截至末次随访时间2019年1月15日,中位随访时间22(4~93)个月,27例患儿死亡18例,9例生存。
死亡患儿中颅内复发8 例,8 例患儿中均为颅内瘤床外复发,瘤床区内未见肿瘤复发。脊髓播散10例,10例脊髓播散患儿中3例患儿行肿瘤转移部位补量照射,其余7 例患儿未行进一步治疗。3 例行补量照射的患儿均在半年内死亡。7 例未行进一步治疗的患儿均在脊髓转移后3个月内死亡。
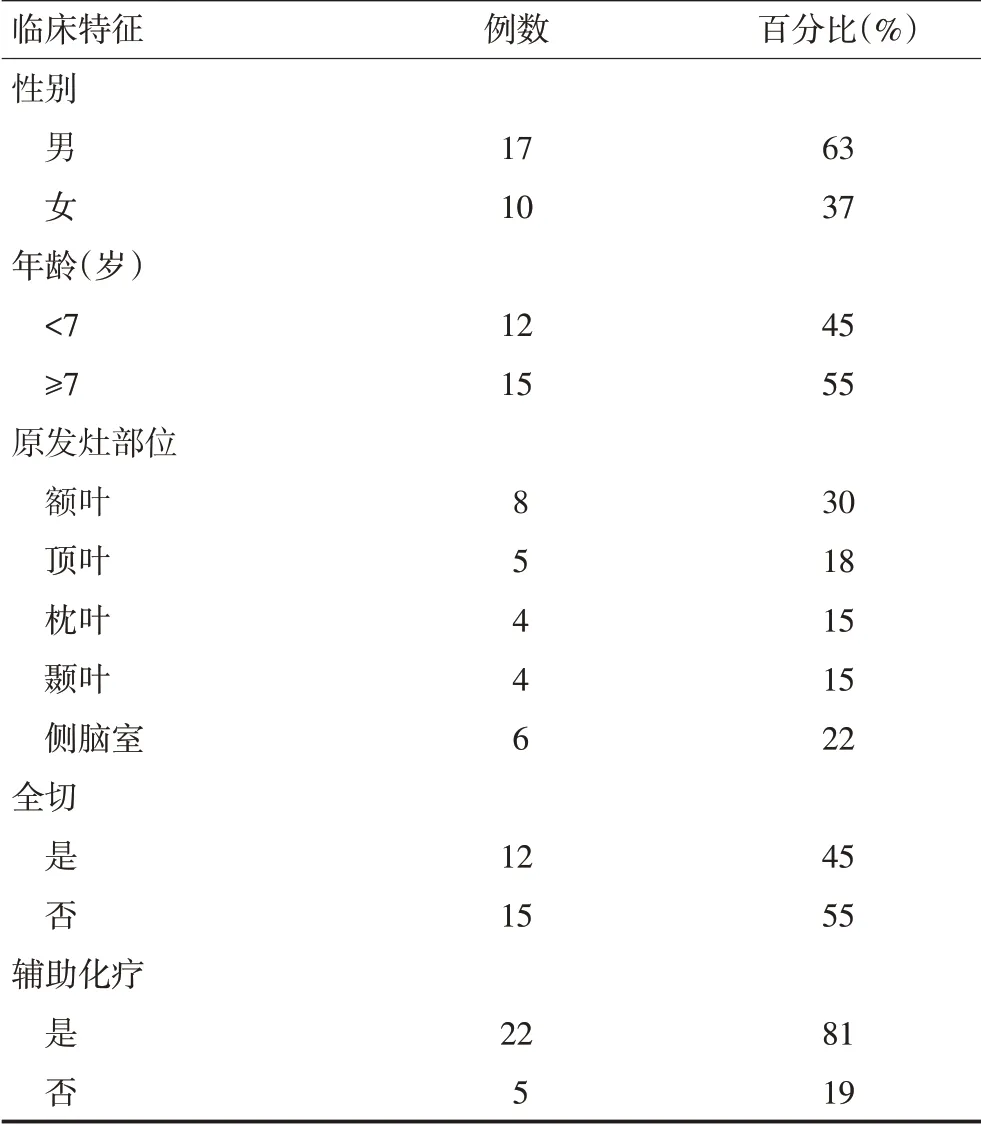
表1 27例颅内幕上胚胎性肿瘤患儿临床资料
9例生存患儿为持续完全缓解状态,未见颅内及脊髓复发。1、3、5年生存率分别为79.4%、50.2%、36.5%。5例患儿行术后单纯放疗,均在放疗结束后3年内死亡。除5例仅行术后放疗的患儿,22例完成所有治疗(手术+放疗+化疗)患儿1、3、5年生存率分别为85.0%、60.4%和43.0%。
3 讨论
CNS 胚胎性肿瘤是一类主要发生于儿童和青少年的高度恶性的肿瘤类型,WHO 组织学分级为Ⅳ级。2007年第4版CNS肿瘤分类中,CNS胚胎性肿瘤主要包含3 大类肿瘤:髓母细胞瘤、cPNET 和非典型畸胎样/横纹肌样瘤(AT/RT)。而在2016年WHO 的CNS肿瘤分类修订版中,废除cPNET及其亚型室管膜母细胞瘤的命名,重新命名2007 版中的cPNET 及其亚型(CNS 神经母细胞瘤、CNS 神经节细胞神经母细胞瘤、髓上皮瘤和室管膜母细胞瘤)[5]。2016年新版CNS 胚胎性肿瘤新增多层菊型团的胚胎性肿瘤(ETMR)和有横纹肌瘤样特征的CNS 胚胎性肿瘤。将2007 版中的cPNET 根据C19MC 基因扩增或融合情况,进行了重新分类:1)将有C19MC基因扩增或融合的髓上皮瘤和室管膜母细胞瘤并入ETMR 的C19MC变异型;2)将不存在C19MC 基因扩增或融合的室管膜母细胞瘤并入ETMR的NOS型;3)将CNS神经母细胞瘤、CNS 神经节细胞神经母细胞瘤及不存在C19MC基因扩增或融合的髓上皮瘤由cPNET的亚型升级为CNS 胚胎性肿瘤的独立亚类;4)将发生于小脑以外的颅内无其它CNS肿瘤组织学和分子遗传学变异特征的cPNET 重新命名为“CNS 胚胎性肿瘤,NOS”[2]。因此“CNS 胚胎性肿瘤,NOS”主要涵盖了2007年第4版中的cPNET经典型。
本研究中的CNS胚胎性肿瘤主要是指2007年第4 版中的cPNET 这一类型的肿瘤。在2016年新版分类命名出现之前,一直沿用的是cPNET 这一病理学诊断,而新版分类出现之后,cPNET被“CNS胚胎性肿瘤”代替。由于该类型肿瘤发病率低,而恶性度极高,临床医师对其临床特点认识不足,从而导致治疗强度不足,患儿预后较差。本研究总结了行术后放疗的27 例CNS 胚胎性肿瘤患儿的临床资料,主要是2007年第4 版CNS 肿瘤分类中的cPNET 这一肿瘤类型,复阅患儿病理资料,按照2016年版CNS肿瘤分类修订版命名原则,可以确诊“CNS胚胎性肿瘤“。由于颅内胚胎性肿瘤来源于胚胎神经上皮细胞,因此主要发生在儿童,成人少见。有研究认为该类肿瘤在新生儿颅内肿瘤中的发病率较高[6-7]。本研究入组的研究对象主要是术后放疗的患儿,年龄3岁以下的患儿无法配合术后放疗,因此在27例患儿中,中位发病年龄为7岁,最小的患儿年龄为3岁。患儿的临床表现无特异性,主要与占位效应导致的颅内压增高有关系,大多数患儿因颅内压增高导致的头痛、头晕、恶心和呕吐为首发症状起病。根据肿瘤累及的颅内不同部位会导致相应的症状,如视力下降、视野缩小和肢体功能障碍、运动不利等临床症状[8]。肿瘤可以发生于颅内的任何部位,好发生于大脑凸面,侧脑室旁,中线附近,灰白质交界区多见,位置深在,容易侵犯深部白质或者核团结构。肿瘤形态不规则,边界清楚,瘤周水肿相对较轻,或者无明显瘤周水肿区。
CNS 胚胎性肿瘤影像学上表现有一定的特征性。首先肿瘤体积较大,肿瘤平均直径(5.2±1.6)cm。肿瘤颅内发病部位以幕上居多,CT 平扫呈稍高密度。肿瘤多有浅分叶,MR 扫描T1WI 图像上多为不均匀较低信号,T2WI为等或者高信号,由于肿瘤恶性度高,生长较快,因此常伴有坏死或者囊变区。可伴有出血或者钙化,增强扫描可见不均匀强化。因此,对于发生在儿童颅内幕上的体积较大的肿瘤,形态不规则,CT 平扫显示较高密度,MR 图像上表现为混杂信号,增强扫描可见明显强化,肿瘤内部可见坏死或囊性变,此时多考虑胚胎性肿瘤的可能性大。
2016 版CNS 肿瘤分类修订版中,CNS 胚胎性肿瘤包括以下4 类肿瘤[9]:1)髓母细胞瘤;2)ETMR;3)CNS胚胎性肿瘤的独立亚类;4)AT/RT以及有横纹肌样特征的CNS 胚胎性肿瘤。对于髓母细胞瘤的治疗,目前公认的治疗手段是最大程度的肿瘤切除,术后辅以放化疗[10]。而对于除髓母细胞瘤以外的其他CNS胚胎性肿瘤的治疗,其治疗手段与髓母细胞瘤类似,均以手术为基础的放化疗综合治疗。最大程度的切除肿瘤是综合治疗前提。由于胚胎性肿瘤容易沿脑脊液播散[11],因此术后行辅助放化疗前应完善患儿的全脊髓增强MR 检查,以明确有无脊髓转移。一旦出现脊髓转移,则患儿的预后较差,多数1年内死亡。若未出现脊髓转移,则要进行全脑全脊髓放疗和辅助化疗。本研究27 例术后行放化疗的患儿,术后放化疗前行全脑全脊髓检查均未发现脊髓转移,治疗方案是行全脑全脊髓照射27.0~30.6 Gy,全中枢照射结束后行颅内瘤床区加量照射至55.8~60.0 Gy。放疗结束后继续行全身化疗。而对于出现脊髓转移的患儿,一般建议行全脑全脊髓照射36.0 Gy,然后行瘤床区加量照射至55.8~60.0 Gy后行全身化疗。对于ETMR这一类CNS胚胎性肿瘤的治疗,由于ETMR 发病率低,目前世界上仅有近百例的报道[12],并且属于2016版CNS肿瘤分类修订版中新增的肿瘤类型,因此对于该类疾病的治疗认识有限,可以借鉴其他CNS 胚胎性肿瘤的治疗方式[13],即最大程度的肿瘤切除,术后行辅助放化疗。对于AT/RT以及有横纹肌样特征的CNS 胚胎性肿瘤的治疗,与其他类型的CNS 胚胎性肿瘤的治疗类似,不再赘述。目前国际上对于胚胎性肿瘤的放疗剂量无统一的标准,颅内胚胎性肿瘤的生物学特点和髓母细胞瘤不同,因此不能完全照搬髓母细胞瘤的放疗剂量。本研究中,8例患儿放疗后出现颅内复发,这8例患儿均为颅内瘤床外复发,瘤床区内未见肿瘤复发。10 例出现脊髓播散。由此可见,瘤床区55.8~60.0 Gy 的放疗剂量是足够的,因为未出现瘤床区内肿瘤复发的情况。而对于全脑全脊髓的最佳放疗剂量,既要考虑到肿瘤的控制情况,又要考虑尽量减少放射线对患儿发育的影响,很难找到一个理想的平衡点。10 例放疗后出现脊髓播散的患儿,很可能和放疗剂量、化疗强度和周期数不足有关系。因此最佳的放疗剂量和化疗方案以及周期数还需要进一步开展临床试验进行研究。
有关CNS 胚胎性肿瘤的预后,从目前的文献报道来看,对于不伴有脊髓转移的CNS 胚胎性肿瘤来讲,髓母细胞瘤的预后相对较好[14],ETMR 预后最差[15],其他类型的CNS 胚胎性肿瘤的预后介于上述两者之间。而一旦出现脊髓的转移,则预后极差。本研究27 例患儿中,复发者与生存者初始治疗的临床特点,主要包括肿瘤的位置、大小两组之间无差别,由于是在同一神经外科中心、同一手术团队进行的手术,因此手术切除程度两组也未见差别。而放疗剂量和化疗疗程有差别。对于年龄较小的患儿,为避免放射线给患儿带来的不良影响,应尽量给予更多周期的化疗,而减少全脑全脊髓的照射剂量。而对于年龄在12 岁以上的患儿,可以适当增加全脑全脊髓的照射剂量。本研究发现,复发患儿的全脑全脊髓的照射剂量普遍低于生存患儿。另外复发患儿与生存患儿化疗周期数的多少也有差别,复发患儿化疗周期数少于生存患儿。由于患儿经历手术和放疗,部分身体状况较差者无法耐受多周期化疗,而这部分化疗周期数比较少者容易出现复发。生存者大部分都是经过多个周期化疗的患儿。本研究27例患儿中有22 例行术后放疗+化疗,5 例患儿仅行术后放疗而未行辅助化疗。22 例完成所有治疗(完成手术+放疗+化疗)的患儿疗效好于仅行术后放疗的患儿。9 例生存的患儿均为术后行放疗+化疗的患儿。因此在儿童颅内幕上胚胎性肿瘤的治疗中,手术和术后辅助放化疗的综合治疗模式意义重大。然而目前国际上对于颅内胚胎性肿瘤的最佳的放疗剂量和化疗方案以及周期数还缺乏高级别的证据,还需要进一步开展相关临床试验进行研究。
综上,在临床工作中,对于该类高度恶性的儿童颅内肿瘤,应采取较为积极的治疗措施,最大程度地切除肿瘤,术后行辅助放化疗,以延长患儿的生存期。

