基于磁共振成像乳腺癌远处转移预测模型的研究*
汤加 马文娟 刘君君 邵真真 刘佩芳
乳腺癌是世界范围内最常见的女性恶性肿瘤[1],发生远处转移,临床分期为Ⅳ期患者的预后较差[2]。早期发现可能发生远处转移的乳腺癌,有利于制定个体化治疗方案[3],从而对预测生存期[4]、改善预后具有一定意义。传统的乳腺癌远处转移预测模型包括的预测指标一般为临床及病理等[5],而基于乳腺磁共振成像(magnetic resonance imaging,MRI)的远处转移预测模型少有报道。本研究旨在对病理或随访证实转移性乳腺癌和同期未发生转移患者的MRI影像特征进行分析,建立基于平扫MRI和动态对比增强(dynamic contrast enhanced,DCE)-MRI影像特征参数的预测模型,探讨该模型对预测乳腺癌远处转移的价值。
1 材料与方法
1.1 病例资料
回顾性分析2011年1月至2016年12月3 032例于天津医科大学肿瘤医院行乳腺MRI检查患者的临床资料,根据纳入标准筛选出转移组93例和非转移组186例。93例转移组中转移病灶行穿刺证实13例、术后病理证实4例、行影像学检查及随访证实76例,其中92例有分子分型、1例无分子分型;186例非转移组从符合纳入标准的患者中随机抽取未发生远处转移者,均有分子分型。患者均为女性,转移组年龄为19~71岁,非转移组年龄为25~76岁。转移组中浸润性导管癌为83例、浸润性微乳头状癌为4例、浸润性小叶癌为2例、黏液癌为2例、浸润性乳头状癌为2例;非转移组中浸润性导管癌为178例、浸润性筛状癌为4例、浸润性导管癌伴鳞状细胞分化为1例、小管癌为1例、浸润性微乳头状癌为1例、黏液癌为1例。纳入标准:1)具有完整乳腺MRI影像资料,图像质量符合诊断标准;2)乳腺内病灶经手术病理证实为浸润性癌;3)手术前后均按照乳腺癌诊治规范处置并定期行胸部CT、腹盆部超声检查、骨扫描检查,有脑部症状者行脑MRI检查。
1.2 方法
1.2.1 MRI检查方法 采用Hdxt Echo1.5T MR扫描仪或Discovery 750 3.0T MR扫描仪(美国GE公司)进行检查。采用乳腺专用8通道相控表面线圈,患者取俯卧位,双乳自然下垂于线圈中。平扫采用横断面FSE T1WI序列(TR 622 ms,TE10 ms)及脂肪抑制T2WI 序列(TR 6 330 ms,TE 68 ms),层厚4.5 mm,层间距0.5 mm,矩阵384×224,激励次数(NEX)2。针对乳腺的DCE-MRI检查,采用优化的三维快速梯度回波序列双侧乳腺矢状面容积成像技术(volume imaging for breast assessment,VIBRANT),TR 6.1 ms,TE 2.9 ms,反转角15°,矩阵256×128,视野(FOV)26 cm×26 cm,层厚1.8 mm,NEX 1。在注射对比剂前先扫蒙片,后由高压注射器经手背静脉以团注方式注入对比剂Gd-DTPA,剂量为0.2 mL/kg,速率为2.0 mL/s,后注射等量生理盐水,即刻连续扫描延迟至8 min,单期扫描时间60~90 s。
1.2.2 MRI影像特征提取 MRI图像经2位医师回顾性复习和处理,采用Functool软件在AW 4.6工作站(美国GE公司)测量数据。MRI图像根据美国放射学院制定的2013版乳腺影像报告和数据系统(BI-RADS)进行分析[6]。分析MRI图像定性指标:病变类型、纤维腺体类型、背景强化、是否多发、强化方式、T1WI及T2WI信号均匀度、时间-信号强曲线(time-signal intensity curve,TIC)类型及病灶最大径。多灶性病变选最大者进行分析。选择病变最大层面勾画感兴趣区(region of interest,ROI),避开囊变及坏死区域,ROI略小于病变范围。
1.2.3 预测模型建立与验证 2011年1月至2014年12月221例患者(转移组75例、非转移组146例)为训练集建立模型,2015年1月至2016年12月58例患者(转移组18例、非转移组40例)为测试集验证模型的准确性。建立乳腺癌远处转移预测模型,公式为y=α+β1x1+β2x2+……+βnxn,二分类变量赋值0或1,建立哑变量病变类型a、b代表病变类型并赋值0或1。
1.2.4 随访 转移组和非转移组中位随访时间分别为51和45个月,随访期间转移组93例中5例患者死亡。随访时间从术后第1次检查截至2018年9月。
1.3 统计学分析
采用R 软件进行统计学分析。连续变量采用Kolomogorov-Smirnov检验行单因素分析,符合正态分布及方差齐性采用t检验,否则采用Mann-Whitney U检验,离散变量采用χ2检验或Fisher's 精确检验。采用Logistics回归分析进行多因素分析。模型采用准确率、敏感度、特异度、受试者工作特征曲线(receiver operating characteristic,ROC)下面积(area under receiver operating characteristic curve,AUC)进行评价。以P<0.05为差异具有统计学意义。
2 结果
2.1 转移组不同分子分型乳腺癌与远处转移关系
转移组93例发生单器官、多器官转移分别为58、35例。93例中有52例(55.9%)骨、骨髓转移,36例(38.7%)肺脏、胸膜转移,30例(32.3%)肝脏转移,15例(16.1%)脑、脑膜转移,8例(8.6%)腹膜、卵巢等其他部位转移。93例中Luminal A型12例,发生骨、肺脏、肝脏、脑、其他部位转移分别为7(58.3%)、2(16.7%)、2(16.7%)、4(33.3%)、2(16.7%)例;Luminal B型48例,发生上述部位转移分别为34(70.8%)、19(39.6%)、15(31.3%)、7(14.6%)、2(4.2%)例;HER-2过表达型14例,发生上述部位转移分别为3(21.4%)、6(42.9%)、9(64.3)、1(7.1%)、2(14.3%)例;三阴性乳腺癌18例,发生上述部位转移分别为7(38.9%)、9(50.0%)、4(22.2%)、3(16.7%)、2(11.1%)例;1例无分子分型,发生骨转移。
2.2 转移组与非转移组MRI表现特征比较
对MRI表现特征行单因素分析,结果显示病变类型(P<0.001)、是否多发(P<0.001)、T1WI及T2WI信号均匀度(P=0.005及P=0.008)在转移组与非转移组间差异具有统计学意义(表1)。其中病灶最大径为偏态分布,采用Mann-Whitney U检验,方差齐性结果为0.178,转移组和非转移组的中位病灶最大径分别为5.6 cm和2.6 cm(P<0.001)。
将单因素分析结果纳入多因素Logistics 回归分析,结果显示病变类型、是否多发、T2WI 信号均匀度和病灶最大径为独立预测因子(P<0.05,图1,表2)。
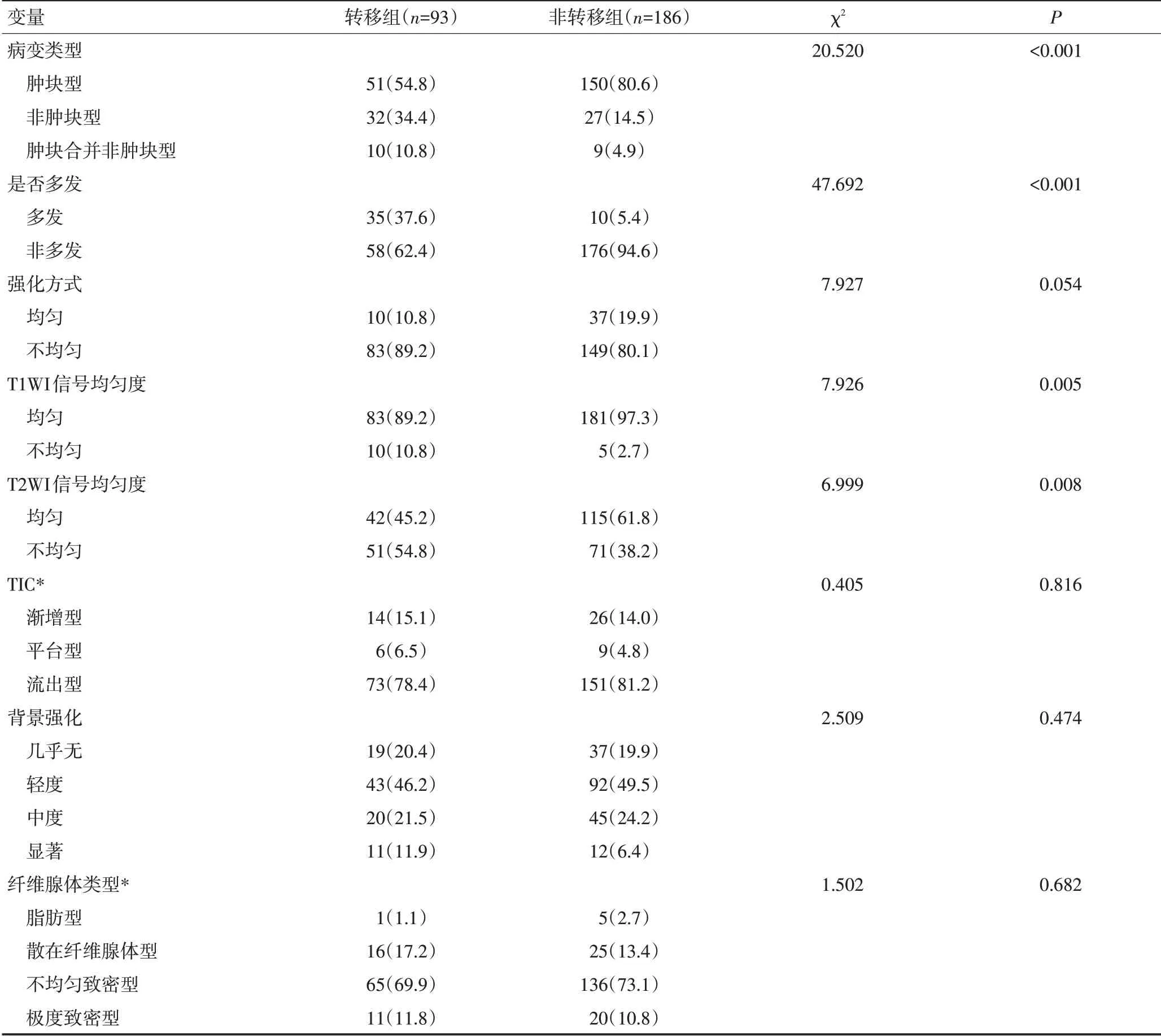
表1 转移组和非转移组乳腺癌患者MRI表现特征比较
图1 乳腺癌转移病变MRI表现特征
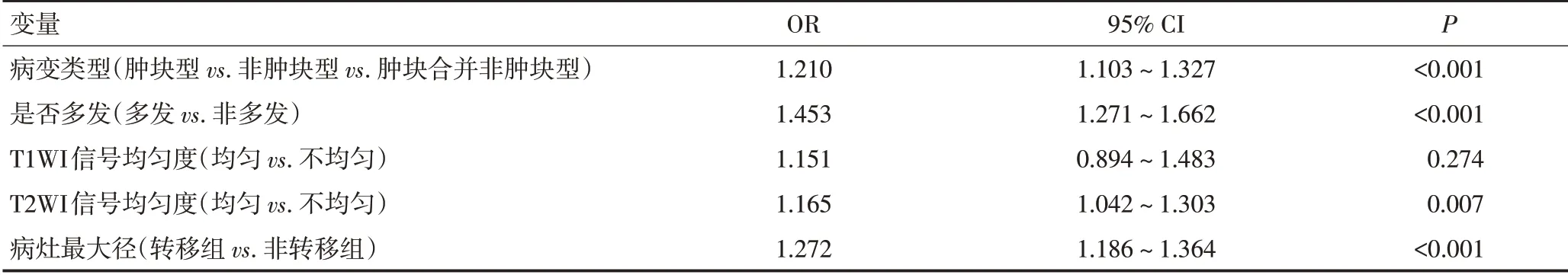
表2 乳腺癌患者MRI表现特征Logistics多因素回归分析
2.3 预测模型建立
利用独立预测因子建立预测模型:y=0.861+1.178×病变类型a+1.152×病变类型b+1.423×是否多发+1.092×T2WI 信号均匀度+1.069×病灶最大径(肿块型病变:病变类型a=1、病变类型b=0;非肿块型病变:病变类型a=0、病变类型b=1;肿块非肿块型病变:病变类型a=0、病变类型b=0;是否多发:非多发=0、多发=1;T2WI 信号均匀度:均匀=0,不均匀=1)。本模型准确率、敏感度、特异度和AUC 分别为82.8%、85.7%、75.0%和0.801,ROC曲线见图2。

图2 乳腺癌远处转移预测模型ROC曲线
3 讨论
由于手术方式进步及系统的新辅助化疗,乳腺癌患者远处转移及死亡的发生率显著下降[7],但仍有20%~30%患者发生远处转移[5],远处转移依然是导致乳腺癌患者死亡的主要原因。尽早发现患者存在远处转移的风险,有助于预测其生存期并制定治疗方案[4]。目前,临床上常通过免疫组织化学法检测提示的分子分型预测预后[5],而提示分子分型的病理切片取材于部分肿瘤组织[8],因肿瘤的异质性,肿瘤组织的整体情况不能完全被反映。乳腺MRI 通过观察形态学和血流动力学特征,可全面评估肿瘤组织的整体情况,反映肿瘤异质性。因此,本研究将多个平扫MRI 和DCE-MRI 影像特征参数进行整合,建立基于MRI影像特征的乳腺癌远处转移预测模型。
本研究发现,骨、肺脏、肝脏是乳腺癌最常见的远处转移部位,与以往研究一致[9]。Savci-Heijink等[10]研究发现,Luminal型骨转移、三阴性乳腺癌肺脏转移常见,与本研究一致,该研究中HER-2阳性乳腺癌更易发生脑转移,与本研究不同,可能与本研究纳入病例数较少有关。
本研究中肿块型病变、病变多发、T2WI信号不均匀、最大径较大的乳腺癌更易发生远处转移。有研究表明,肿块型病变的Ki-67 指数较非肿块型病变高[11],而Ki-67 高表达的乳腺癌往往预后不良[12],这可能是本研究中肿块型病变更易发生远处转移的原因。病灶最大径越大越易发生远处转移[13],此外Lynch等[14]研究发现,病变多发的乳腺癌患者预后较差,与本研究结果类似。本研究中T2WI信号更不均匀的乳腺癌更易发生转移,研究发现行新辅助化疗3个疗程的乳腺癌患者,与肿瘤大小的变化相比T2WI信号均匀度的变化更能反映肿瘤在病理水平上的变化[15]。
综上所述,MRI 图像上表现为肿块型病变、病变多发、T2WI信号不均匀、最大径较大的乳腺癌更易发生远处转移,利用上述特征建立的模型对预测乳腺癌远处转移具有潜在价值。本研究仍存在一定局限性,部分病例随访时间不足5年,经影像学检查及随访诊断远处转移的病例数较多。将来拟采用影像组学方法提取MRI定量特征,以进一步提高模型精度。

