AKR1家族基因AKR1C1,AKR1C3,AKR1B1调控肺腺癌A549细胞顺铂耐药的研究
方亚妮,刘金辉,石小玲,戴鹏高
(1.陕西中医药大学 医学技术学院,陕西 西安 712046;2.西北大学 生命科学学院,陕西 西安 710069)
肺癌是我国发病率和死亡率最高的恶性肿瘤。根据中国癌症流行病学调查数据统计,2015年我国确诊为肺癌的人数高达73.3万,发病率在所有癌症中占据首位;肺癌死亡病例为61.0万人,死亡人数居癌症首位[1]。近年来其发病率和死亡率也有日益增加的趋势。非小细胞肺癌占肺癌病理类型的80%左右[2],可近一步分为大细胞癌,鳞状细胞癌及腺癌3种类型,其中腺癌患者所占比重最高,50%左右[3]。由于病情的隐匿性,大多数肺腺癌患者在确诊时已处于晚期,无法进行手术治疗,因此以铂类药物为基础的放化疗成为这些患者治疗的主要的临床手段[4],其中顺铂作为化疗的一线药物一直被沿用至今[5]。
然而,患者在长期使用顺铂过程中对其产生的获得性耐药使得他们的治疗效果大大降低[6]。因此,发现与顺铂耐药密切相关的分子标志物对改善肺腺癌患者的治疗现状有着重大的意义。本课题组前期转录组测序结果揭示醛酮还原酶家族1(Aldo-Keto Reductases family 1,AKR1)的3个成员AKR1C1,AKR1C3及AKR1B1在A549顺铂耐受株中表达量显著提升[7],提示了这3个基因可能与肺腺癌患者顺铂耐药相关,但目前尚缺少系统性的研究阐明该家族基因在肺腺癌顺铂获得性耐药中的作用。本研究基于抑制剂阻断,RNAi敲减等细胞功能性实验对AKR1C1,AKR1C3及AKR1B1这3个基因在肺腺癌顺铂耐药中的作用进行了初步的探究。
1 材料与方法
1.1 主要试剂
RPMI-1640培养基,胎牛血清,双抗预混液均购自美国Gibco公司。顺铂购自美国Sigma公司。RNA提取试剂Trizol购于美国Invitrogen公司。Real-time qPCR试剂盒One Step SYBR®PrimeScriptTMRT-PCR Kit II购买于日本TaKaRa公司。实时定量pcr引物和抑制剂Salicylate购自上海生工生物工程有限公司。抑制剂Epalrestat与Medroxyprogesterone acetate购自美国Selleck Chemicals公司。CCK-8试剂盒购自日本同仁化学研究所。Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司。siRNA购自上海吉玛制药技术有限公司。转染试剂盒Lipofectamine®2000购自美国Life technologies公司。
1.2 细胞培养
肺腺癌A549细胞购自中国科学院上海细胞库。耐顺铂细胞株A549/DDP由本课题组体外诱导构建,耐药指数为3.4[7]。A549细胞培养于含10%(体积分数)胎牛血清、100U/mL青霉素和0.1mg/mL链霉素的双抗预混液的RPMI-1640培养基中。A549/DDP培养在顺铂浓度为2μmol/L的RPMI-1640培养基中,其他条件相同。A549细胞和构建得到的A549/DDP细胞首先要经过单克隆筛选以降低遗传背景对后续实验的干扰。将两种细胞稀释到每毫升10个细胞,加入96孔板中,每板200μL。培养24h后显微镜下观察,标记只有一个细胞存活的孔,并对这些孔进行重点观察,每2~3天更换一次新鲜培养基,待细胞在孔中富集后将其转移到24孔板中扩大培养,直至培养得到可以正常繁殖传代的单克隆A549/DDP和A549细胞。后续实验中所提到的A549细胞和A549/DDP细胞均为经过单克隆筛选过的细胞。实验时细胞均处于对数生长期。
1.3 转录组测序数据分析
将A549/DDP及其亲本细胞A549在转录组水平对其表达量差异进行分析比较。我们首先使用Illumina公司的Hiseq2000测序平台对样本进行转录组测序,进一步基于Cufflinks软件包对各转录本和基因的表达量进行计算,并以A549细胞为对照,依照差异倍数log2|Fold Change|≥2且FDR<0.01的标准筛选两样本的差异表达基因(differentially expressed genes,DEGs)。基于GO,COG及KEGG 3个基因功能数据库对初步筛选得到的DEGs进行了功能注释及信号通路富集分析,并结合TCGA数据库进行数据深度挖掘和临床应用评估[7]。
1.4 AKR家族基因差异表达验证
基于quantitivereversetranscription-PCR(qRT-PCR)技术对转录组测序发现的差异基因AKR1C1,AKR1C3及AKR1B1进行差异表达分析。采用TRIzol法提取两组细胞总RNA。mRNA反转录和定量基于One Step SYBR®PrimeScriptTMRT-PCR Kit II提供的试剂完成。所有qRT-PCR实验均在ABI ViiA7荧光定量平台进行, 反应程序设置为95℃, 1 min; 95℃,20 s; 60℃, 40 s, 共计40个循环, 于60℃收集荧光, 并依据2Ct内参基因-Ct待测基因计算各基因的表达量差异。特异性引物依靠primer-blast在线软线设计完成,选取GAPDH为内参基因,见表1。
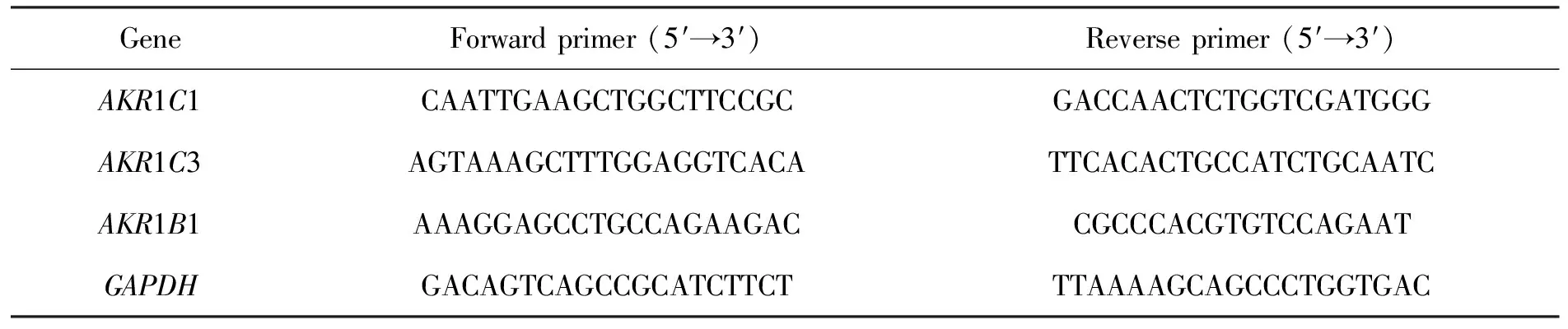
表1 mRNA定量引物序列Tab.1 Primers sequences used for mRNA expression analysis
1.5 CCK-8法细胞活性检测
CCK-8的主要成分是四唑盐WST-8,其可在电子载体1-Methoxy PMS的作用下被细胞内的脱氢酶还原为水溶性的甲臜染料(吸收峰为450nm),其生成量与培养孔中活细胞数量成正比,故用酶标仪检测培养基的在450nm处的吸光值可间接反映出活细胞的数目。收集对数期生长的细胞,胰酶消化后完成细胞计数。根据计数情况将细胞稀释到50 000个/mL,按每孔100μL体积将细胞悬液加入96孔板中,即每孔接种细胞数约为5 000。待细胞贴壁后将原培养基更换梯度浓度的含药培养液。培养48h后弃去培养液,更换为含10%CCK-8的培养液继续孵育,2h后在酶标仪上检测各孔细胞在450nm处的吸光值。吸光值即反映出活细胞的数目。
1.6 抑制剂阻断实验
本研究使用的3种抑制剂为Salicylate,Epalrestat与Medroxyprogesterone acetate,作用对象分别是AKR1C1,AKR1B1及AKR1C3。在抑制剂处理之前,为消除原培养基中药物对实验的干扰,首先移除含顺铂的培养基,更换无药培养基对其培养2h。采用浓度梯度的3种抑制剂对A549/DDP进行处理,采用CCK-8法对使用抑制剂后A549/DDP细胞活性进行测定,绘制细胞生长抑制曲线并计算每种抑制剂对A549/DDP细胞的IC50。Epalrestat浓度梯度设置为0,20,30,40,50与60μmol/L;Salicylate浓度梯度设置为0,0.125,0.25,0.5,1,2mmol/L;Medroxyprogesterone acetate浓度梯度设置为0,5,10,20,40与60μmol/L。抑制剂浓度由前期预实验摸索得到。确定3种抑制剂的IC50浓度后,分别将这3种抑制剂与顺铂联合作用于A549/DDP细胞,顺铂的浓度梯度分别为0,2,5,10,20,40和50μmol/L,采用CCK-8法测定这3种抑制剂对A549/DDP顺铂敏感性的影响。
1.7 RNA干扰实验
RNA干扰实验基于Lipofectamine®2000转染试剂体系完成。本研究使用的small interference RNA(siRNA)序列见表2。转染于96孔细胞培养板或6孔细胞培养板中完成,以scramble siRNA作为对照。转染完成后将培养基更换顺铂浓度分别为0,2,5,10,20,40和50 μmol/L的含药培养液,同时设置仅添加培养液的调零孔,培养48h后基于CCK-8法对细胞的活性进行测定,并计算转染后顺铂对A549/DDP细胞的IC50。

表2 siRNA序列Tab.2 Sequences of siRNA
1.8 细胞凋亡实验
转染24h或48h后,分别将对照组和各实验组的细胞制备成细胞悬液,基于Annexin V-FITC/PI细胞凋亡检测试剂盒分析各实验组细胞的凋亡情况,并统计分析各组间的差异。
1.9 数据统计
所有数据均采用平均值±标准差(means ± SD)表示,采用SPSS17.0统计软件进行统计学分析,P<0.05表示差异有显著性。
2 实验结果
2.1 转录组测序结果
转录组测序结果最终筛选出1 214个差异表达的基因,其中656个基因在A549/DDP细胞中表达上调,余下558个基因则呈现为下调状态。图1为1 214个差异表达基因的火山分布图[7],绿色的点代表表达量下调的基因,红色的点代表表达量上调的基因,黑色的点代表表达量没有差异的基因。其中,AKR1家族的3个成员AKR1C1,AKR1C3及AKR1B1同时在A549/DDP细胞中显著上调,其差异倍数分别为19.97,5.00和7.03。
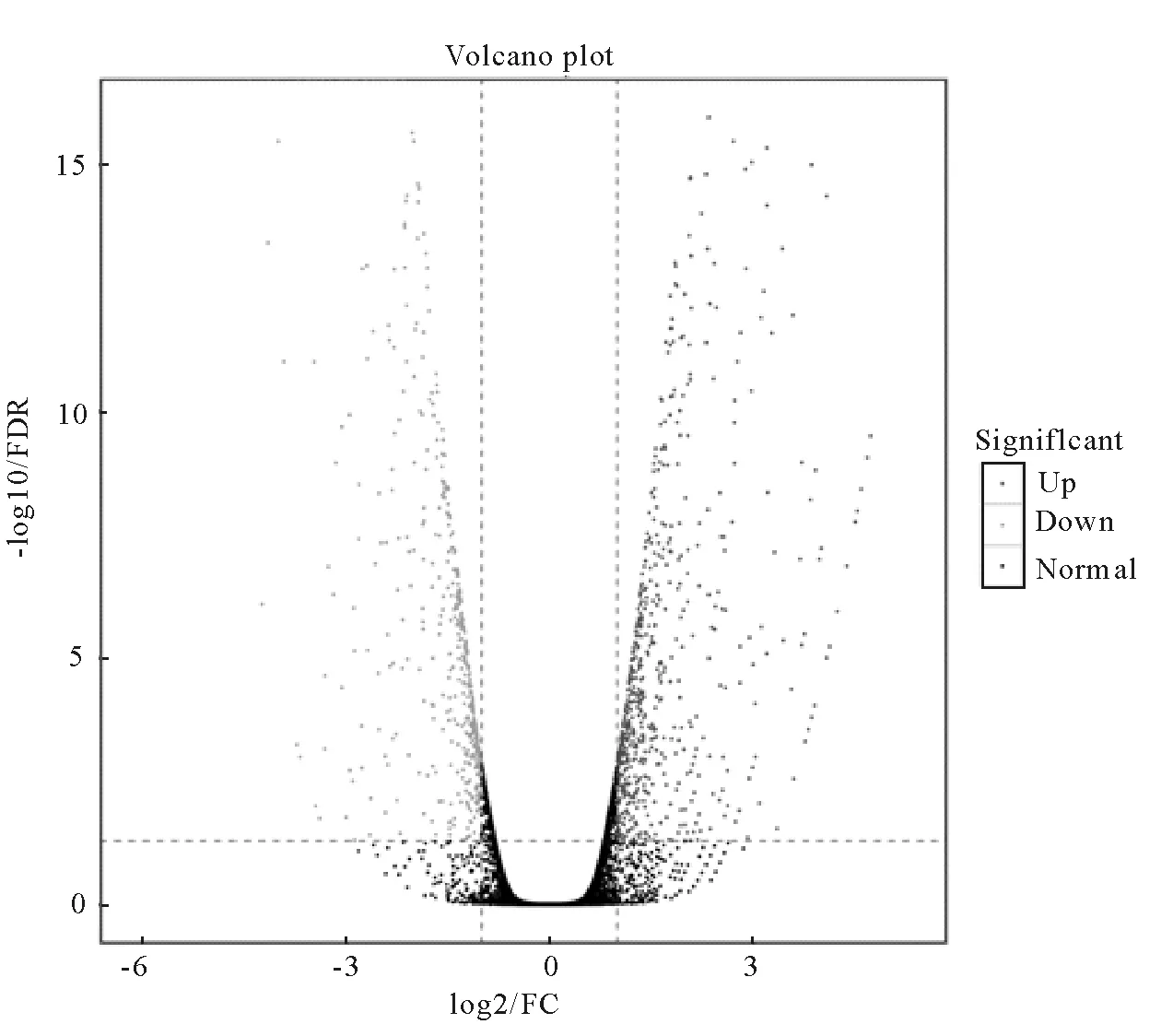
每个点指代一个基因,红色点表示该基因在A549/DDP细胞中显著上调,绿色点表示该基因在A549/DDP中显著下调,黑色点表示该基因在两种细胞中无显著表达差异。图1 差异表达基因火山图Fig.1 Volcano plot of differentially expressed genes
2.2 qRT-PCR证实AKR1家族3个基因在A549/DDP细胞中显著表达上调
基于qRT-PCR技术,对3个基因在两组细胞中的表达差异情况进行了验证。如图2所示,转录组新一代测序平台(Next Generation Sequencing,NGS)和qRT-PCR平台的检测结果一致。
2.3 Salicylate和Epalrestat显著提升A549/DDP细胞对顺铂的敏感性
针对AKR1C1,AKR1B1及AKR1C3 3种酶,选取相应的抑制剂Salicylate(SA),Epalrestat(EPA)与Medroxyprogesterone acetate(MA),将它们分别作用于A549/DDP细胞。48h后对3种抑制剂对细胞的毒性分别进行检测,发现SA和EPA均可显著抑制A549/DDP细胞的活性,且有明显的药物的浓度依赖性。然而,不同浓度的MA均未对A549/DDP细胞的活性产生显著影响(图3)。
基于抑制率曲线,最终求得SA作用于A549/DDP细胞的IC50浓度约为0.60mmol/L,EPA为38.42μmol/L。我们进一步使用3种抑制剂分别与顺铂联合处理A549/DDP细胞,以探索AKR1的抑制对顺铂敏感性的影响。SA,EPA和MA的作用浓度分别为:0.60,38.42,30μmol/L。结果显示,SA使得顺铂作用的IC50由34.4μmol/L±1.77μmol/L降低至15.26±2.36μmol/L(P<0.05),EPA则使其降低至21.56 ±1.29μmol/L(P<0.05),而MA并未显著影响A549/DDP对顺铂的敏感性(图4A)。实验结果表明,SA或EPA与顺铂的联合使用显著改善了A549/DDP细胞对顺铂的敏感性。我们进一步检测了SA或EPA增强顺铂敏感性的作用是否存在时间依赖性。结果表明,SA联合顺铂处理24h即显著增强了顺铂的细胞毒性(P<0.05),而EPA则在连续处理36h后才表现出明显的顺铂增敏效应(P<0.05)。这表明SA和EPA均显著提升了A549/DDP的顺铂敏感性,且呈现出明显的时间依赖性(图4B)。

A为AKR1C1抑制剂Salicylate对A549/DDP作用结果。结果用mean±SD表示,n=3。*vs.NS P<0.05;**vs.NS,P<0.01;***vs.NS P<0.001。B为AKR1C3抑制剂Epalrestat对A549/DDP作用结果。结果用mean±SD表示,n=3。*vs.DMSO, P<0.05;***vs.DMSO,P<0.001。C为AKR1B1抑制剂Medroxyprogesterone acetate对A549/DDP作用结果。图3 AKR1抑制剂对A549/DDP的作用Fig.3 Cyto-toxicity of AKR1 inhibitors on A549/DDP cells
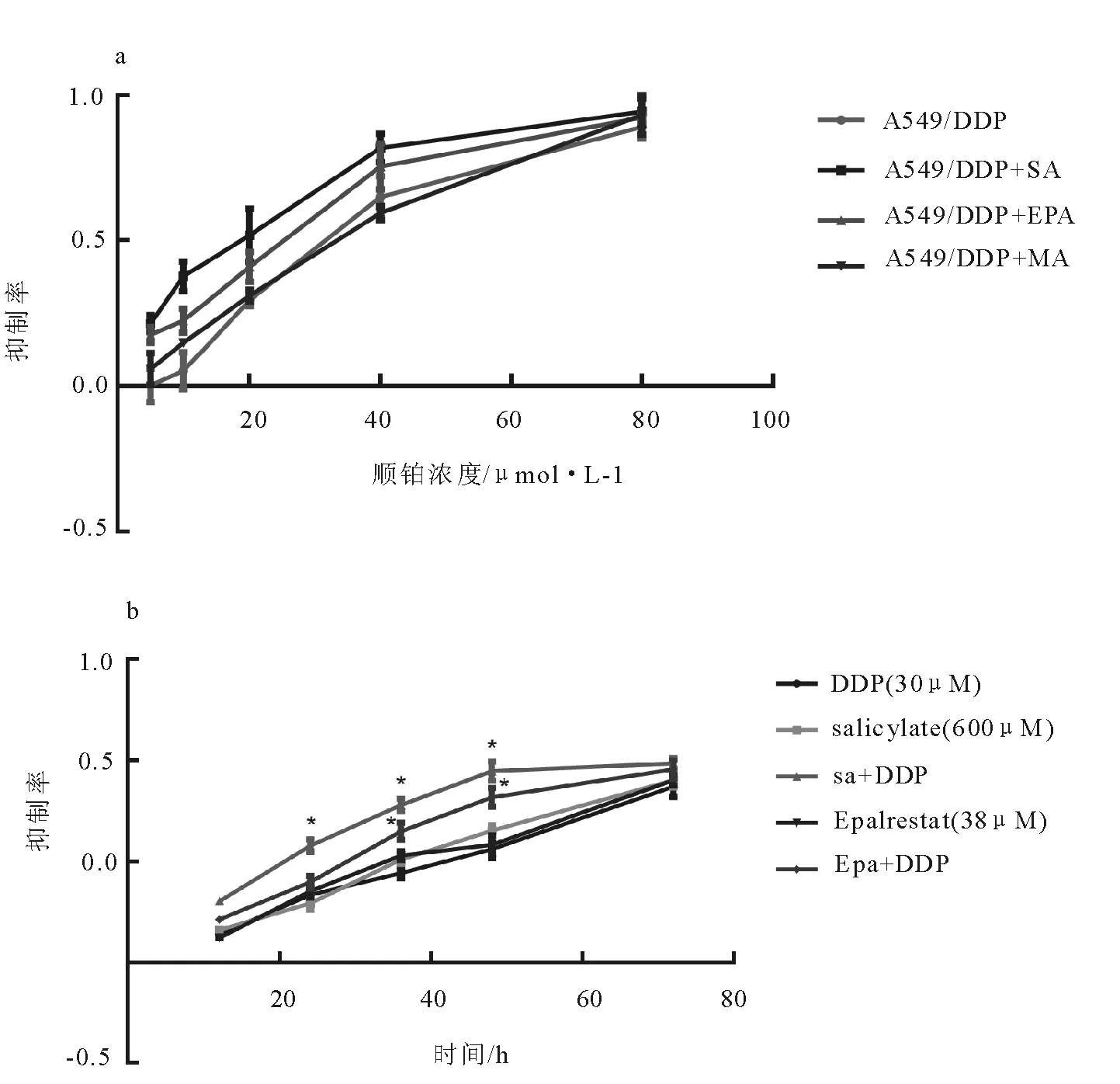
A为SA,EPA以及MA分别与不同浓度顺铂联合使用对A549/DDP作用结果。SA作用浓度为0.60mM,EPA作用浓度为38.42μM,MA作用浓度为30μM。B为SA及EPA分别与顺铂联合使用对A549/DDP细胞的抑制作用。分别于12h、24h、36h、48h以及72h对细胞活性进行检测。结果用mean±SD表示,n=3。*表示P<0.05。图4 AKR1抑制剂对顺铂敏感性的影响Fig.4 Effect of AKR1 inhibitors on DDP sensitivity
2.4 AKR1C1和AKR1C3对细胞顺铂敏感性的影响
AKR1C1和AKR1B1的酶活抑制剂显著提升了A549/DDP细胞对顺铂的药物敏感性,为了进一步验证这一结果,分别设计并合成了AKR1C1和AKR1B1的siRNA,在转录水平对这两个基因进行了敲减。将特异性siRNA和scramble RNA分别转染至A549/DDP细胞中,在siRNA转染24h及48h后,分别对敲减效率进行验证。siRNA转染24h或48h后,AKR1C1及AKR1B1在A549/DDP细胞中的表达量均显著下调;相较于短时间处理,48h的敲减效果更佳,其中AKR1C1的敲减效率可达90%以上,而AKR1B1的敲减效率则超过85%,因此我们选取48h作为基因敲减实验的终点(图5)。由于前期实验结果未能证实AKR1C3与顺铂的耐药相关,故未进一步研究AKR1C3干扰对A549/DDP细胞顺铂敏感性的影响。转染后,我们对各组细胞进行顺铂处理并在48h后进行细胞活性检测。如图5C所示,单独敲减AKR1C1或AKR1B1均没有显著改善A549/DDP细胞的顺铂耐药情况;然而,在A549/DDP细胞中同时敲减AKR1C1和AKR1B1则显著提升了细胞的顺铂敏感性(P<0.05)。
2.5 AKR1C1和AKR1C3对顺铂诱导的细胞凋亡影响
基于前期实验结果,我们在A549/DDP细胞中同时敲减AKR1C1和AKR1B1并分别在顺铂处理24h和48h后,分析实验组和对照组细胞的凋亡情况。如图6所示,相较于对照组细胞,同时敲减AKR1C1和AKR1B1显著增强了顺铂诱导的A549/DDP细胞的凋亡作用(P<0.05)。
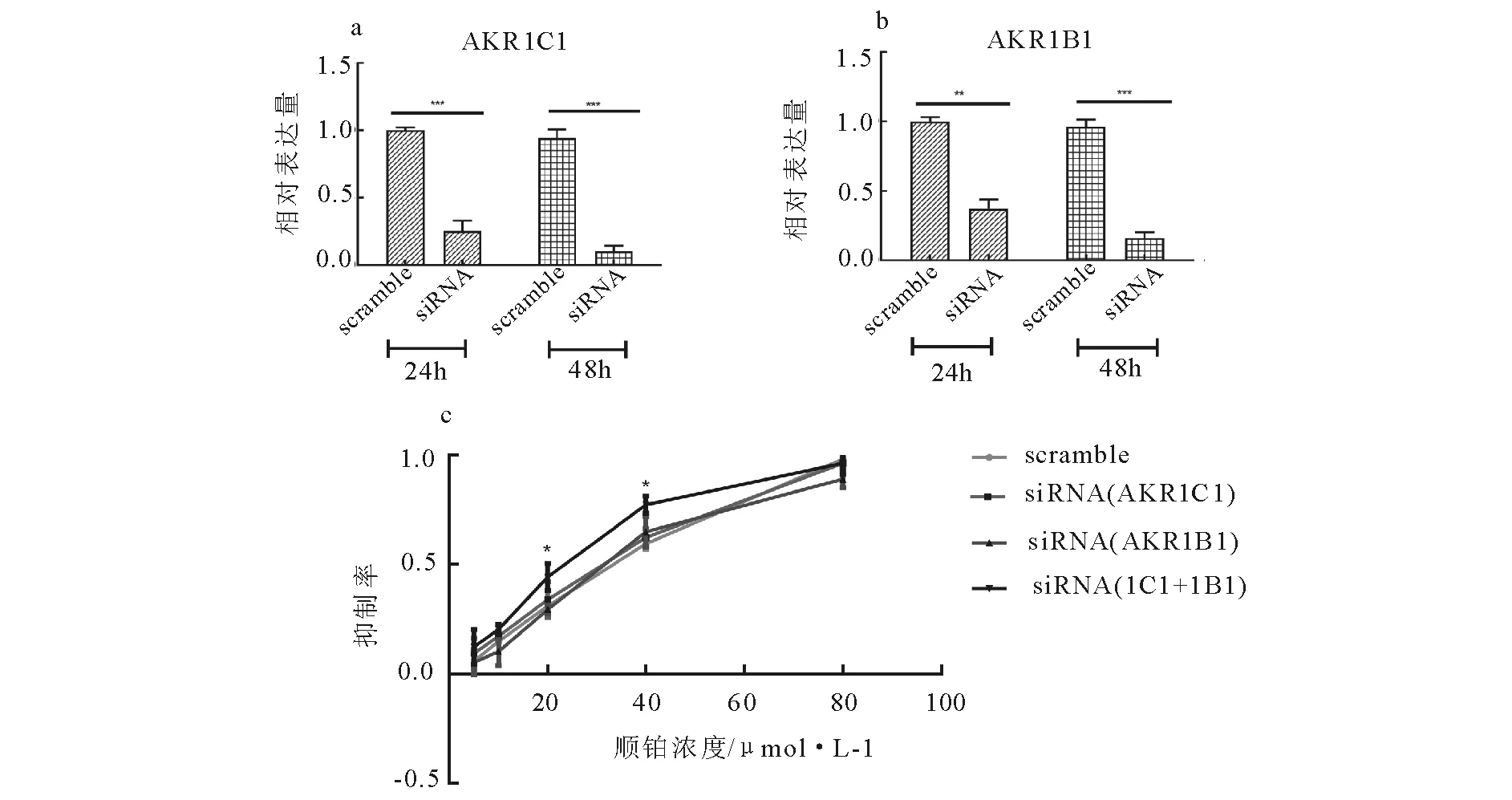
A为 AKR1C1敲减效率验证结果;B为AKR1B1敲减效率验证结果。结果用mean±SD表示, n=3。**vs.scramble, P<0.01;***vs.scramble, P<0.001。C为基因敲减对A549/DDP顺铂敏感性的作用。结果用mean±SD表示,n=3。*vs.与其相同顺铂处理浓度的scramble, P<0.05。图5 AKR1基因敲减对A549/DDP细胞顺铂敏感性的影响Fig.5 Effect of AKR1 genes knock-down on DDP sensitivity
3 讨 论
醛酮还原酶超家族是以NADPH为辅酶的一类可将人体细胞内具有强突变剂作用的醛或酮等分子还原为醇的蛋白质总称,而AKR1基因家族是其中一个分支[8]。研究表明,AKR1家族的多个成员与多种恶性肿瘤的发生发展密切相关:AKR1C1,AKR1C2和AKR1C3在肺癌[9]、子宫内膜癌[10]和乳腺癌[11]组织中均呈现为异常高表达;AKR1B1的高表达与乳腺癌的发展密切相关并可作为患者不良预后的分子标志物[12]。另有研究证实,AKR1C1促进NSCLC肿瘤细胞的转移[13],且AKR1C3可作为区分NSCLC和SCLC的分子标志物[14]。
AKR1家族成员AKR1C1,AKR1C3及AKR1B1还被证明与抗肿瘤药物的耐药性相关:Shiiba团队的研究表明,AKR1C1和AKR1C3与顺铂和5-氟尿嘧啶这两种化疗药物的耐药性相关[15];Matsumoto R的实验证实通过炎性细胞因子interleukin-1β下调AKR1C1基因的表达,使得膀胱癌细胞的耐药性大大降低[16];而Matsunaga T的实验结果则证实,基于siRNA技术,下调AKR1C1表达同样显著提高了结直肠癌细胞HCT-15对顺铂的药物敏感性[17];此外,Sonowal H团队的实验表明,抑制AKR1B1酶活性可增强结肠癌细胞对阿霉素的敏感性[18]。这些研究结果均提示了,AKR1家族的部分成员与多种肿瘤化疗药物的敏感性相关,这与本课题组前期的研究结果相同。
在课题组前期的转录组结果中,AKR1家族的3个基因AKR1C1,AKR1C3及AKR1B1在肺腺癌耐药细胞株中表达量显著上调,这一结果揭示了这3个基因可能与肺腺癌A549细胞的顺铂耐药有着紧密的关联。但是,目前尚缺少系统性的研究证实该家族的基因在非小细胞肺癌顺铂获得性耐药中的作用。同时,目前没有任何专注于AKR1抑制剂在修复顺铂敏感性,即探索将AKR1抑制剂应用于顺铂耐受的非小细胞肺癌患者临床治疗中的报道。所以,本研究就这3个基因是否能加强肺腺癌耐药细胞的顺铂敏感性做了进一步的研究和探索。
我们基于抑制剂阻断和RNAi技术,对AKR1家族基因AKR1C1,AKR1B1和AKR1C3进行了功能性验证。抑制剂实验结果表明,AKR1C1或AKR1B1酶活抑制剂与顺铂联合使用可显著提高A549/DDP细胞的顺铂敏感性;而抑制AKR1C3酶活性并不能引起肺腺癌耐药细胞A549/DDP对顺铂的敏感性增强。究其原因可能有以下两点:第一,AKR1C3的表达上调与顺铂耐药无关,而是“被动”受其他信号因子调控的结果,这与肿瘤发生中产生的‘passive mutation’情况相似,即AKR1C3并非调控顺铂敏感性的关键因子;第二,AKR1家族成员之间或与其他家族的药物代谢酶间存在功能上的重叠现象,可在一定程度上弥补抑制剂造成的功能阻断。敲减实验结果表明:在A549/DDP细胞中同时敲减AKR1C1和AKR1B1不仅增强了顺铂的细胞毒性,且同时显著增强了顺铂诱导的细胞凋亡作用。同时,敲减AKR1C1和AKR1B1可显著提高细胞对顺铂的敏感性,但单独敲减二者之一则没有明显的作用,即从侧面证实了AKR1家族成员之间存在的功能重叠现象。同时也表明,AKR1C1与AKR1B1都在调节A549细胞顺铂耐药中起到关键作用。
综上所述,本研究的实验结果进一步地证实了AKR1C1与AKR1B1基因在调节A549细胞顺铂耐药中起到了关键作用。本阶段的研究成果为解决肺腺癌临床治疗中出现的顺铂耐药问题提供了解决思路,并为肺腺癌的临床精准医疗提供了新的潜在分子靶标,同时本研究成果也为其他恶性肿瘤的治疗提供了理论支持。

