不同产地腌渍萝卜化学成分分析及抑菌活性比较
赵 雪,卢珍华,曾荣急,苏国成,李桂玲,2,李 健,2*
(1.集美大学 食品与生物工程学院,福建 厦门 361021;2.福建省海洋功能食品工程技术研究中心,福建 厦门 361021)
白萝卜(Raphanus sativus)原产地欧洲,十字花科萝卜属的一种常见的根茎类蔬菜,在我国已有2 700年的栽种历史[1]。民间一直流传着“冬吃萝卜夏吃姜,不劳医生开药方”等养生谚语。以白萝卜为原材料制作的腌渍品,加工方式多样,口感独特,既提高了农副产品的营养价值,又延长了萝卜的保质期[2]。
白萝卜在腌渍过程中发生了一系列复杂的化学变化,主要可以分为两个方面:一方面是高盐渗透作用使萝卜脱水萎缩,形成了柔软紧密的细胞结构[3],抑菌活性物质4-甲硫基-3-丁烯基异硫氰酸盐(4-(methylthio)-3-butenylisothiocyanate,MTBITC)随盐度的增加而降低[4-5]。另一方面微生物利用白萝卜及其腌制液中的糖类物质发酵产酸,形成了特殊的口感[6]。日本学者KUMAKURA K等[7]通过靶向代谢分析腌渍萝卜营养成分变化得到:萝卜盐渍时间的加长,会使γ-氨基丁酸(γ-aminobutyric acid,GABA)、多不饱和脂肪酸和支链氨基酸的水平升高。有研究发现漳浦白萝卜经过陈年发酵腌渍,产生了新的化学成分羟基苯甲醛、对羟基苯乙醇、β-谷甾醇、2,6-二羟基苯乙酮,松脂素等[8],其中部分化学物质存在抑菌活性。萝卜品种、种植条件、加工工艺的不同会影响腌渍萝卜的化学成分,为初步探究陈年腌渍萝卜提取物的地域性差异,本研究以永新、漳浦、潮汕、乐清、苏州萝卜干及新鲜白萝卜为实验材料,采用高效液相色谱法分析对比了不同产地的腌渍萝卜化学成分差异,并对其提取物的抑菌活性和细胞毒性进行分析,为腌渍萝卜的抑菌功效及食品安全性提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
新鲜白萝卜:厦门市集美菜市场;漳浦萝卜干:福建省漳州市漳浦县;潮汕萝卜干:广东省潮汕县;永新萝卜干:江西省永新县;乐清萝卜干:广西省乐清县;苏州萝卜干:江苏省苏州市。
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae):中国微生物菌种保藏中心;人体肝脏肿瘤细胞(HepG2)、人体正常肝细胞(LO2):中国科学院上海生命科学研究院细胞库。
1.1.2 化学试剂
甲醇、乙醇、丙酮、乙酸乙酯、乙醚(均为分析纯):国药集团化学试剂有限公司;二甲亚砜(dimethylsuloxide,DMSO):西陇化工股份有限公司;四甲基噻唑蓝(methyl thiazolyl tetrazolium,MTT):南京奥多福尼生物科技有限公司。
1.1.3 培养基
LB琼脂培养基、LB肉汤培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
WK-1600A型高速药物粉碎机:青州市精诚机械有限公司;RV8型旋转蒸发仪:德国IKA集团;HWY-2112型双层恒温培养摇床:厦门德维科技有限公司;DHG-9146A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;JMY-2102C生化培养箱:上海久茂试验仪器制造公司;Synergy H1MF多功能酶标仪:美国伯腾仪器有限公司;SW-CJ-2FD无菌超净操作台:苏净集团苏州安泰空气技术有限公司;Forma 3111水套式CO2细胞培养箱:赛默飞世尔科技有限公司;SC-403生物安全柜:美国BAKER公司;DEAE203170高效液相色谱仪:安捷伦(中国)有限公司;SHZ-D(III)玻璃抽滤装置:上海晖创化学仪器有限公司。
1.3 方法
1.3.1 提取物浸膏的制备
将购买的新鲜白萝卜及其他5种不同地区的白萝卜腌渍品切片,于55℃烘箱中干燥至恒质量,高速粉碎后得到干粉,80目过筛,置于干燥器中保存备用。称取适量干粉,分别加入5倍体积的甲醇、乙醇、乙醚、乙酸乙酯、丙酮,密封后置于150 r/min的摇床中浸提24 h,抽滤后收集提取液,在抽滤得到的残渣中加入相同体积的有机试剂,在同样的条件下重复浸提3次,合并滤液后,旋蒸浓缩,得到5种有机试剂的提取物浸膏,共得30个样品,标记后4℃储存备用。
1.3.2 高效液相色谱分析
使用DEAE203170高效液相色谱-紫外检测器检测法,将30种提取物浸膏用适量甲醇稀释为30 mg/mL。用甲醇(A)-水(B)体系作为流动相进行梯度洗脱:0~2 min,10%A和90%B;2~15 min,25%A和75%B;15~20 min,50%A和50%B;20~25 min,75%A和25%B;25~35 min,100%A和0%B;35~45 min,100%A和0%B;流速0.8 mL/min,进样量10μL,柱温30℃,检测波长为302nm[9],色谱柱为693970-902 Agilent TC-C18(4.6 mm×150 mm,4 μm)。
1.3.3 抑菌活性的测定
以大肠杆菌、金黄色葡萄球菌、酿酒酵母作为指示菌,采用牛津杯法进行抑菌试验。参照AGOURRAM A等[10]的方法,用PDA培养基活化酿酒酵母菌菌种、PCA培养基活化大肠杆菌和金黄色葡萄球菌菌种2代,再分别制成菌悬液,使菌液浓度为108CFU/mL。待琼脂培养基冷却至40~50℃,加入1%的菌悬液,摇匀。用无菌镊子将牛津杯平整放置于培养基上。然后向牛津杯中加入200 μL的质量浓度为30 mg/mL的样品,同时设置阳性对照和试剂空白对照。以1 mg/mL硫酸链霉素(大肠杆菌和金黄色葡萄球菌),和0.5mg/mL两性霉素作为阳性对照,并作各溶剂的空白对照。每个样品设置3个平行对照。大肠杆菌和金黄色葡萄球菌于37℃培养18~24 h,酵母菌于30℃条件下培养24~28 h。观察菌种生长情况,测量抑菌圈直径。
1.3.4 细胞毒性试验
采用MTT法[11]检测30种脂溶性化合物对人正常肝细胞(LO2)和肿瘤细胞(HepG2)增殖的抑制作用。将人体正常肝细胞(LO2)和人体肿瘤细胞(HepG2)制成单细胞悬液,调整细胞终浓度至5×104CFU/mL,然后以每孔100 μL的量接种至96孔板,在37℃、5%的CO2培养箱中培养24 h。待细胞完全贴壁后,检测不同脂溶性化合物对细胞活性的影响。给药组为浓度50 μg/mL的提取物样品,每孔加入100 μL的样品,每组样品设置3个复孔。以抗癌药物紫杉醇作为阳性对照测定癌细胞系的敏感性。同时,设置溶剂对照组和空白组(培养基)。将板置于37℃、5%的CO2培养箱中培育24 h后,每孔加20 μL 5 mg/mL的MTT,孵育4 h后,弃去培养液。每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在多功能酶标仪OD490nm处测量各孔的吸光度值。细胞增殖抑制率按如下公式计算:
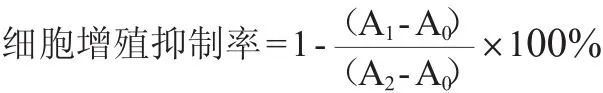
式中:A0为空白组吸光度值;A1为试验组吸光值;A2为溶剂对照组吸光度值。
2 结果与分析
2.1 不同产地腌渍萝卜化学成分差异性分析
为比较不同产地腌渍萝卜的化学成分差异,选取了苏州、永新、乐清、漳浦及潮汕萝卜干,对其甲醇、乙醇、丙酮、乙酸乙酯、乙醚提取物进行HPLC分析,其色谱图分别见图1~图5。由图1~图5可知,腌渍萝卜的甲醇、乙醇提取物色谱峰个数较少,提取效果较差。不同极性溶剂对腌渍萝卜的萃取效果不同,萃取效果由高到低依次为乙酸乙酯相>丙酮相>乙醚相>乙醇相>甲醇相。从乙酸乙酯提取效果来看,不同产地的腌渍萝卜的色谱峰的出峰时间,峰面积存在较大差异,故不同产地的腌渍萝卜化学成分不同。潮汕萝卜干与漳浦萝卜干的化学成分最为接近,可能是由于潮汕与漳浦地理位置接近,原材料品种相似度高,受闽南饮食文化影响以及加工工艺相似。

图1 新鲜白萝卜和不同产地腌渍萝卜甲醇提取物高效液相色谱图Fig.1 HPLC chromatogram of methanol extract of fresh white radish and preserved radish from different regions

图2 新鲜白萝卜和不同产地腌渍萝卜乙醇提取物高效液相色谱图Fig.2 HPLC chromatogram of ethanol extract of fresh white radish and preserved radish from different regions

图3 新鲜白萝卜和不同产地腌渍萝卜丙酮提取物高效液相色谱图Fig.3 HPLC chromatogram of acetone extract of fresh white radish and preserved radish from different regions
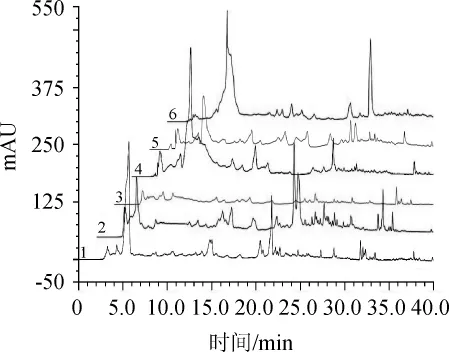
图4 新鲜白萝卜和不同产地腌渍萝卜乙酸乙酯提取物高效液相色谱图Fig.4 HPLC chromatogram of ethyl acetate extract of fresh white radish and preserved radish from different regions

图5 新鲜白萝卜和不同产地腌渍萝卜乙醚提取物高效液相色谱图Fig.5 HPLC chromatogram of ether extract of fresh white radish and preserved radish from different regions
2.2 不同腌渍萝卜提取物的抑菌实验结果
采用牛津杯法对不同产地的腌渍萝卜干不同溶剂30个提取物进行了抑菌实验,结果见表1。由表1可知,30个提取物中有6个提取物对酿酒酵母(Saccharomyces cerevisiae)有抑制效果,抑菌圈直径9.11~13.63 mm,16个提取物对大肠杆菌(Escherichia coli)有抑制效果,抑菌圈直径10.84~31.92 mm,24个提取物对金黄色葡萄球菌(Staphylococcus aureus)有抑制效果,抑菌圈直径11.11~32.23 mm。潮汕萝卜干的丙酮、乙酸乙酯提取物对酿酒酵母、大肠杆菌、金黄色葡萄球菌的抑菌圈直径分别为(12.50±0.14)mm、(29.77±0.07)mm、(29.00±0.07)mm;(13.63±0.34)mm、(31.92±0.33)mm、(32.23±0.08)mm。漳浦萝卜干的丙酮、乙酸乙酯提取物对酿酒酵母、大肠杆菌、金黄色葡萄球菌的抑菌圈直径分别为(9.11±0.21)mm、(23.95±0.04)mm、(25.34±0.22)mm;(13.63±0.34)mm、(31.92±0.33)mm、(32.23±0.08)mm。潮汕和漳浦萝卜干的丙酮、乙酸乙酯提取物对酿酒酵母抑制作用较弱;而对大肠杆菌,金黄色葡萄球菌抑制作用较强,并且二者对3种指示菌抑菌效果相当。这可能是由于两地原材料和腌渍工艺较为接近,提取物的抑菌活性成分较为接近。结果表明,甲醇、乙醇、乙醚、丙酮及乙酸乙酯提取物中分别有5种、6种、12种、11种、12种抑菌活性成分,其中乙酸乙酯提取物的抑菌活性最强。

表1 不同产地腌渍萝卜提取物抑菌结果Table 1 Antimicrobial activity of extracts of preserved radish from different regions
2.3 提取物细胞毒性实验测定结果
选取正常人类肝细胞LO2和肝癌细胞HepG2作为供试细胞,采用MTT法测试30种腌渍萝卜提取物的细胞毒性,结果见表2。

表2 腌渍萝卜提取物对LO2和HepG2细胞的抑制率Table 2 Inhibition rates of preserved radish extracts on LO2 and HepG2 cell
由表2可知,当永新、乐清萝卜干的甲醇提取物,苏州、乐清、潮汕萝卜干的乙醇提取物,永新、乐清、潮汕萝卜干的乙酸乙酯提取物,苏州、永新、乐清萝卜干的丙酮提取物质量浓度为50μg/mL时,对正常肝细胞LO2无细胞毒作用,对肿瘤细胞HepG2的抑制率为22.60%~63.63%。因此,体外实验表明部分腌渍萝卜提取物中可能存在抗癌活性成分。目前很多研究表明萝卜中的抗癌活性成分主要为异硫氰酸盐(isothiocyanate,ITCs)[17-19],其中的萝卜硫素(sulforaphane,SFN)和异硫氰酸酯(4-methylthio-3-butenyl isothiocyanate,4-MTBI)抗癌活性较强。SFN通过阻断phaseⅠ和phaseⅡ酶和抑制DNA突变等前期调控,诱导癌细胞凋亡,阻止癌细胞转移[20]。BEEVI S S等[21]研究表明,萝卜的正己烷提取物4-MTBI通过调节凋亡通路相关基因Bcl2来抑制细胞增殖、诱导癌细胞凋亡。萝卜硫素和异硫氰酸酯的含量随着腌渍的时间、萝卜的品种、加工方式不同发生改变[3]。部分腌渍萝卜提取物对HepG2细胞没有抑制作用,原因可能是部分提取物中具有细胞毒性的成分含量相对较低,PAPI A等[22-23]报道了日本萝卜芽提取物的使用剂量与人体结肠癌细胞的增殖抑制率有关。萝卜提取物抑制癌细胞的生长能力与细胞类型有关[24]。
3 结论
本实验通过对比不同产地腌渍萝卜的化学成分差异,抑菌活性和细胞毒性发现:不同极性溶剂对腌渍萝卜的萃取效果不同,甲醇、乙醇、乙醚、丙酮及乙酸乙酯提取物中分别有5种、6种、12种、11种、12种抑菌活性成分,其中乙酸乙酯提取物的抑菌活性最强。大部分提取物对酿酒酵母没有抑菌作用,而对肠道致病菌大肠杆菌、金黄色葡萄球菌有较强抑制效果。在提取物的质量浓度为50 μg/mL的条件下,22种提取物对LO2细胞无毒,对HepG2细胞的抑制率为22.60%~63.63%,表明腌渍萝卜提取物中可能存在抗癌活性成分。
综上所述,不同产地的腌渍萝卜化学成分存在较大差异,且具有抗菌、抗癌活性作用,为天然抑菌药物和抗癌药物的开发提供了理论基础。本研究仅对不同产地腌渍萝卜的化学成分、抑菌活性、细胞毒性进行了初步的探究,其脂溶性化合物中的抑菌、抗癌活性物质进行分离、纯化和鉴定有待进一步的研究。

