紫萍和兰氏萍不同克隆的生长性状及其与微卫星标记的关联性分析
张文珺, 徐娜娜,①, 李霞芳, 王梦薇, 胡芳露, 可建伟, 翁益松
(1. 浙江海洋大学水产学院, 浙江 舟山 316022; 2. 舟山市水利勘测设计院, 浙江 舟山 316021)
浮萍(duckweed)是一类广泛分布于淡水生境的浮水植物,全世界共5 属37 种,紫萍属(SpirodelaSchleid.)和兰氏萍属(LandoltiaLes et Crawford)是浮萍科(Lemnaceae)中包含种类数较少的属,前者有紫萍〔S.polyrhiza(Linn.) Schleid.〕和S.intermediaW.Koch 2 种,后者仅兰氏萍〔L.punctata(G. Meyer)Les et D. J. Crawford〕1 种[1]。 值得一提的是,兰氏萍曾划入紫萍属,中文学名少根紫萍,拉丁学名S.oligorrhiza(Kurz) Hegelm.,后根据叶绿体基因rpl16、rps16和atpF-atpH序列以及基因组DNA 的AFLP 分析结果划入兰氏萍属[1-2]。 紫萍和兰氏萍广布于全球热带及温带地区,在中国南北各省均有分布,常见于水田、池塘、湖湾和水沟等地[3]。 这2 种浮萍叶状体扁平,背面常呈紫色,但二者的单叶状体根数存在明显差异,其中,紫萍的单叶状体根数为7 ~21,而兰氏萍的单叶状体根数为2 ~7[2];二者的叶状体形态也存在一定差异,其中,紫萍的叶状体呈阔倒卵形,而兰氏萍的叶状体呈长椭圆形至狭倒卵形[3]。
浮萍是被子植物中体型较小的一类植物,其繁殖方式以无性繁殖为主。 相关研究结果表明:紫萍中抑制性成熟基因miR156的位点数为24 ~32,多于双子叶植物拟南芥〔Arabidopsisthaliana(Linn.) Heynh〕(10)和单子叶植物水稻(OryzasativaLinn.)(19),而促进性成熟基因miR172的位点数仅为1[4];在自然环境中,紫萍以无性繁殖为主,当环境条件适宜时2 d即可克隆出1 代[5],导致其种群遗传多样性较低[6-7]。 浮萍具有极强的无性繁殖能力,能够在含有有机物的污水中快速生长[8],并且对氮、磷和重金属以及一些特定污染物也具有较强的吸收和利用能力[9-13],可用于治理富营养化水体和多种污水。 然而,不同种类浮萍甚至同一种类不同个体对营养元素和污染物的吸收和利用效率存在很大差异[14-18],因此,探究与浮萍生长性状相关的分子标记对于选育及应用浮萍治理污水具有重要的实际意义。
鉴于此,作者选取紫萍和兰氏萍各3 个克隆,分别独立培养,对所有克隆分株的生长性状(包括单株叶状体数,单叶状体的根数、总根长和平均根长以及叶状体的长度和宽度)进行分析,基于微卫星标记扩增结果对6 个克隆各微卫星位点的基因型进行分析,并对各微卫星位点与2 种浮萍生长性状的关联性进行分析,还对2 种浮萍各微卫星位点不同基因型间的生长性状进行多重比较,以期为应用这些微卫星标记进行紫萍和兰氏萍的选育提供参考依据。
1 材料和方法
1.1 材料
供试的紫萍3 个克隆和兰氏萍3 个克隆分别采自舟山本岛的6 个淡水水域,依次编号Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ。 每个水域只选择1 个叶状体相连且完整的克隆植株,置于光照培养箱中使用稀释100 倍的培养液进行单独培养。 培养液母液包含0.320 g·L-1氮、0.120 g·L-1五氧化二磷、0.200 g·L-1氧化钾、0.013 g·L-1氧化镁、0.017 g·L-1硫,且微量元素含量大于等于0.002 g·L-1;培养条件为温度(23.0±0.5) ℃、空气相对湿度(78±5)%、光照度2 000 lx、光照时间16 h·d-1。 培养2 个月后,对所有克隆分株的生长性状进行统计和测量,每个克隆植株随机选取10 个完整的克隆分株提取基因组DNA。
1.2 方法
1.2.1 生长性状的统计和测量 统计每个克隆分株上叶状体的数量,即单株叶状体数;统计每个叶状体上根的数量,即单叶状体根数;使用游标卡尺(精度0.01 mm)测量每个叶状体的长度和宽度以及每条根的长度,并计算单叶状体的总根长和平均根长。
1.2.2 微卫星位点的基因型分析 用硅胶分别对紫萍和兰氏萍的完整克隆分株进行干燥;取0.1 g 样品,采用改良的CTAB 法[19]提取基因组DNA。 选取19 对微卫星引物[20]进行扩增反应,各引物的序列及特征见表1。 所有引物由北京华大基因公司合成。
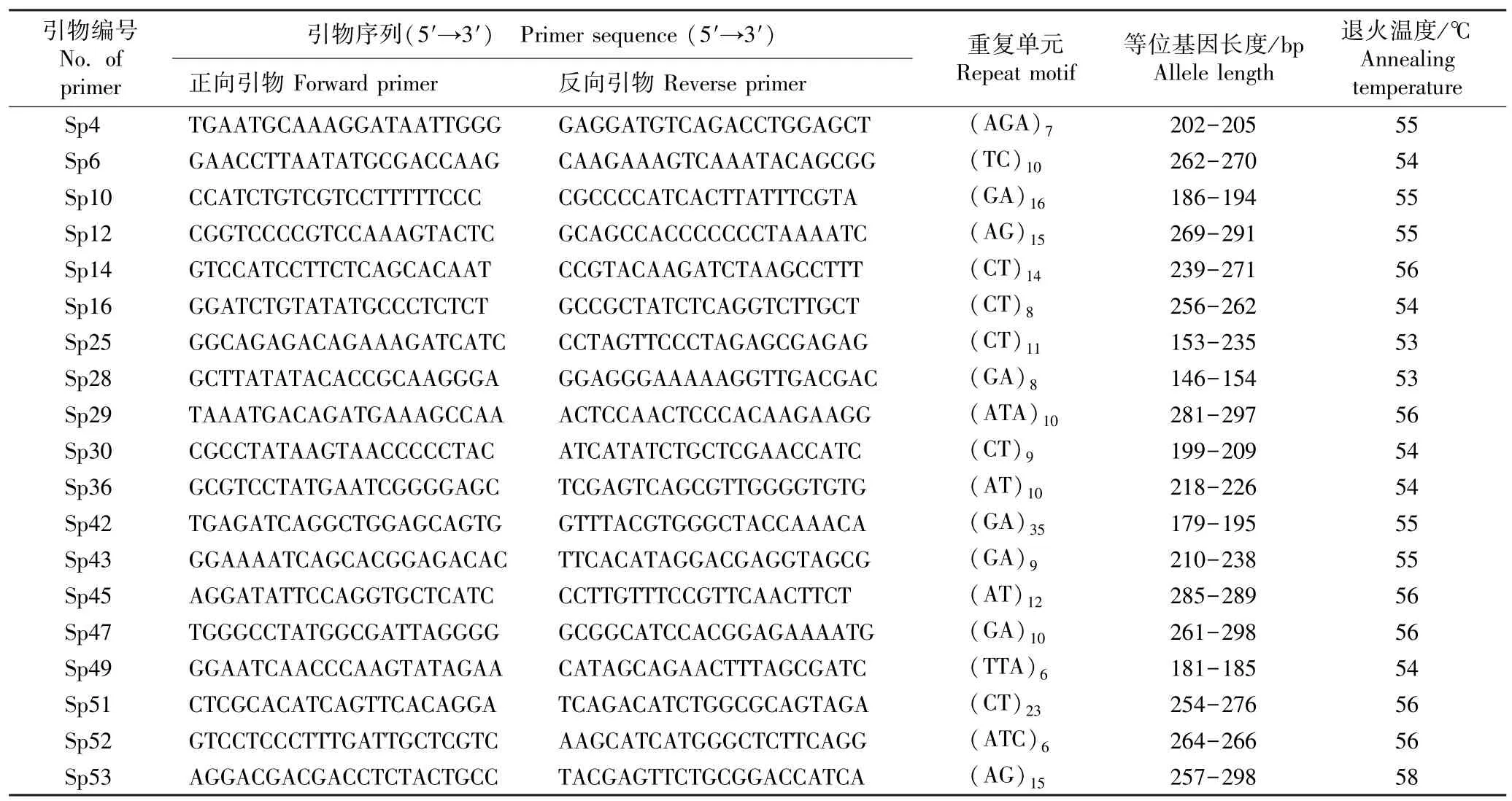
表1 供试19 对微卫星引物的序列及特征Table 1 Sequences and characteristics of 19 pairs of microsatellite primers tested
用Bio-Rad T100 PCR 仪(美国Bio-Rad 公司)进行扩增反应,扩增体系总体积20 μL,包括4 UTaqDNA 聚合酶〔生工生物工程(上海)股份有限公司〕、2 μL 10×PCR buffer、0.8 mmol·L-1dNTPs、0.3 mmol·L-1正向引物、0.3 mmol·L-1反向引物、50 ~100 ng DNA 模板,ddH2O 补足体积。 扩增程序:94 ℃预变性5 min;94 ℃变性30 s、53 ℃~58 ℃退火35 s、72 ℃延伸40 s,共35 个循环;最终72 ℃延伸3 min。用ABI 3730XL 测序仪(美国ABI 公司)检测扩增产物,根据检测结果分析各微卫星位点的基因型。
1.3 数据统计和分析
采用SPSS 19.0 软件对实验数据进行统计分析;根据数据的方差齐性采用最小显著差数法(LSD法)和Dunnett T3 检验法对相关数据进行多重比较;应用一般线性模型(GLM)对各微卫星位点与紫萍和兰氏萍生长性状的关联性进行最小二乘法分析[21-22]。
2 结果和分析
2.1 紫萍和兰氏萍不同克隆生长性状的比较
紫萍和兰氏萍不同克隆生长性状的比较结果见表2。 由表2 可以看出:紫萍克隆Ⅱ的单株叶状体数最少(2.7),克隆Ⅰ和Ⅲ的单株叶状体数均为2.9;克隆Ⅲ的单叶状体的根数、总根长和平均根长及叶状体的长度和宽度均最大,克隆Ⅱ的单叶状体的根数、总根长和平均根长均最小,克隆Ⅰ的叶状体的长度和宽度均最小。 兰氏萍克隆Ⅵ的单株叶状体数及单叶状体的总根长和平均根长均最大,克隆Ⅳ的单叶状体根数及叶状体的长度和宽度均最大;克隆Ⅳ的单株叶状体数以及克隆Ⅵ的单叶状体根数均最少,克隆Ⅴ的叶状体的长度和宽度及单叶状体的总根长和平均根长均最小。 总体来看,紫萍克隆Ⅲ的生长性状优于克隆Ⅰ和Ⅱ的生长性状,兰氏萍克隆Ⅳ和Ⅵ的生长性状优于克隆Ⅴ的生长性状。
由表2 还可以看出:紫萍单叶状体的根数、总根长和平均根长及叶状体宽度在3 个克隆间存在显著(P<0.05)差异,兰氏萍的各生长性状在3 个克隆间也存在显著差异。
表2 紫萍和兰氏萍不同克隆生长性状的比较(±SE)1)Table 2 Comparison on growth traits of different clones of Spirodela polyrhiza (Linn.) Schleid. and Landoltia punctata (G. Meyer) Les et D. J.Crawford (±SE)1)
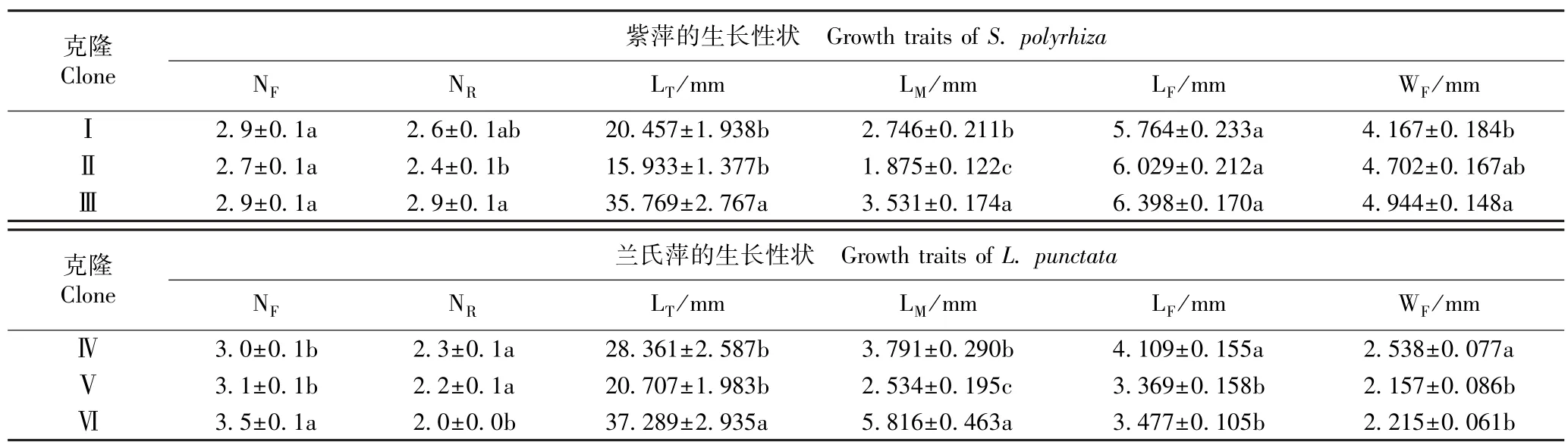
表2 紫萍和兰氏萍不同克隆生长性状的比较(±SE)1)Table 2 Comparison on growth traits of different clones of Spirodela polyrhiza (Linn.) Schleid. and Landoltia punctata (G. Meyer) Les et D. J.Crawford (±SE)1)
1)N: 单株叶状体数 Number of frond per plant; N: 单叶状体根数 Number of root per frond; L: 单叶状体总根长 Total length of root per frond;F R T LM:单叶状体平均根长M eanleng thofrootp er fron d;LF : 叶状体 长度L engt hoffrond; WF: 叶状体 宽度Widthoffrond.同列中不同的小写字母表示差异显著(P<0.05)Differentlowercasesinthesamecolumnindicatethesignificant(P<0.05)difference.
克隆Clone紫萍的生长性状 Growth traits of S. polyrhiza NF NR LT/mm LM/mm LF/mm WF/mmⅠ2.9±0.1a 2.6±0.1ab 20.457±1.938b 2.746±0.211b 5.764±0.233a 4.167±0.184bⅡ2.7±0.1a 2.4±0.1b 15.933±1.377b 1.875±0.122c 6.029±0.212a 4.702±0.167abⅢ2.9±0.1a 2.9±0.1a 35.769±2.767a 3.531±0.174a 6.398±0.170a 4.944±0.148a克隆Clone兰氏萍的生长性状 Growth traits of L. punctata NF NR LT/mm LM/mm LF/mm WF/mmⅣ3.0±0.1b 2.3±0.1a 28.361±2.587b 3.791±0.290b 4.109±0.155a 2.538±0.077aⅤ3.1±0.1b 2.2±0.1a 20.707±1.983b 2.534±0.195c 3.369±0.158b 2.157±0.086bⅥ3.5±0.1a 2.0±0.0b 37.289±2.935a 5.816±0.463a 3.477±0.105b 2.215±0.061b
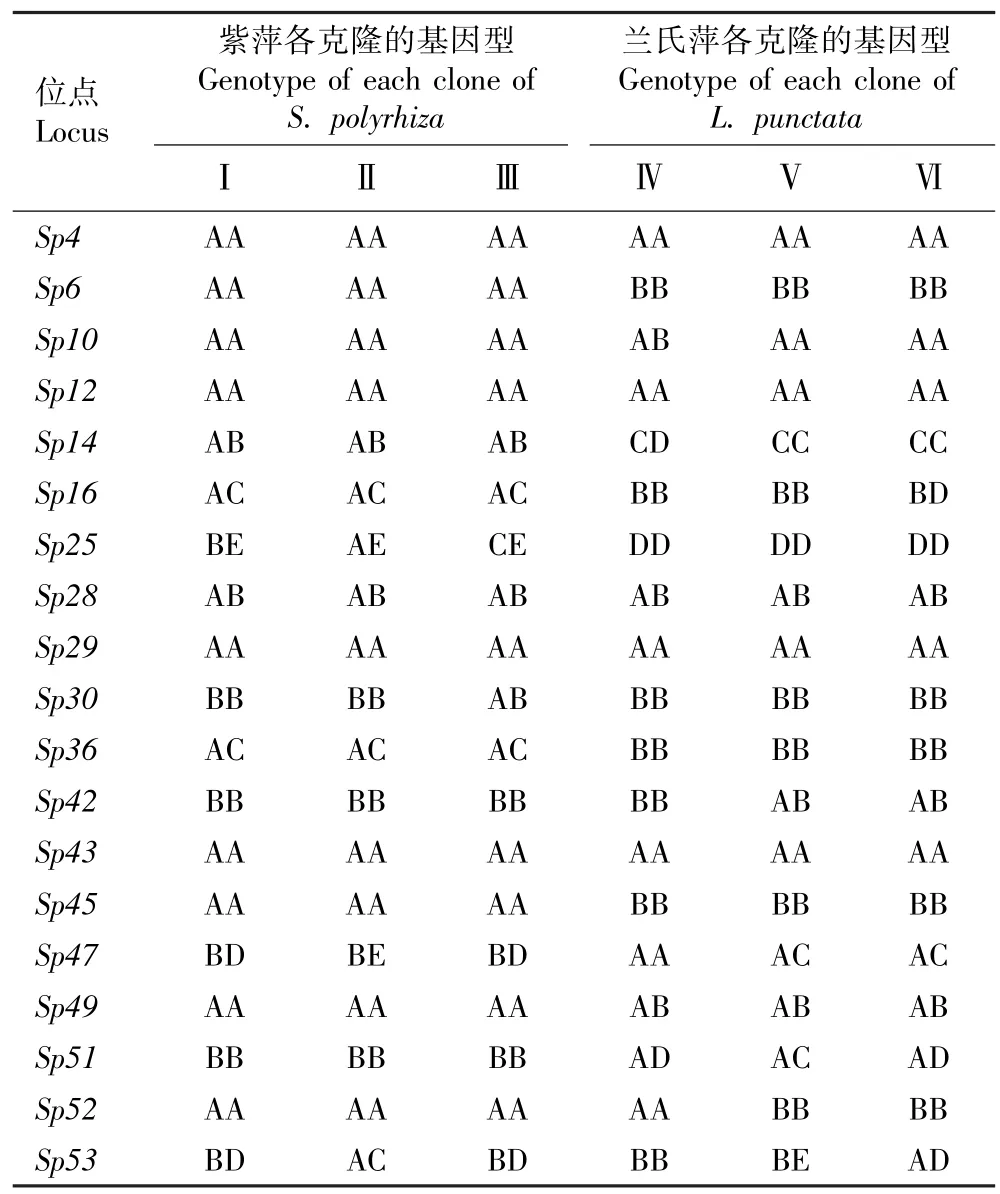
表3 紫萍和兰氏萍不同克隆各微卫星位点的基因型分析Table 3 Analysis on genotypes of different clones of Spirodela polyrhiza (Linn.) Schleid. and Landoltia punctata (G. Meyer) Les et D. J. Crawford at each microsatellite locus
2.2 紫萍和兰氏萍不同克隆各微卫星位点的基因型分析
检测结果显示:在紫萍和兰氏萍的6 个克隆中共检测到50 个等位基因,平均每个位点的等位基因数为2.6。 并且,每个克隆随机选出的10 个克隆分株的多位点基因型相同,紫萍3 个克隆和兰氏萍3 个克隆为6 个不同的多位点基因型,说明供试的紫萍和兰氏萍植株均为克隆繁殖植株。 紫萍和兰氏萍不同克隆微卫星位点的基因型分析结果见表3。 由表3 可以看出:紫萍3 个克隆在Sp25、Sp30、Sp47和Sp53位点的基因型不同,在其余15 个微卫星位点的基因型相同;兰氏萍3 个克隆在Sp10、Sp14、Sp16、Sp42、Sp47、Sp51、Sp52和Sp53位点的基因型不同,在其余11 个微卫星位点的基因型相同。 供试的2 种浮萍6个克隆在Sp4、Sp12、Sp28、Sp29和Sp43位点的基因型相同,并且,除Sp28位点外,其余4 个微卫星位点均只有1 个等位基因。
2.3 微卫星位点与紫萍和兰氏萍生长性状的关联性分析
根据各微卫星位点基因型的分析结果,分别对4 个微卫星位点(包括Sp25、Sp30、Sp47和Sp53位点)与紫萍生长性状的关联性以及8 个微卫星位点(包括Sp10、Sp14、Sp16、Sp42、Sp47、Sp51、Sp52和Sp53位点)与兰氏萍生长性状的关联性进行F检验,结果分别见表4 和表5。
由表4 可以看出:Sp25、Sp30、Sp47和Sp53位点与紫萍单叶状体的根数、总根长和平均根长的关联性极显著(P<0.01),Sp30位点与紫萍叶状体的长度和宽度的关联性显著(P<0.05),Sp25位点与紫萍叶状体宽度的关联性也显著,其余各微卫星位点与紫萍生长性状的关联性均不显著。
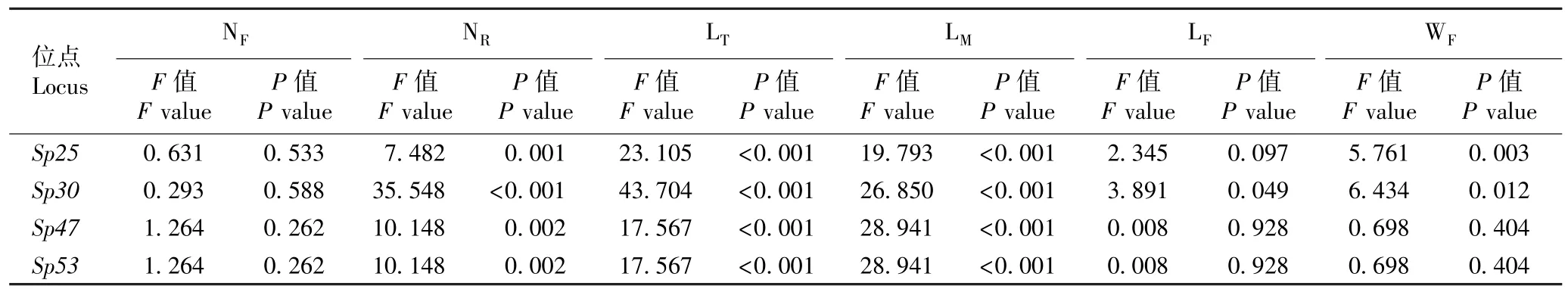
表4 微卫星位点与紫萍生长性状关联性的F 检验结果1)Table 4 Result of F-test on associations of microsatellite loci with growth traits of Spirodela polyrhiza (Linn.) Schleid. 1)
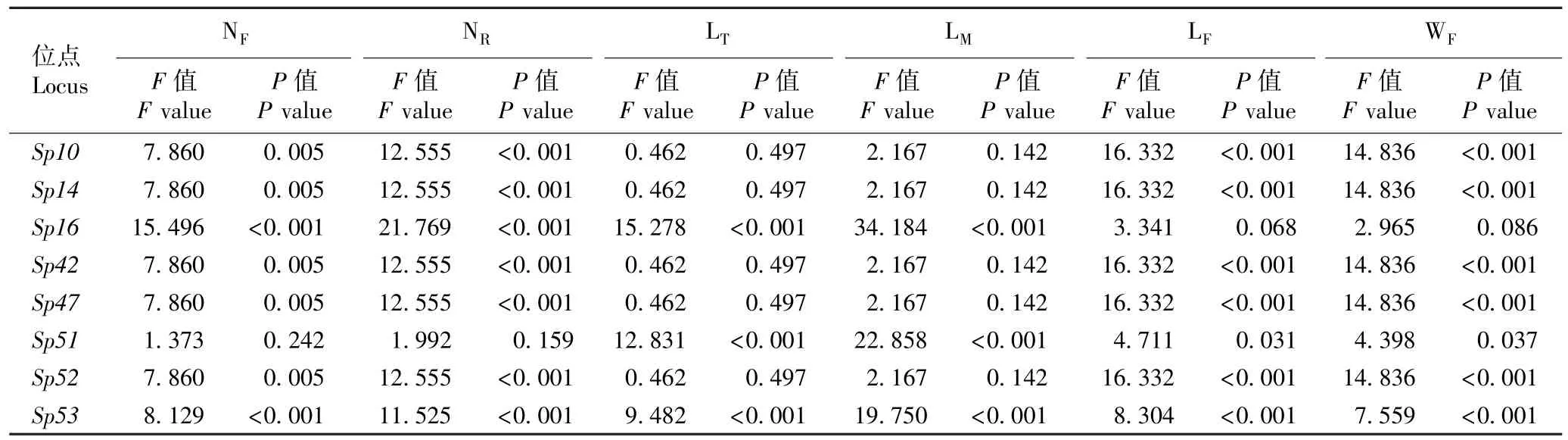
表5 微卫星位点与兰氏萍生长性状关联性的F 检验结果1)Table 5 Result of F-test on associations of microsatellite loci with growth traits of Landoltia punctata (G. Meyer) Les et D. J. Crawford1)
由表5 可以看出:除Sp51位点,其余位点(即Sp10、Sp14、Sp16、Sp42、Sp47、Sp52和Sp53位点)与兰氏萍单株叶状体数和单叶状体根数的关联性极显著;Sp10、Sp14、Sp42、Sp47、Sp52和Sp53位点与兰氏萍叶状体的长度和宽度的关联性极显著,Sp51位点则与兰氏萍叶状体的长度和宽度的关联性显著;Sp16、Sp51和Sp53位点与兰氏萍单叶状体的总根长和平均根长的关联性极显著。
2.4 紫萍和兰氏萍各微卫星位点不同基因型间生长性状的多重比较
各微卫星位点不同基因型间紫萍和兰氏萍生长性状的多重比较结果分别见表6 和表7。
由表6 可以看出:Sp25、Sp30、Sp47和Sp53位点不同基因型间紫萍单株叶状体数的差异均不显著。Sp25位点CE 基因型、Sp30位点AB 基因型、Sp47位点BD 基因型和Sp53位点BD 基因型紫萍单叶状体
的总根长和平均根长均显著(P<0.05)高于同一微卫星位点其他基因型,说明这些基因型紫萍的根相对更长。 此外,Sp25位点CE 基因型紫萍的单叶状体根数及叶状体的长度和宽度均最大;Sp30位点AB 基因型紫萍的单叶状体根数及叶状体的长度和宽度显著高于BB 基因型;Sp47位点和Sp53位点BD 基因型紫萍的单叶状体根数均显著高于同一微卫星位点其他基因型。
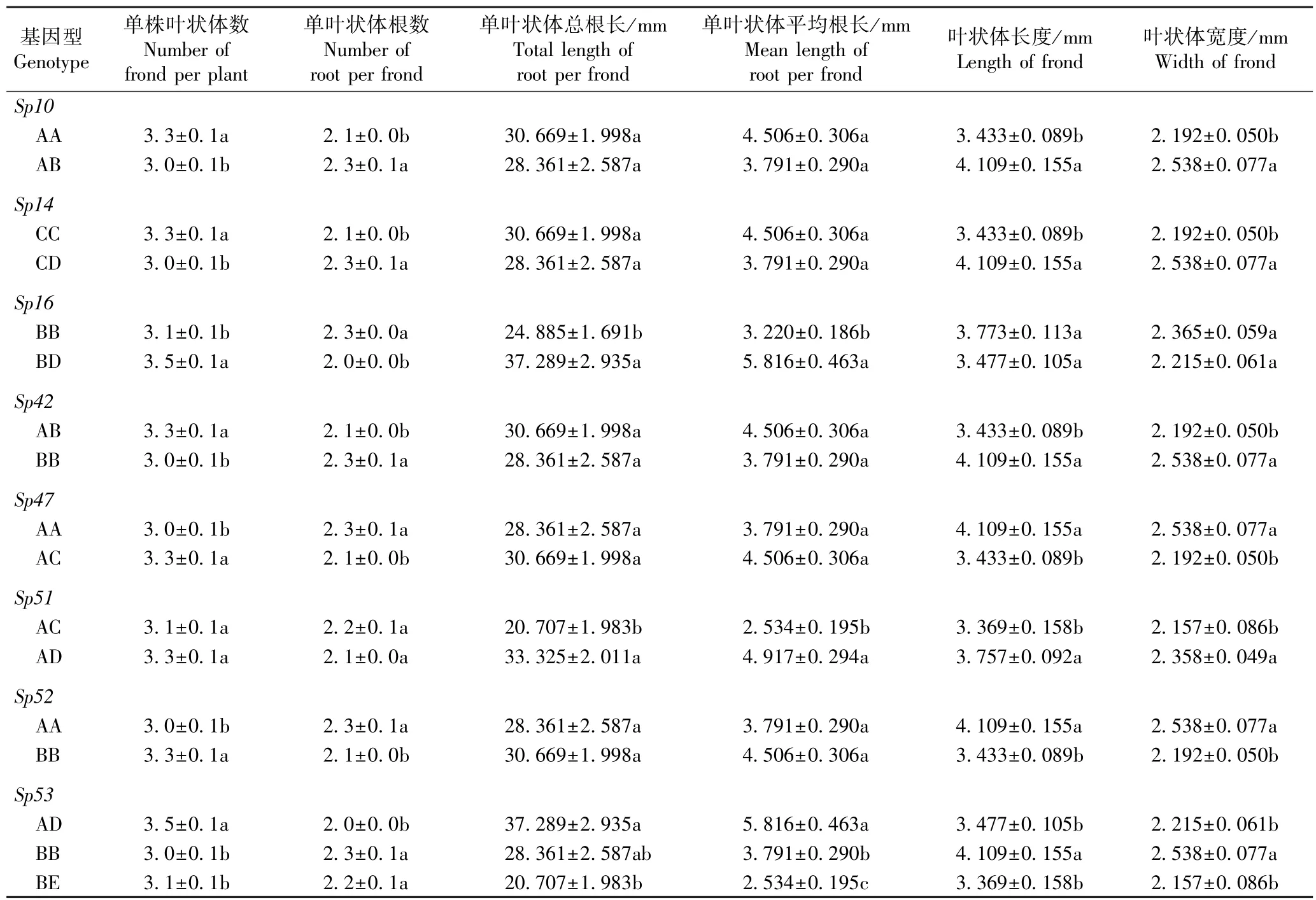
表7 各微卫星位点不同基因型间兰氏萍生长性状的多重比较1)Table 7 Multiple comparison on growth traits of Landoltia punctata (G. Meyer) Les et D. J. Crawford among different genotypes at each microsatellite locus1)
由表7 可以看出:除Sp51位点外,其余微卫星位点不同基因型间兰氏萍的单株叶状体数和单叶状体根数均差异显著;除Sp16位点外,其余微卫星位点不同基因型间兰氏萍叶状体的长度和宽度均差异显著;Sp16、Sp51和Sp53位点不同基因型间兰氏萍单叶状体的总根长和平均根长均差异显著。 比较发现,8 个微卫星位点多数基因型兰氏萍的单叶状体根数偏少,并且,Sp51和Sp53位点AD 基因型兰氏萍的根明显偏长。
3 讨论和结论
微卫星标记又称简单重复序列(simple sequence repeats),是常用的中性分子标记之一。 由于真核生物基因组中简单重复序列的单元重复数在个体间存在高度变异,因此,微卫星标记已被广泛用于多种生物的种群遗传结构分析[23-26]、亲缘分析[27-29]及与生长性状有关的研究工作[30-36]。 通常情况下,微卫星标记具有物种特异性,但也可能存在于同属不同种类或不同属种类的基因组DNA 中,也就是说微卫星标记可能具有种间标记通用性( cross-species amplification) 或属间标记通用性( cross-genera amplification)[37-42]。
本研究结果表明:紫萍3 个克隆在15 个微卫星位点上具有相同的基因型,其中11 个微卫星位点的基因型为纯合子;而兰氏萍3 个克隆在11 个微卫星位点上具有相同的基因型,其中9 个微卫星位点的基因型为纯合子。 紫萍和兰氏萍的所有克隆在Sp4、Sp12、Sp28、Sp29和Sp43位点基因型相同,并且,除Sp28位点外,其余4 个微卫星位点均只有1 个等位基因,说明Sp28位点的基因型为杂合子,其余微卫星位点的基因型均为纯合子。 值得注意的是,紫萍3 个克隆在Sp6、Sp14、Sp16、Sp25、Sp36、Sp45、Sp47和Sp51位点的基因型和等位基因与兰氏萍3 个克隆不同。 上述研究结果说明虽然紫萍和兰氏萍的DNA 序列有一定的相似性,但供试的微卫星标记仍对紫萍和兰氏萍具有很好的属间标记通用性,可用于紫萍和兰氏萍的基因型分析。
关联性分析结果表明:与紫萍生长性状相关的微卫星位点有4 个,分别为Sp25、Sp30、Sp47和Sp53;与兰氏萍生长性状相关的微卫星位点有8 个,分别为Sp10、Sp14、Sp16、Sp42、Sp47、Sp51、Sp52和Sp53;并且,与紫萍和兰氏萍生长性状共同相关的微卫星位点只有2 个,分别为Sp47和Sp53。 各微卫星位点与紫萍和兰氏萍生长性状的关联性存在差异,总体来看,各微卫星位点与紫萍单叶状体的根数、总根长和平均根长的关联性极显著(P<0.01),而与兰氏萍单株叶状体数、单叶状体根数及叶状体的长度和宽度的关联性极显著。 值得注意的是,Sp53位点与紫萍和兰氏萍根生长性状的关联性均极显著。 比较发现,Sp47和Sp53位点BD 基因型紫萍的根明显偏多且偏长,Sp51和Sp53位点AD 基因型兰氏萍的根明显偏长;并且,Sp25位点CE 基因型紫萍的叶状体最多且最大,其根也最多且最长。
综上所述,供试的微卫星标记具有属间标记通用性,能用于紫萍和兰氏萍基因型分析。 与紫萍生长性状相关的微卫星位点分别为Sp25、Sp30、Sp47和Sp53,这些微卫星位点与紫萍根的长度和数量密切相关;与兰氏萍生长性状相关的微卫星位点分别为Sp10、Sp14、Sp16、Sp42、Sp47、Sp51、Sp52和Sp53,这些微卫星位点与兰氏萍叶状体的数量和大小以及根的数量密切相关。

