基于网络药理学探讨丹栀逍遥散治疗多囊卵巢综合征的物质基础及作用机制*
汪碧云,伍庭凤,李舒婷,谢琳玲,曾 蕾
(1.广州中医药大学第一临床医学院,广东 广州 510405;2.广州中医药大学附属中山中医院,广东 中山 528400;3.广州中医药大学第一附属医院,广东 广州 510405)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性中较常见的内分泌代谢紊乱性疾病,根据不同的诊断标准,约影响9%~18%的育龄期女性[1-2]。其主要表现为月经失调、多毛、不孕等,常合并胰岛素抵抗(IR)。PCOS发病机制目前尚不明确,涉及到遗传、环境、精神心理因素等多个方面,可能为多因素共同作用的结果。目前对于PCOS的治疗尚无特效药物,多根据患者的具体情况个体化治疗,包括调整月经周期、促进生育、调整代谢等。由于PCOS缺乏特异性西药治疗,越来越多的学者关注中医中药对PCOS的防治。
中医古籍没有关于PCOS病名的记载,但根据其临床表现,可归为“月经过少”“月经后期”“闭经”“崩漏”以及“不孕”等范畴。现代中医各医家对PCOS的治疗略有差异,但其病机之本多责之于肾、肝、脾,缘此三脏功能失常,致冲任失调、痰壅胞宫、瘀血阻络而发为本病。丹栀逍遥散原方出自明代薛己的《内科摘要》,其方根据《太平惠民和剂局方》中的逍遥散加减而来,具有疏肝清热、养血健脾之功效,主治肝郁血虚内热证。临床多用于PCOS肝经郁火证,该证型的患者多有高雄激素的表现。动物实验证明该方能降低PCOS模型大鼠的抗米勒管激素(AMH)及雄激素(T)的水平,并能改善PCOS的IR情况[3-4]。但由于中药复方药物多且成分复杂,其具体的作用机制尚不明。因此需要系统地研究药物、化合物、蛋白、基因及疾病的相互作用过程,以进一步明确该方的药效物质基础及作用机制。本研究基于网络药理学的方法,查找丹栀逍遥散的活性成分,并预测其作用靶点,通过建立药物——疾病靶点的网络图,探索丹栀逍遥散治疗PCOS的作用机制,为中药复方的机制论证提供新思路。
1 材料与方法
1.1 丹栀逍遥散活性成分筛查 丹栀逍遥散的主要方药组成包括牡丹皮、栀子、当归、白芍、柴胡、茯苓、白术、甘草等,在中药系统药理学数据库与分析平台TCMSP[5]检索上述各味中药,得到相关活性化合物后,以药物口服生物利用度(OB)≥30%,药物相似性(DL)≥0.18为条件进一步筛选。将最终得到的活性成分导入化学信息数据库Pubchem[6],检索各个活性成分的规范SMILES结构和化学结构式。
1.2 丹栀逍遥散潜在靶点的预测 将各活性成分的结构导入到Swiss Target Prediction[7]数据库,限定物种为人,预测其作用靶点,根据相关性的高低选取潜在作用靶点。
1.3 PCOS的相关靶点数据构建 疾病靶点的查询基于人类基因数据库GeneCards[8],以“Polycystic O-vary Syndrome”为关键词搜索。获得相关靶点后,为便于数据分析,使用Uniprot[9]将靶点的Gene Symbol转换成Uniprot ID。转换完成后,绘制药物-疾病靶点的Venn 图(http://bioinformatics.psb.ugent.be/webtools/Venn/),得到药物作用的潜在靶点。
1.4 构建靶点-靶点相互作用(PPI)网络图 将丹栀逍遥散作用与PCOS的潜在靶点导入String数据库构建PPI网络,对于无相互作用的靶点予以剔除,将全节点关系信息导入到Cytoscape构建网络图,使用Network Analyzer插件分析网络图,以Degree值大小对各靶点进行排序,取Degree>10的核心靶点重新构建PPI图。
1.5 靶点的信号通路分析和生物信息富集分析 通过DAVID数据库对核心靶点进行生物学过程(biological process,BP)、分子功能(molecular function,MF)及细胞成分(cellular component,CC)的 GO 分析;并利用Cytoscape里的ClueGO联合CluePedia插件进行KEGG分析。以此明确丹栀逍遥散治疗PCOS的相关生物信息及调控通路。
2 结果
2.1 丹栀逍遥散活性成分筛查 在TCMSP数据库检索丹栀逍遥散各味中药,共获得1 081个活性成分,根据DL及OB进一步筛选后,最终得到162个活性成分,其中牡丹皮8个,柴胡16个,栀子15个,白芍12个,白术2个,茯苓15个,甘草92个,当归2个。去除无化学结构式及未预测到靶点的活性成分,以及删除重复项后,最终得到142个有效活性成分,构建药物及活性成分网络图,其中粉色的节点为药物共有的活性成分(如图1所示)。
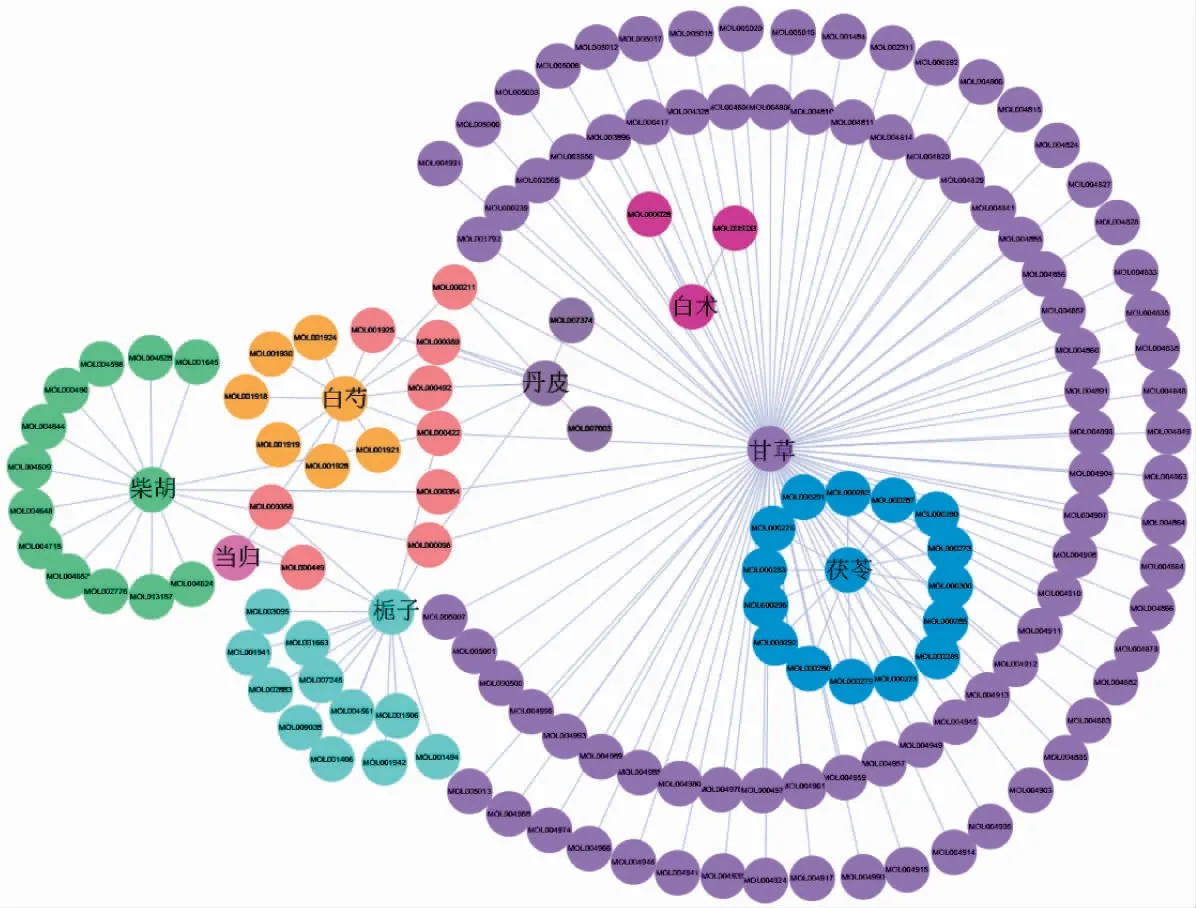
图1 各个药物的活性成分网络图(粉色为共有的活性成分)
2.2 潜在靶点预测 对活性成分进行靶点预测后得到483个靶点。在Gene Cards数据库检索到PCOS相关靶点共3 619个。在Uniprot数据库中限定物种为人,由于客观未知原因,最终疾病靶点有3 451个成功转化ID。用Venn图分析疾病与药物靶点,得到140个药物作用的潜在靶点。将潜在靶点导入String数据库构建PPI网络,将PPI网络中全节点关系导入到Cytoscape,使用Network Analyzer对网络进一步分析,将Degree≤10的节点剔除。对剩下的84个核心靶点进一步分析,得到网络图2。
2.3 丹栀逍遥散作用于PCOS的核心靶点的网络分析 利用DAVID数据库对核心靶点进行GO分析,设置最小基因富集单位为2,以P<0.05为有意义,最终得到 286个BP、81个MF和 34个CC。利用Cytoscape对其进行KEGG富集,设置Kappa score为0.4,最小富集单位为3,筛选P<0.05的结果,最终得到83条通路,包括卵巢类固醇生成、磷脂酰肌醇3激酶 /蛋白激酶B(PI3K/Akt)信号通路、IR信号通路、雌激素信号通路、子宫内膜癌等通路(图3)。为进一步探索丹栀逍遥散治疗PCOS的相关通路作用机制,通过KEGG中的KEGG Mapper,把核心靶点映射到相关通路中,最终得到多个通路图,图4为其中的一条卵巢类固醇激素生成通路图,绿色标识为丹栀逍遥散的核心靶点。
3 讨论
丹栀逍遥散为中医古籍的经典方剂,但和其他中医方剂一样,中药成分的复杂性导致其难以解释药物治疗疾病的具体作用机制。通过生物信息学构建药物和疾病的互作网络,整合药物作用的靶点,对药物的作用机制及开发有一定的指导意义。

图2 药物与疾病核心靶点交互作用的PPI网络
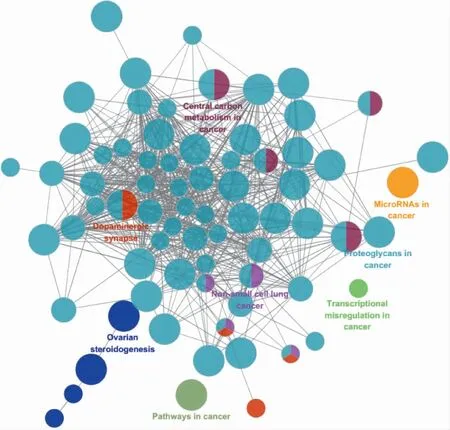
图3 Cytoscape中ClueGO对核心靶点富集出的KEGG通路图
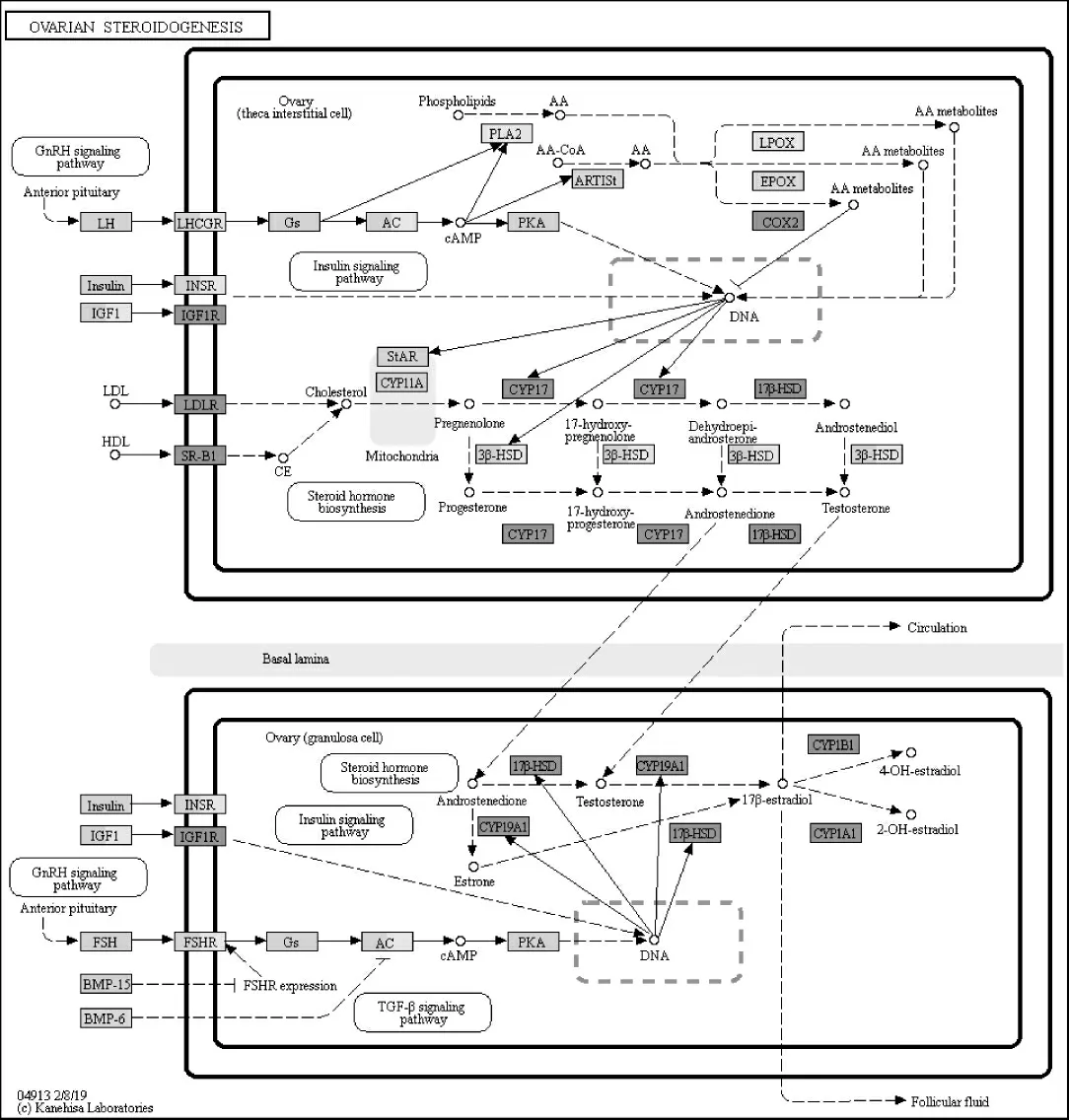
图4 卵巢类固醇激素生成通路图,绿色标识为本研究中的核心靶点
丹栀逍遥散作为治疗PCOS常用的方剂之一,对于PCOS以高雄激素血症为主要表现的患者有较好的治疗效果,本研究运用网络药理学的方法探索本方疗效的物质基础和分子机制。
3.1 化合物作用靶点 目前已经有关于本方中关键化合物对PCOS的作用机制研究。槲皮素(quercetin)是一种黄酮类化合物,为柴胡、栀子、牡丹皮及甘草的共有的化合物。已经证明槲皮素可以促进肝脏己糖激酶(HK)和葡糖激酶(GK)活性,并降低 PCOS大鼠白介素 1β(IL-1β)、白介素 6(IL-6)和肿瘤坏死因子α(TNF-α)的水平,改善大鼠的胰岛素抵抗(IR)状态[10-11]。它还可以增加PCOS模型大鼠子宫的雌激素受体α(ERα)和葡萄糖转运蛋白 4(GLUT4)基因的表达[11],这可能是PCOS合并不孕的新的治疗方向。同样在人体也已经证明口服槲皮素可以通过上调脂联素受体和激活AMP激活蛋白激酶(AMPK)改善患者的IR状态[12-13]。
芍药苷(paeoniflorin)可以抑制大鼠卵巢睾酮的合成,并对刺激大鼠卵巢芳香酶活性以促进雌二醇合成[14],还能促进脂肪细胞腺苷的释放,激活腺苷A1受体,增加葡萄糖的摄取[15]。
黄芩苷(baicalin)可以通过抑制PCOS模型大鼠的卵巢HSD3B2基因表达,降低雄激素的生成[16],还能上调葡萄糖转运蛋白2(GLUT2)和GLUT4的表达,刺激肝细胞对细胞外葡萄糖浓度的瞬时响应和长期响应,对葡萄糖转运进行精细调控,从而改善肝IR状态[17]。
茯苓酸(pachymic acid)可以调节IL-6、TNF-α抑制PCOS的炎症状态,减少氧化应激,改善IR,减少卵巢颗粒细胞的凋亡,促进卵泡发育[18]。藏红花酸(crocetin)作为一种天然类胡萝卜素,能改善肥胖诱导的IR[19],还可以调节PCOS小鼠的动情周期,恢复其紊乱的激素水平,从而促进排卵[20]。
以上各类化合物以及其他山柰(kaempferol)、柚皮素(naringenin)等均能通过不同的途径改善PCOS的高雄激素血症/IR/低度炎症情况,体现了丹栀逍遥散治疗PCOS多成分、多靶点的特点。
3.2 核心靶点的富集分析 对核心靶点的GO富集分析提示丹栀逍遥散作用于PCOS可能与甾体激素合成、细胞增殖、氧化还原等多个BP过程有关。MF层分析其涉及到酪氨酸激酶、类固醇激素、ATP等;CC层面分析提示其涉及到细胞膜、内质网膜、细胞质、受体复合物及膜筏等多细胞成分。
在对核心靶点的KEGG富集分析中,进一步体现了丹栀逍遥散通过多个通路对PCOS产生作用,包括氧化应激、激素合成、代谢等多个方面,涉及到PI3K/Akt、丝裂原活化蛋白激酶(MAPK)、甾体激素合成及胰岛素等多个信号通路。
IR作为PCOS病机的关键之一,不仅存在于PCOS患者的外周组织中,同时也表达于卵巢及子宫内膜局部,降低患者的受孕机率并增加流产风险。胰岛素信号传导通路主要有2条,一条为PI3K/Akt途径。当胰岛素与胰岛素受体结合,促进胰岛素受体底物(IRS)磷酸化,进而激活PI3K,生成第二信使PIP3,激活下游的Akt,调节糖代谢。PCOS患者的胰岛素受体底物-1(IRS-1)介导的PI3K活性下降以及葡萄糖转运蛋白4(GLUT4)减少,造成IR状态[21]。同时,PCOS-IR患者的胰岛素可能通过PI3K/Akt通路促进子宫内膜的异常增生[22]。另一条为丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK/ERK)促有丝分裂通路。当PCOS-IR时,2条信号通路失衡,MAPK/ERK活化,导致PI3K/Akt信号通路缺陷,可以进一步促进IR 形成[23]。
目前的研究已经证实PCOS患者存在代谢性炎症状态,且其代谢性炎症可进一步促进患者的代谢紊乱。而PI3K/Akt通路不仅与PCOS的胰岛素代谢有关,还与PCOS患者的炎症及氧化应激状态相关,Zhao等人[24]利用特异性抑制剂探索 NF-κB、Akt、JNK、Erk1/2等通路,发现WNT5a主要依赖于PI3K/Akt/NF-κB信号通路诱导PCOS患者的炎症及氧化应激。
高雄激素血症表现的痤疮、脱发、油脂分泌旺盛等中医多辨证为肝郁化火,治以丹栀逍遥散多有疗效。已用实验证明丹栀逍遥散能降低PCOS瘦素水平,抑制AMH分泌等,从而改善高雄激素血症[3,25]。另外根据关键靶点的KEGG通路图所知(如图4所示),丹栀逍遥散降雄的机理可能与 CYP17、CYP19A1、CYP1B1、17β-HSD 等有关。CYP17主要调节17α-羟化酶和17,20-裂解酶活性,为雄激素合成的关键酶。PCOS患者的17α-羟化酶活性增加而17,20-裂解酶活性下降,致使两者活性失调从而引起雄激素合成增加[26]。CYP17可能为丹栀逍遥散作用的重要靶点之一,具体需待进一步实验认证。
综上所述,网络药理学结果提示丹栀逍遥散在治疗PCOS上共涉及到142个活性成分、84个核心靶点,其作用机制包括甾体激素合成、氧化还原等,涉及到卵巢类固醇生成、PI3K/Akt、IR等多个信号通路,体现了中药治疗疾病的多中心、多靶点、多途径的作用特点。本研究涉及到的部分靶点及分子机制已被相关研究证实,另有一部分挖掘出的靶点及相关通路可作为下一步研究的理论基础,为丹栀逍遥散的作用机制的进一步研究提供方向。

