菲衍生物制备与聚集态诱导紫外荧光研究
周立伟, 王筱梅
(苏州科技大学 化学生物与材料工程学院,江苏 苏州 215009;江苏省环境功能材料重点实验室,江苏 苏州 215009)
有机发光分子在稀溶液中荧光强度高、在聚集态(固态)时发光强度减弱,这一荧光淬灭现象是由于分子团聚所致。在有机发光器件的制作中发光材料需要镀膜,因此,这种荧光淬灭不可避免。如何克服荧光的浓度效应、降低聚集态荧光淬灭、提高固态材料的发光强度曾经是光电材料领域的难题。2001年,唐本忠教授团队首次发现分子硅杂环噻咯(Silole)在溶液态时几乎不发光,但是在形成聚集态或是固态时,其发光效果骤然增强,并将这一现象命名为聚集诱导发光(Aggregation Induced Emission Enhancement,AIEE)[1]。此后,唐本忠教授团队又不断发现了一系列AIEE材料[2-7]。2017年度由唐本忠领衔的“聚集诱导发光”科研成果获国家自然科学奖一等奖(编号Z-103-1-01)。2003年,该课题组首次发现四苯乙烯衍生物具有固态荧光增强现象,这种现象的出现,是由于烯烃双键两侧连接4 个取代基,从而导致邻位基团的空间位阻增大,有效遏制了双键的自由旋转所致。迄今为止,已报道的AIEE材料的发光波段从蓝光到红光覆盖整个可见光波段[8-16],尚未见在紫外发光区域的AIEE材料的报道。
据此,笔者制备了两种取代菲衍生物以期获得紫外发光的AIEE材料。
1 实验部分
1.1 试剂及仪器
苯硼酸、9-溴菲、9,10-二溴菲、四三苯基膦钯催化剂均为市售试剂,光谱测试中使用的所有测试溶剂在测试前均经过重蒸纯化处理。
核磁共振谱由Bruker600MHz 型核磁共振仪测得,质谱由INOVA400(EI)质谱仪测得,紫外-可见吸收光谱在UV-VisTu-1800 spc 紫外分光光度计上测定,稳态荧光光谱在英国Edinburgh920 型稳态/瞬态荧光光谱仪上测定。
1.2 实验步骤
1.2.1 9-苯基菲合成 在50 mL 三颈烧瓶中加入9-溴菲(1 g,3.889 mmol)、苯硼酸(451.6 mg,3.704 mmol)、二恶烷(20 mL)、2 mol·L-1碳酸钾溶液(10 mL,20 mmol)以及磁力搅拌子,抽真空并通氮气,再加入四三苯基膦钯(Pd[P(C6H5)3]4)(224.8 mg,0.1945 mmol)。在氮气保护下加热到110 ℃反应,使用油封观察通氮气速率。经过检测测得苯硼酸完全反应后,停止反应。
产物经过萃取后,加入无水硫酸镁干燥过夜,抽滤后经硅胶层析柱提纯,展开剂选择纯石油醚。干燥称重。最终得9-苯基菲为白色固体粉末0.46 g,产率为48.9%,熔点:137.3~138.5 ℃;1H NMR(DMSO-d6,400 MHz):δ,ppm 8.94 ~8.96(m,1H,Ar-H),8.88 ~8.90(m,1H,Ar-H),8.03 ~8.05(m,2H,Ar-H),7.50 ~7.84(m,11H,Ar-H);LC-MS:254.1(M+)。1.2.2 9,10-二苯基菲合成 9,10-二苯基菲的合成与9-苯基菲的合成类似,只需将9-溴菲改为9,10-二溴菲即可,最后得到白色固体粉末0.79 g,产率约53.8%,熔点:169.1~170.2 ℃;1H NMR(CDCl3,400 MHz) δ,8.82 (d,J =8.3 Hz,2H),7.67 (t,J =7.6 Hz,2H),7.56 (d,J =7.3 Hz,2H),7.49 (t,J =7.5 Hz,2H),7.26 ~7.12(m,10H);LC-MS:331.2(M+)。
1.3 测试条件
使用UV-VisTu-1800 spc 吸收光谱仪测定紫外-可见吸收光谱、 英国Edinburgh920 型荧光光谱仪测定稳态/瞬态光谱。荧光量子产率根据公式(1)[17]计算,其中Φs和Φr分别为样品和参比物的荧光量子产率;As和Ar分别为样品和参比物的吸光度;Fs和Fr为样品和参比物的荧光积分面积;ns和nr为样品和参比物溶液的折射率。选用POPOP (1,4-双[2-(5-苯基)恶唑基]苯)为参比物(Φf=0.97),激发波长为300 nm。

式中,s 表示待测物质;r 表示参比物;f 表示荧光。
2 结果与讨论
2.1 吸收光谱
图1 为9-苯基菲(a)与9,10-二苯基菲(b)在不同溶剂中的紫外吸收光谱。由图1 可知,9-苯基菲和9,10-二苯基菲均表现出两个吸收带,分别位于~255 nm 和~300 nm 处,位于短波长的吸收带(255 nm)是由菲母体引起,而后者则为分子内电荷转移吸收带,即为ICT(Intramolecular Charge Transfer)吸收带。可见,随着溶剂极性的增加,两者的ICT 吸收带均出现了1~2 nm 的红移,且9-苯基菲与9,10-二苯基菲的ICT 带的吸收峰位位移不大;特别是,位于短波长的吸收带的吸光度明显高于ICT 吸收带的吸光度,这些光谱特征表明,9-苯基菲和9,10-二苯基菲分子,基态时苯环和菲环并不在同一个共轭平面,分子呈现明显的扭曲构型。
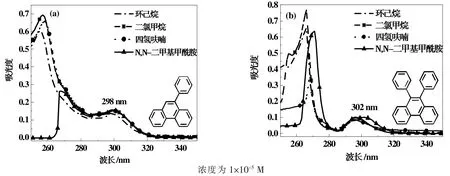
图1 9-苯基菲与9,10-二苯基菲在不同溶剂中的紫外吸收光谱
2.2 荧光光谱
图2 为9-苯基菲在不同溶剂中的荧光发射光谱。当9-苯基菲溶于环己烷溶剂时,其荧光发射峰呈现三重峰结构,两个发射峰位于353 nm 与368 nm 处。随着溶剂的极性由二氯甲烷、四氢呋喃到N,N-二甲基甲酰胺(DMF),9-苯基菲的三个荧光发射峰位略呈红移趋势, 而荧光强度则明显降低。计算得荧光量子产率(Φf)数据表明,随着溶剂极性增大Φf值明显降低,即由48.5%(环己烷)、42.8%(二氯甲烷)、42.6%(四氢呋喃)降低至41.1%(DMF),见表1。这可以解释为,9-苯基菲分子的基态极性小于其激发态极性。在极性强的溶剂中,该分子激发态的稳定化作用大于基态,导致激发态能级降低的程度更大,所以荧光峰位发生了红移;且因为能隙的变小,将减弱荧光分子的辐射跃迁,减弱分子的荧光强度。
图3 为9,10-二苯基菲在不同溶剂中的荧光发射光谱。由图3 可知,当9,10-二苯基菲溶于环己烷溶剂时,其荧光发射峰呈现三重峰结构,两个主发射峰位位于356 nm 与378 nm 处;相比于9-苯基菲有所红移,这是由于双取代衍生物的共轭效应所致。然而,随着溶剂的极性由二氯甲烷、四氢呋喃到N,N-二甲基甲酰胺(DMF),9,10-二苯基菲的三个荧光发射峰位略呈蓝移趋势(蓝移了~3 nm),更可贵的是荧光强度明显增大,表现出与9-苯基菲截然不同的溶剂效应(如图2 所示)。
计算所得荧光量子产率(Φf)数据表明,随着溶剂极性增大Φf值明显提高, 即由34.2%(环己烷)、39.9%(二氯甲烷)、42.5%(四氢呋喃)提高至43.0%(DMF),见表1。出现这种现象是因为双取代衍生物(9,10-二苯基菲)分子的基态极性大于其激发态极性,使得在极性强的溶剂中,分子的基态稳定化作用将大于激发态,导致基态能级降低的程度更大,荧光峰位发生蓝移。由于能隙变大,将增大荧光分子的辐射跃迁,有利于提高荧光强度。

图2 9-苯基菲在不同溶剂中的荧光发射光谱

图3 9,10-二苯基菲在不同溶剂中的荧光发射光谱
2.3 聚集态光谱
为测试聚集态光谱行为,分别在不同比例的N,N-二甲基甲酰胺/水(DMF/H2O)(v/v)混合溶剂(10% H2O;20% H2O;30% H2O;40% H2O;50% H2O;60% H2O)中测试目标分子的吸收与荧光光谱,确定聚集态形式和最佳荧光增强特性。

表1 菲衍生物在不同溶剂中及聚集态时荧光量子产率(Φf)对比 %
图4 为9-苯基菲(a)与9,10-二苯基菲(b)在不同比例的DMF/H2O 混合溶剂中紫外吸收光谱。
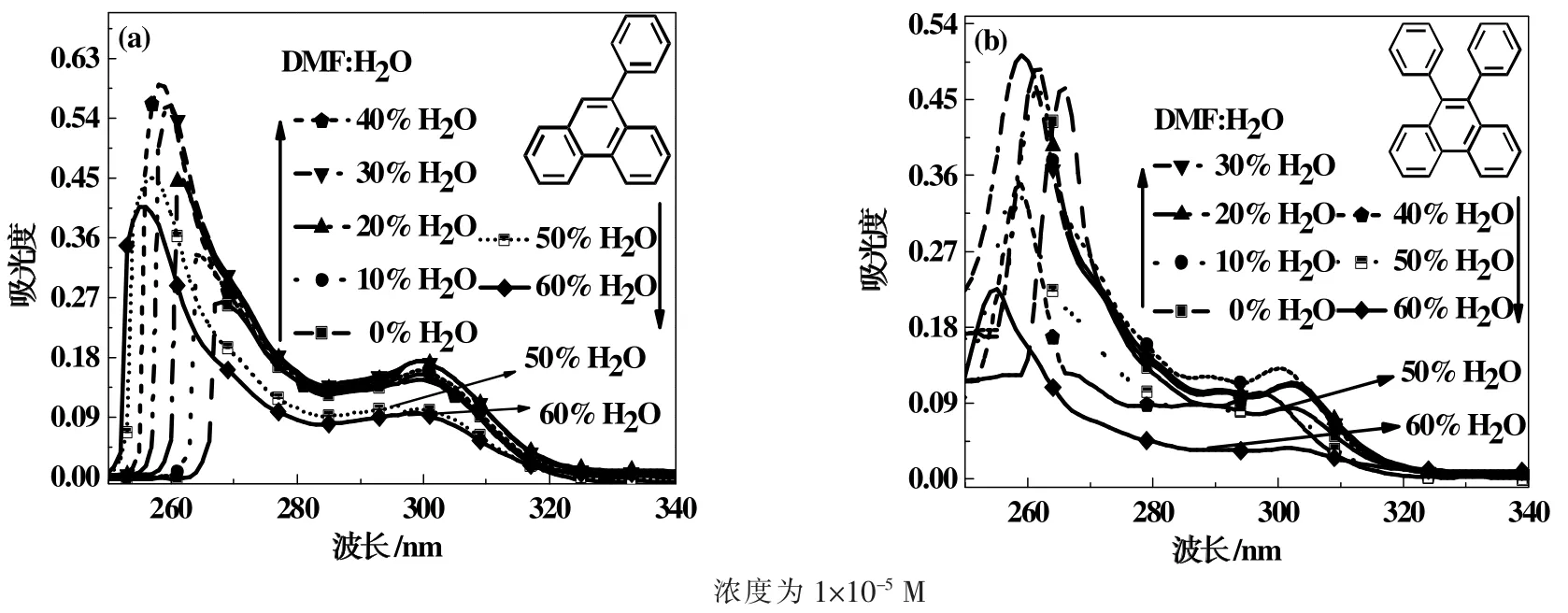
图4 9-苯基菲与9,10-二苯基菲在DMF/H2O 溶剂中的紫外吸收光谱
由图4(a)可见,9-苯基菲在纯DMF 溶剂中的吸收光谱呈双吸收峰(分别位于266 nm 和298 nm 处);加入10%水后,位于短波长区的吸收带(归属于母体菲的吸收带)的峰位急剧发生蓝移至260 nm 处,而长波长区域吸收带(ICT 吸收带)尚未发生位移;继续增加含水量(20%~60%),此时母体菲的吸收带渐渐红移,但与纯DMF 溶剂中相比,母体菲的吸收带依然呈现出明显的蓝移趋势,且ICT 吸收带也略有蓝移。当含水量从10%增加到40%,9-苯基菲的吸光度逐渐增加, 表示聚集体的基态到激发态的跃迁几率增大; 当含水量从50%增加到60%,9-苯基菲的吸光度逐渐降低,这是由于含水量增大导致化合物颗粒开始沉淀所致。由图4(b)知,9,10-二苯基菲具有类似的光谱行为,即随着体系含水量逐渐增加时,吸收峰位均产生明显蓝移。
化合物聚集态是由分子间非共价键互为作用而形成的分子聚集体, 分为H-聚集体和J-聚集体两种[18]。前者为分子之间呈现面对面(face-to-face)平行排列且吸收峰位蓝移,后者为分子之间为头对尾(head-totail)的排列且吸收峰位红移。图4 的吸收光谱表明了菲衍生物均形成了H-聚集体,由于发光分子呈现为面对面平行排列,不但加强了分子之间π-π 相互作用也增强了分子的刚性,这将有利于提高分子的荧光强度。
图5 为9-苯基菲(a)与9,10-二苯基菲(b)在不同比例DMF/H2O 混合溶剂中的荧光光谱图。
由图5(a)可见,9-苯基菲在纯DMF 溶剂中,其ICT 发光带为双荧光峰,分别在354 nm 和371 nm 处。当体系中的含水量不断增加,溶质的溶解度变差导致分子开始聚集(由于不良溶剂的加入);此时荧光强度在逐步上升,直至含水量增加至50%时,9-苯基菲的荧光强度增加至最大,约为初始荧光强度的3 倍以上。继续增加溶液的含水量时荧光强度不再增加达到饱和;当含水量增加到60%以上时,荧光强度开始下降,这是由于含水量增大导致化合物颗粒开始沉淀,体系中发光分子数目减少导致,但仍高于初始时(即分子态)的荧光强度,尤其是9-苯基菲在纯固态时的荧光强度仍然高于分子态的荧光强度。重要的是,化合物在聚集态的发光峰位与分子态相比只略微发生红移,从而获得聚集态诱导紫外荧光增强特性。
由图5(b)可见,9,10-二苯基菲与9-苯基菲具有类似的光谱现象。当体系中的含水量不断增加时,ICT发光带荧光强度显著上升; 到含水量增加至30%时, 荧光强度增加至最大(约为初始荧光强度的1.5 倍以上)。继续增加含水量,9,10-二苯基菲的荧光强度开始下降;含水量增加至60%时,其荧光下降但依然高于初始时(分子态)的荧光强度。计算得到聚集态荧光量子产率为:9-苯基菲(50.2%)>9,10-二苯基菲(43.9%),见表1。9-苯基菲随着溶剂极性增加,荧光量子产率降低,而9,10-二苯基菲则随着溶剂极性增加,荧光量子产率升高,这是由于这两种分子基态极性与激发态极性不同所致。而9,10-二苯基菲聚集态发光效果不明显的原因是9,10-二苯基菲分子的扭曲程度高,不能形成刚性共轭平面,导致分子间π-π 作用力减弱。
3 结语
合成了两种菲衍生物(9-苯基菲和9,10-二苯基菲),进行了核磁、质谱表征以及紫外吸收光谱与荧光光谱的性能研究。两种化合物表现出不同的溶剂效应,9-苯基菲随着溶剂极性增加, 荧光量子产率降低,而9,10-二苯基菲则随着溶剂极性增加,荧光量子产率升高,这是由于这两种分子基态极性与激发态极性不同所致。聚集态性能研究表明,9-苯基菲表现出的AIEE 紫外荧光增强特性,Φf值由41.1%提高至50.2%,而9,10-二苯基菲的聚集态诱导性能不明显,其原因是9,10-二苯基菲分子的扭曲程度高,不能形成刚性共轭平面,导致分子间π-π 作用力减弱。

