同轴电喷法制备BSA-PLGA核壳微球
周天水, 崔荣煜, 史紫千, 冯 芳
(苏州科技大学 化学生物与材料工程学院,江苏 苏州 215009;江苏省环境功能材料重点实验室,江苏 苏州 215009)
近年来,可生物降解聚合物被不断地应用到制备微球制剂中,其中聚酯类高分子材料作为载体材料包裹蛋白、多肽等药物来进行控制释放研究,尤其是聚乳酸-羟基乙酸共聚物材料被研究得最多。聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是由乳酸和羟基乙酸按比例共聚形成的高分子材料,具有良好的生物相容性、无毒性及可生物降解性[1],该材料被美国FDA 批准应用于临床。聚乳酸-羟基乙酸共聚物(PLGA)包载蛋白、多肽等药物制成缓释药物微球可以解决口服药易降解、减少给药次数等问题[2],其降解产物为H2O 和CO2[3-5],对蛋白类无明显影响。由于蛋白、多肽等分子药物稳定性差,在负载过程中易流失,因此,笔者首次采用同轴电喷法实现羟乙基壳聚糖和透明质酸形成的凝胶溶液为蛋白、多肽类药物提供亲水环境,从而有利于保持药物活性,避免药物大量流失。相比较其他微球制备方法,同轴电喷法[6-7]一步到位实现微球制备及包载药物,并且具有单分散性、可重复性、微球尺寸可控性等优势,在药物控释领域具有较高的应用前景。以往微球制备研究多集中在乳化法制备工艺对微球形态的影响,而对于使用电喷法来制备核壳结构的凝胶内核微球的制备工艺的综合研究较少。
笔者以牛血清蛋白(BSA)为模拟蛋白,PLGA材料为模拟蛋白载体,采用同轴电喷法来制备BSA-PLGA微球,研究了四种电喷参数对微球形貌及粒径的影响,验证了使用羟乙基壳聚糖和透明质酸形成的凝胶溶液稳定BSA 制备出PLGA 微球的形貌良好,粒径较均一,激光共聚焦扫描显微镜表征了微球的核壳结构。
1 实验部分
1.1 主要试剂及仪器
聚乳酸-羟基乙酸共聚物(PLGA),山东省医疗器械研究所;牛血清白蛋白(BSA),南京生兴生物科技有限公司;二氯甲烷(DCM),分析纯,苏州华丽达精细化工有限公司;透明质酸钠(HA),阿拉丁试剂有限公司;羟乙基壳聚糖,分析纯,阿拉丁试剂有限公司;蒸馏水,自制。
场发射扫描电子显微镜,S-4800,QUANTAFEG,日本日立公司;微量注射泵,TJ-3A/LSP01-1A,保定兰格恒流泵有限公司;激光共聚焦扫描显微镜,OLYMPUS,徕卡显微系统(上海)贸易有限公公司;电喷装置,四个部分,自组。
1.2 载BSA的PLGA微球制备
称取一定量的PLGA 溶解到二氯甲烷溶剂中,通过磁力搅拌使其完全溶解,配置的PLGA 溶液作为壳层溶液;称取一定量的透明质酸、羟乙基壳聚糖、牛血清蛋白,将其完全溶于蒸馏水中,作为核层溶液。用注射器分别将核层、壳层溶液吸入其中,接入同轴金属针管,再施加一定的电压,调整接收距离、流速比等,在接收载台的铝箔纸上接收微球,冷冻干燥后得到PLGA 载BSA 微球,密封冷冻保存。制备过程中使用同轴电喷雾法把PLGA 溶液和BSA 凝胶液分别通入注射器,注射器与喷头连接,同轴喷射头由内外层管道形成同心圆柱。在一定电压下,同轴针管口与接收载台处形成电场力,针管口处可以观测到形成锥射流即Taylor 锥。
1.3 制备条件对PLGA微球的影响
同轴电喷制备过程中,以羟乙基壳聚糖和透明质酸钠形成的凝胶作为内核材料,PLGA 作为外壳材料进行同轴电喷,考察电喷电压、壳层溶液浓度、进样速度和凝胶内核溶液浓度等参数对PLGA 微球形貌、粒径及分布的影响。采用单因素分析,研究高分子溶液浓度、电压、推进速度、接收距离对微球表面形态的影响,从而优化出制备微球的最佳条件。制备条件如下:以二氯甲烷为溶剂,壳流速为2 mL·h-1,电压为10 kV,接收距离为15 cm,改变PLGA 溶液浓度进行考察微球形貌。固定PLGA 浓度为10%,壳流速为2 mL·h-1,接收距离为15 cm,改变电压进行考察微球形貌。固定PLGA 浓度为10%,电压为10 kV,接收距离为15 cm,改变溶液壳层流速考察微球形貌。固定PLGA 浓度为10%,电压为10 kV,壳流速为2 mL·h-1,改变接收距离来考察微球形貌。实验中PLGA 溶液浓度为质量体积比。
1.4 SEM测试与粒径统计
把收集载台上的微球样品喷金置于S4800 扫描电镜下观察其形貌。并用Image-pro Plus 软件分析电镜图片,统计平均粒径。
1.5 激光共聚焦测试
使用激光扫描共聚焦显微镜来扫描微球。
2 结果与分析
2.1 电喷溶液浓度对微球形貌、粒径及分布的影响
不同PLGA 电喷溶液浓度下的SEM图如图1 所示。
在电喷实验中,当PLGA 浓度在8%以下时,得不到完整的颗粒。当PLGA 溶液浓度为8%~10%时,可以看出微球颗粒表面趋于光滑, 颗粒与颗粒之间存在少量粘连纤维。当溶液浓度达到10%~12%和12%~14%时,颗粒由圆形逐步变成椭圆形并且颗粒间粘连很多,有研究提及PLGA 浓度过大后容易出现串珠结构[8]。浓度为12%时,电场力克服表面张力形成射流,产生了形如哑铃形状射流,两个大液滴连在一条细射流上, 且随着聚合物浓度进一步加大,粘滞力也随之增大,颗粒越发不成球形态,哑铃形逐渐向纤维形状转变。对PLGA 溶液浓度为6%、8%、10%时进行微球直径及分布统计,详见图2。随着PLGA 浓度的增大,颗粒由椭球形逐步变成纺丝状,粘度升高,表面张力无法降低其粘性,无法形成球形而呈现出纺丝形态。不同PLGA 浓度下的粒径分布如图2所示。由图2 可知,当PLGA 溶液浓度为10%时,颗粒表面趋于正圆形,制得的PLGA 微球形貌及变化趋势与Xie 等人[8]研究结果相似,所以笔者选用10%的PLGA 溶液来制备颗粒,颗粒表面光滑,呈现良好的分散性,适合制备微球。
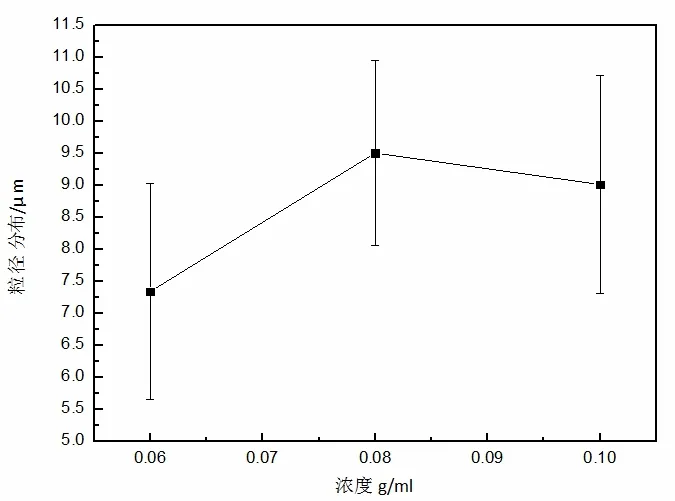
图2 不同PLGA 浓度下制备微球的粒径分布
2.2 负载电压对微球形貌、粒径及分布的影响
不同电压下制备微球的SEM图如图3 所示。

图3 不同电压下制备微球的SEM图
图3 中的不同电压下微球之间存在一些连接细纤维,主要还是由于刚刚喷射时,喷头处射流不稳定以及在接收台左侧铁质仪器对其有一定的牵引力,但是从图中可以看出基本呈现微球形态。在8、9 kV 时,针头处射流不稳定,微球少些呈现椭圆形且有一些粘连。在12 kV 左右时,微粒间纤维连接过大,微粒大部分呈现椭圆形,可能电压过大导致了射流不稳定,无法形成均一的微球。随着电压增大,微球粒径基本呈现出变大趋势,粒径分布很集中。随着电压的增加,颗粒粒径逐步减小,粒径与电压呈负相关,电压从8 kV 增加到12 kV,电压增加,粒径减小,这与Tang 等人[9]研究结果基本一致。
从图4 不同电压粒径结果中可以看到,随着电压的不断升高,聚合物微球粒径呈现变大趋势,当电压达到一个上限时,分裂出的射流数量增多,微球粒径有些减小。在8 kV 电压及以下,电场力不足以克服液滴表面张力,喷射出的大都是大液滴形状,不能形成微球形态。在电压大于12 kV 后,可以看出由于电压过大产生多股射流并且造成的喷射流不稳定。由此文中将选定10 kV 电压来制备PLGA 微球。
2.3 溶液进样速度对微球形貌、粒径及分布的影响
不同进样流速下制备微球的SEM图如图5 所示。
壳层溶液的进样速度从1 mL·h-1开始,当流速为1 mL·h-1时,从图5 中可以看出,已开始电喷出微球颗粒,但是大多数不能呈现球态而是纤维丝状, 当流速从1.5 mL·h-1增大到2.5 mL·h-1时,可以从图中看出,随着流速不断增大,产生的微球颗粒的粒径也呈现增大趋势,在2 mL·h-1时流速下,电喷产生的微球形貌良好,微球表面光滑。当流速增大到3 mL·h-1时,从图5e 中可以看到,微球粒径变小,由于电喷过程中,流速已经超过了最大极限流速,导致颗粒由球形向椭球形转变,且微球颗粒之间的粘连也不断增大。
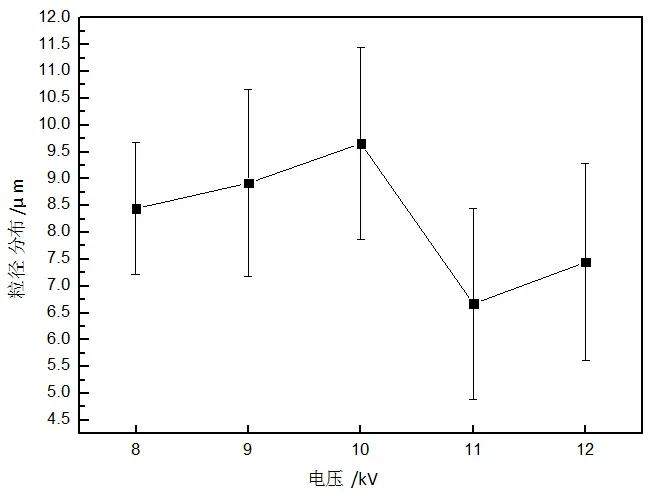
图4 不同负载电压下制备微球的粒径分布
图6 也明显反映出微球粒径随着流速的变化趋势。研究发现随着壳层流速的增大,微球粒径也随之增大,该变化趋势与Xu 等人[10]研究相同,但是发现微球当流速达到极限值时,出现了拐点,在3 mL·h-1时,粒径变小,微球颗粒已不能呈现良好的球行。所以文中选定壳层流速2 mL·h-1为最佳流速。
2.4 接收距离对微球形貌的影响
接收距离对微球形貌的影响如图7 所示。
接收距离在13 cm 以下并不能制备出微球。从图7 中可见,随着接收距离不断增大,从13 cm 开始微球的形貌发生很大变化,从一开始的椭圆形向球形转变,当接收距离从16 cm到17 cm 的变化中可以看出,已经基本不能够制备出微球,基本呈现纺丝状,超出了最佳的接收距离范围,从17 cm 往后只能电喷得到纺丝状,由此文中选择15 cm 为最佳的接收距离。
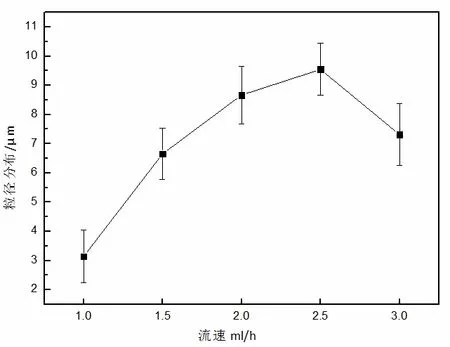
图6 不同进样流速下制备微球的粒径分布

图7 不同接收距离下制备微球的SEM图
2.5 优化条件下制备的微球形貌
优化条件下制备的微球形貌如图8 所示。
在最佳的优化条件: 壳流速为2 mL·h-1,PLGA 浓度为10%,电压为10 kV,接收距离为15 cm 等条件下制备出如图所示的PLGA 微球。由图8 可见,在这样的条件下制备出的微球比较分散,基本呈球形,表面光滑。

图8 优化条件下制备BSA-PLGA 微球在不同放大倍数下的电镜形貌图
2.6 共聚焦显微镜下的微球形貌
共聚焦显微镜下的微球形貌如图9 所示。
通过在凝胶内核溶液中加入牛血清蛋白(BSA),并使用优化条件来制备出BSA-PLGA 微球,其中牛血清蛋白(BSA)的浓度为5%,分别在激发波长下和白光下对BSA-PLGA 微球进行激光共聚焦的表征。从图9a 可知,能够看到分散的内核光点, 这是由于牛血清蛋白具有荧光性,可以发出绿光,在图中呈现光亮内核。通过图9a 荧光图和图9b 白光图的对比, 载药微球已完全包裹住牛血清蛋白, 并且从图9a 和图9b 中看出,壳层已经完整覆盖内部,形成圆环,表明制备出了核壳结构微球。
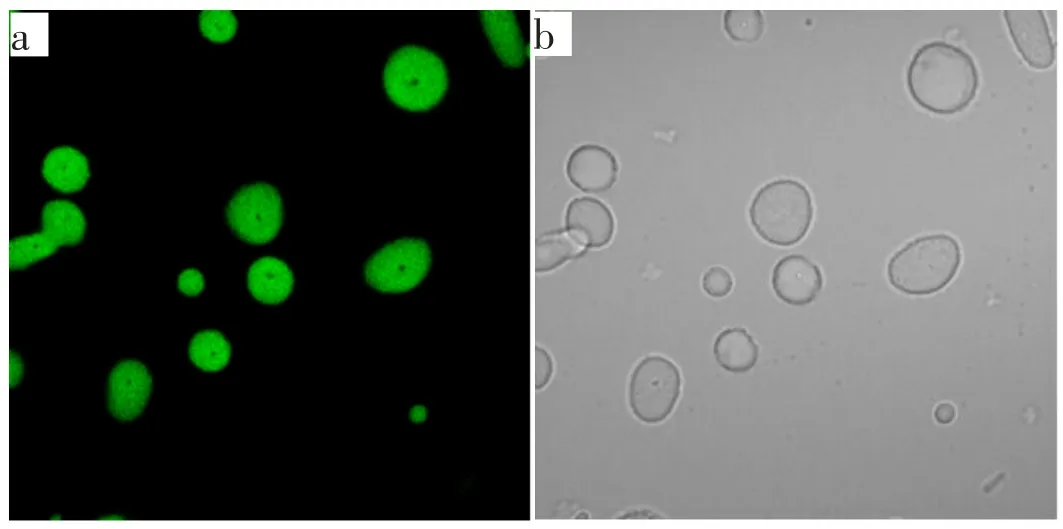
图9 优化条件下BSA-PLGA 微球的共聚焦显微镜图
3 结语
(1)通过同轴电喷雾法制备出BSA-PLGA 微球。通过对聚合物浓度、壳层流速、负载电压、接收距离等参数的优化实验,得到最佳的优化条件:PLGA 浓度为10%,壳流速为2 mL·h-1,负载电压为10 kV,接收距离为15 cm。(2)通过优化条件下制备BSA-PLGA 微球电镜图以及共聚焦显微镜图可以看到,制备出的微球粒径比较均匀,表面光滑,包裹的BSA 蛋白比较完整,没有出现结构破损现象。

